化学反应与能量的变化.docx
《化学反应与能量的变化.docx》由会员分享,可在线阅读,更多相关《化学反应与能量的变化.docx(17页珍藏版)》请在冰豆网上搜索。
化学反应与能量的变化
化学反应与能量的变化
一、焓变与反应热
1、定义:
在化学反应过程中放出或吸收的热量,通常叫做反应热,,又称为“焓变”
2、符号:
用
表示。
3、单位:
一般采用KJ/mol。
4、可直接测量,测量仪器叫量热计。
5、研究对象:
一定压强下,在敞口容器中发生的反应所放出或吸收的热量。
6、反应热产生的原因:
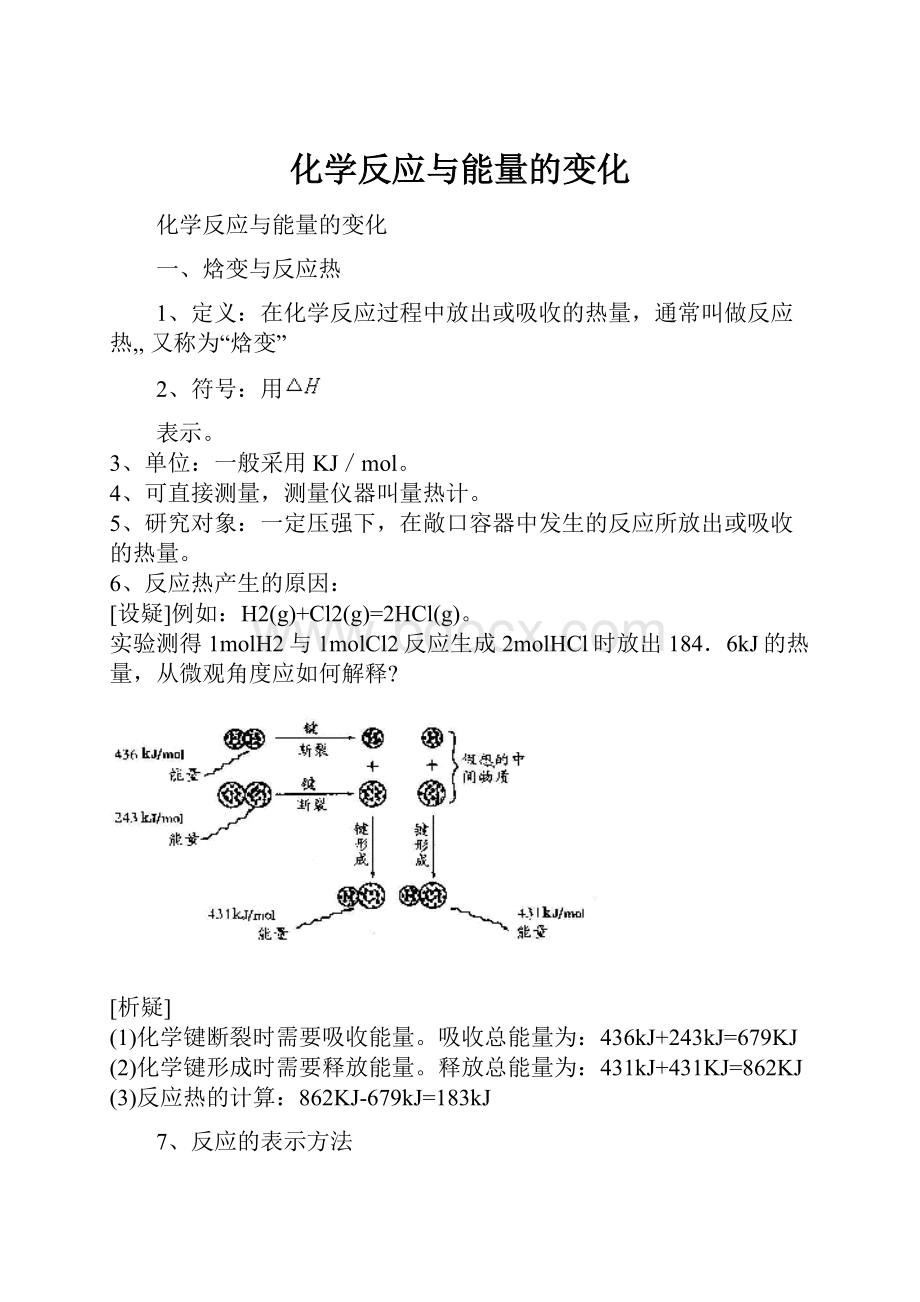
[设疑]例如:
H2(g)+Cl2(g)=2HCl(g)。
实验测得1molH2与1molCl2反应生成2molHCl时放出184.6kJ的热量,从微观角度应如何解释?
[析疑]
(1)化学键断裂时需要吸收能量。
吸收总能量为:
436kJ+243kJ=679KJ
(2)化学键形成时需要释放能量。
释放总能量为:
431kJ+431KJ=862KJ
(3)反应热的计算:
862KJ-679kJ=183kJ
7、反应的表示方法
(1)放热反应:
即有热量放出的化学反应,其反应物的总能量大于生成物的总能量。
(2)吸热反应:
即吸收热量的化学反应,其反应物的总能量小于生成物的总能量。
化学反应中的能量变化示意图对于该“示意图”可理解为下列形式:
放热反应ΔH为“—”或ΔH〈0吸热反应ΔH为“+”或ΔH〉0
8、△H计算的三种表达式
(1)△H==E(化学键断裂所吸收的总能量)—E(化学键生成所释放的总能量)
(2)△H==E(生成的总能量)–E(反应物的总能量)
(3)△H==反应物的键能之和–生成物的键能之和
注意:
化学键断裂或生成所吸收或放出的能量叫做化学键的键能。
反应键能越小,稳定性越弱,能量就越高破坏它需要的能量就越小;生成物的键能越大,稳定性越强,能量就越低,释放的能量就越大,故需要放出能量,△H为负,反应之为正。
△H有正负之分,因此比较△H大小时,要连同“+”、“-”包含在内,类似于数学上的正负数比较,如果只比较反应放出热量变化,则只比较数值大小。
【小结】若反应放热,说明反应物所具有的总能量>生成物所具有的总能量△H<0,反应物的稳定性<生成物的稳定性。
若反应吸热,说明反应物所具有的总能量<生成物所具有的总能量△H>0,反应物的稳定性>生成物的稳定性,物质所具有的总能量越高物质越不稳定。
二、热化学方程式
1.定义:
表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
如:
H2(g)+I2(g)
2HI(g);△H=-14.9kJ/mol
例题:
H2(g)+
O2(g)=H2O(g);△H=-241.8kJ/mol,表示lmol气态H2和
mol气态O2反应生成lmol水蒸气,放出241.8kJ的热量。
(在101kPa和25℃时)H2(g)十
O2(g)=H2O(l);△H=-285.8kJ/mol,表示lmol气态H2与
mo气态O2反应在101kPa和25℃时,生成lmol液态水,放出285.8kJ的热量。
[小结]描述在一定条件下,一定量某状态下的物质,充分反应后所吸收或放出热量的多少。
[意义]不仅表明了化学反应中的物质变化,页表明了化学反应中的能量的变化
2.书写热化学方程式的注意事项:
(1)需注明反应的温度和压强。
因反应的温度和压强不同时,其△H不同。
例如:
H2(g)+
O2(g)=H2O(g);△H=-241.8kJ/molH2(g)十
O2(g)=H2O(l);△H=-285.8kJ/mol
从上述两个热化学方程式可看出,lmolH2反应生成H2O(l)比生成H2O(g)多放出44kJ/mol的热量。
产生的热量为什么不同?
(2)要注明反应物和生成物的状态。
物质的聚集状态,与它们所具有的能量有关。
通常气体用“g”、液体用”l”、固体用“s”、溶液用“aq”,且热化学方程式通常不用“↑”、“↓”。
例如:
H2(g)+C12(g)=2HCl(g);△H=-184.6kJ/mol
H2(g)+
Cl2(g)=HCl(g);△H=-92.3kJ/mol
(3)热化学方程式各物质前的化学计量数不表示分子个数,它可以是整数也可以是分数。
对于相同物质的反应,当化学计量数不同时,其△H也不同。
[注意]热化学方程式是表示反应已完成的量,而不管反应是否真正完成。
△H与反应完成的物质的量有关,而方程式中化学计量数只表示物质的量的多少,并不表示物质的分子数或原子数,所以化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。
当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
[点击试题]
[例1]已知在25℃,101kPa下,1g
(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是
A.
;△H=-48.40kJ/mol
B.
;△H=-5518kJ/mol
C.
;△H=+5518kJ/mol
D.
;△H=-11036kJ/mol
答案BD
[例2]在同温同压下,下列各组热化学方程式中Q2>Ql的是()
A.2H2(g)+O2(g)=2H2O(g);△H=-Q1
2H2(g)+O2(g)=2H2O
(1);△H=-Q2
B.S(g)+O2(g)=SO2(g);△H=-Q1
S(s)+O2(s)=SO2(g);△H=-Q2
C.C(s)+
O2(g)=CO(g);△H=-Q1
C(s)+O2(g)=CO2(s);△H=-Q2
D.H2(g)+Cl2(g)=2HCl(g);△H=-Q1
H2(g)+
Cl2(g)=HCl(g);△H=-Q2
[解析]首先分析同一物质不同聚集状态转化时的能量变化,其次分析不同聚集状态在反应物中和在生成物中对反应热的影响,最后得出比较结论。
A中因H2O(g)→H2O(”放热,故Q2>Ql;B中S(S)→S(g)吸热,而且S在燃烧时必须由固态变为气态才能燃料,故Q2Q1;D中在聚集状态完全相同的条件下,可燃物H2的量与燃烧热的值成正比,因此Q2=1/2Q1[答案]AC。
[例3]已知(l)
=H2O(g)△H1=akJ·
(2)
=2H2O(g)△H2=bkJ·
(3)
=H2O(l)△H3=ckJ·
(4)
=2H2O(l)△H4=dkJ·
下列关系式中正确的是()
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
[解析]氢气跟氧气化合反应是放热反应,再根据反应物中的物质的量关系进行比较可以得出a、b、c、d之间的大小关系。
[答案]C。
[例4]、已知:
C(s)+O2(g)=CO2(g);
=-393.5kJ/mol
H2(g)+
O2(g)=H20(g);
=-241.5KJ/mol
欲得相同热量,需充分燃烧C和H2的质量比约为(A)。
A.12:
3.25B.3.25:
12C.1:
1D.6:
1
[分析]欲得相同热量,设C的质量为x(C),H2质量为y(H2),则有:
选项为A
[例5]、已知两个热化学方程式:
2H2(g)+O2(g)=2H20(l);
=-571.6KJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H20(l);
=-2220kJ/mol
实验测得H2和C3H8的混合气体共5mol,完全燃烧时放热3847KJ,则混合气体中H2与C3H8的体积比是(B)。
A.1:
3B.3:
1C.1:
4D.1:
1
[分析]设H2物质的量为n(H2),则n(C3H8)为5mol-n(H2),则有
·n(H2)+2220kJ/mol
[5mol-n(H2)]=3847kI,则,n(H2)=3.75mol;
n(C3H8)=1.25mol。
又因
,选项为B
三、中和反应反应热的测定
定义:
在稀溶液中,酸跟碱发生中和反应而生成1molH2O时的反应热叫中和热。
在中学阶段,只讨论强酸和强碱反应的中和热。
1、实验原理:
V酸=V碱=50mL。
c酸=0.50mol/Lc碱=0.55mol/L
ρ酸=ρ碱=1g/cm3c=4.18J/(g·℃)
Q=mcΔt ①
Q=(V酸ρ酸+V碱ρ碱)·c·(t2-t1)②
Q=0.418(t2-t1)kJ③
H+(aq)+OH-(aq)=H2O(l)
生成1mol水时反应热为
实验2-3:
在50mL烧杯中加入20mL2mol/L的盐酸,测其温度。
另用量筒量取20mL2mol/LNaOH溶液,测其温度,并缓缓地倾入烧杯中,边加边用玻璃棒搅拌。
观察反应中溶液温度的变化过程,并作好记录。
盐酸温度/℃NaOH溶液温度/℃中和反应后温度/℃
t(HCl)t(NaOH)t2
数据处理:
△H=Q/n=cm△t/n
其中:
c=4.18J/(g•℃),m为酸碱溶液的质量和,△t=t2-t1,t1是盐酸温度与NaOH溶液温度的平均值,n为生成水的物质的量。
2、注意事项:
1.大、小烧杯放置时,为何要使两杯口相平?
填碎纸条的作用是什么?
对此装置,你有何更好的建议?
答:
两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失;填碎纸条的作用是为了达到保温隔热、减少实验过程中热量损失的目的。
若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。
2.温度计上的酸为何要用水冲洗干净?
冲洗后的溶液能否倒入小烧杯?
为什么?
答:
因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差。
*
3.实验中所用HCl和NaOH的物质的量比为何不是1∶1而是NaOH过量?
若用HCl过量行吗?
答:
为了保证0.50mol/L的盐酸完全被NaOH中和,采用0.55mol/LNaOH溶液,使碱稍稍过量。
若使盐酸过量(氢氧化钠溶液极易吸收空气中的CO2,所以氢氧化钠物质的量偏多的部分与CO2反应了,因此保证了盐酸与氢氧化钠物质的量的比可达1:
1)。
4.酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
答:
因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而使误差增大。
5、实验中若用弱酸代替强酸,或用弱碱代替强碱,因中和过程中电离吸热,会使测得中和热的数值偏低。
6、要使用同一支温度计。
分别先后测量酸、碱及混合液的温度时,测定一种溶液后必须用水冲洗干净并用滤纸擦干。
温度计的水银球部分要完全浸入溶液中,且要稳定一段时间再记下读数。
7、实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。
8、操作时动作要快,尽量减少热量的散失。
9、实验时亦可选用浓度体积都不相同的酸碱溶液进行中和热的测定,但在计算时,应取二者中量小的一种,因为过量的酸碱并不参加中和反应。
基础提升
一、书写下列反应的热化学方程式
1、2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;
2、1g硫粉在氧气中充分燃烧放出9.36kJ热量,写出硫燃烧的热化学方程式。
3、燃烧ag乙醇(液态)生成CO2气体和液态H2O,放出热量为QkJ,经测定ag乙醇与足量Na反应能生成H25.6L(标准状况下),则乙醇燃烧的热化学方程式表示正确的是()
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H=-QkJ/mol
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H=-
QkJ/mol
C.
C2H5OH(l)+
O2(g)=CO2(g)+
H2O(l);△H=-QkJ/mol
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H=-2QkJ/mol
4、已知1mol甲烷燃烧放出890.3KJ的热量,在标准状况下,1m3甲烷完全燃烧可放出的热量为()
A、890.3KJB、39745.5KJC、1979KJD、19855KJ
5、燃烧ag乙醇(液态)生成CO2气体和液态H2O,放出热量为QkJ,经测定ag乙醇与足量Na反应能生成H25.6L(标准状况下),则乙醇燃烧的热化学方程式表示正确的()
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H20(l);
=-QkJ/mol
B.C2H50H(l)+3O2(g)=2CO2(g)+3H20
(1);
=-
QkJ/mol
C.
C2H50H(l)十
O2(g)=CO2(g)+
H2O(l);
=-QLJ/mol
D.C2H50H(l)十3O2(g)=2CO2(g)+3H20(l);
=-2QkJ/mol
6、已知金刚石、石墨燃烧的热化学方程式:
C(s、金刚石)+O2(g)=CO2(g);
=-395.4kJ/mol,
C(s、石墨)+02(g)=C02(g);
=-393.51KJ/mol。
则石墨转化为金刚石的反应热
=_____kJ/mol,两物质比较,石墨__较为稳定
答案:
6C、D7、B、C8、+1,9,石墨
巩固提升
1.下列说法正确的是()
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了放热还是吸热
D.吸热反应只能在加热的条件下才能进行
2.下列说法正确的是()
A.热化学方程式的计量数只表示分子的个数
B.热化学方程式中只需标明生成物的状态
C.反应热指的是反应过程中放出或吸收的热量
D.有能量变化的不一定是化学变化
3.根据热化学方程式:
S(l)+O2(g)=SO2(g)ΔH=-293.23kJ/mol分析下列说法中正确的是()
A.S(s)+O2(g)=SO2(g),反应放出的热量大于293.23kJ/mol
B.S(g)+O2(g)=SO2(g),反应放出的热量小于293.23kJ/mol
C.1molSO2的键能的总和小于1mol硫和1mol氧气的键能之和
D.1molSO2的键能的总和大于1mol硫和1mol氧气的键能之和
4.下列说法正确的是()
A.焓变是指1mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物质能量大于生成物能量时,反应放热,ΔH为“—”
5.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中放热最少的是()
A.2A(l)+B(l)=2C(g)ΔH1
B.2A(g)+B(g)=2C(g)ΔH2
C.2A(g)+B(g)=2C(l)ΔH3
D.2A(l)+B(l)=2C(l)ΔH4
6.热化学方程式中化学式前的化学计量数表示()
A.分子个数B.原子个数C.物质的质量D.物质的量
7.在相同温度和压强下,将32g硫分别在纯氧中和空气中完全燃烧,令前者热效应为
ΔH1,后者热效应为ΔH2,则关于ΔH1和ΔH2的相对大小正确的是()
A.ΔH1=ΔH2B.ΔH1>ΔH2C.ΔH1<ΔH2D.无法判断
9.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是()
A.H2O(g)=H2(g)+
O2(g)ΔH=+242kJ/mol
B.2H2(g)+O2(g)=2H2O(l)ΔH=-484kJ/mol
C.H2(g)+
O2(g)=H2O(g)ΔH=-242kJ/mol
D.2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ/mol
10.有如下三个反应方程式()
H2(g)+
O2(g)=H2O(g)ΔH=akJ/mol
H2(g)+
O2(g)=H2O(l)ΔH=bkJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=ckJ/mol
关于它们的下列叙述正确的是()
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.2b=c
11.含NaOH20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式是()
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+28.7kJ/mol
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ/mol
12.已知方程式2H2(g)+O2(g)=2H2O(l)ΔH1=-571.6kJ/mol,则关于方程式
2H2O(l)=2H2(g)+O2(g);ΔH2=?
的说法正确的是()
A.方程式中化学计量数表示分子数B.该反应的ΔH2大于零
C.该反应ΔH2=-571.6kJ/molD.该反应与上述反应属于可逆反应
13.断裂以下的物质需要能量最多的是()
A.HClB.HBrC.HID.HAt
14.下列叙述中正确的是()
A.实现H2→H+H的变化,要放出能量
B.液态水变成气态水要吸收能量
C.金刚石在一定条件变成石墨要吸收能量
D.CaO和水反应过程中焓变大于0
15.表示正反应是吸热反应的图像是()
16.写出下列反应的热化学方程式。
(1)6.0g石墨与适量的水蒸气反应生成二氧化碳气体和氢气,吸收56.7kJ热量。
。
(2)3molNO2气体溶于水生成HNO3和NO气体,放出138kJ热量
。
17.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。
当把0.4mol液态肼和0.8molH2O2混合反应,生成氮气和水蒸气,放出256.652kJ的热量(相当于25℃、101kPa下测得的热量)。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g)ΔH=+44kJ/mol。
则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
18.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在
如图所示的装置中进行中和反应。
通过测定反应过程中
所放出的热量可计算中和热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品
是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
19.已知:
H2(g)+
O2(g)=H2O(g),反应过程中能
量变化如图所示,请回答下列问题。
(1)a、b、c分别代表什么意义?
a:
;b:
;
c:
。
(2)该反应是(填“放热”或“吸热”),ΔH0(填“>”“<”或“=”)。
【能力提升】
20.由金红石(TiO2)制取单质Ti,涉及到的步骤为:
TiO2→TiCl4Ti
已知①C(s)+O2(g)=CO2(g)ΔH=―393.5kJ/mol②2CO(g)+O2(g)=2CO2(g)
ΔH=―566kJ/mol③TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH=+141kJ/mol
则TiO2(s)+2Cl2(g)+C(s)=TiCl4(g)+2CO(g)的ΔH=。
反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是。
第一节化学反应与能量的变化
1.C2.D3.D4.D5.A6.D7.B8.B9.AC10.D11.D12.B13.A14.B15.A
16.C(石墨,s)+2H2O(g)=CO2(g)+2H2(g)ΔH=+113.4kJ
3NO2(g)+2H2O(g)=2HNO3(aq)+NO(g)ΔH=-138kJ
17.
(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)ΔH=-641.563KJ/mol
(2)408.8
(3)产物不会造成环境污染。
18.
(1)环形玻璃搅拌棒
(2)减少实验过程中的热量损失(3)偏小
(4)不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关(5)偏小
19.
(1)代表旧化学键断裂吸收的能量代表生成新键放出的能量代表反应热
(2)放热<
20.—80kJ/mol防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用