高考化学二模试题分类汇编化学反应与能量推断题综合含答案Word文档下载推荐.docx
《高考化学二模试题分类汇编化学反应与能量推断题综合含答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《高考化学二模试题分类汇编化学反应与能量推断题综合含答案Word文档下载推荐.docx(25页珍藏版)》请在冰豆网上搜索。
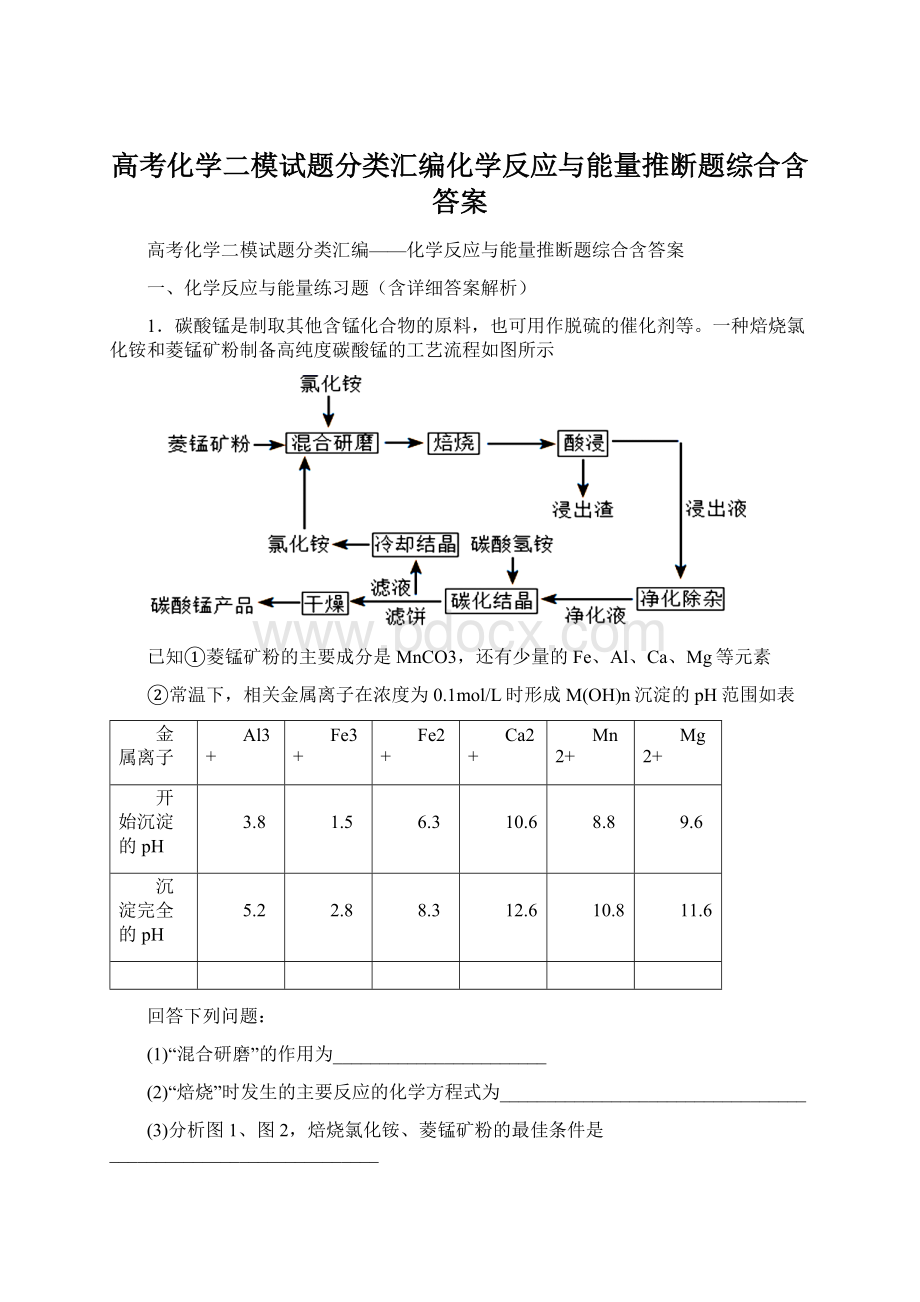
11.6
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A.(NH4)2S2O8B.MnO2C.KMnO4
②调节pH时,pH可取的范围为_________________
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________
【答案】加快反应速率MnCO3+2NH4Cl=MnCl2+2NH3↑+CO2↑+H2O温度为500℃,且m(MnCO3):
m(NH4Cl)=1.10B5.2≤pH<
8.8CO32-水解程度大于HCO3-,易生成氢氧化物沉淀
【解析】
【分析】
菱锰矿的主要成分为MnCO3,加入氯化铵焙烧发生MnCO3+2NH4Cl
MnCl2+CO2↑+2NH3↑+H2O↑,气体为二氧化碳和氨气、水蒸气,浸出液中含MnCl2、FeCl2、CaCl2、MgCl2、AlCl3等,结合表中离子的沉淀pH及信息可知,浸取液净化除杂时加入少量MnO2氧化亚铁离子为铁离子,加氨水调pH,生成沉淀氢氧化铁和氢氧化铝,加入NH4F,除去Ca2+、Mg2+,净化液加入碳酸氢铵碳化结晶过滤得到碳酸锰,据此分析解题。
【详解】
(1)“混合研磨”可增大反应物的接触面积,加快反应速率;
(2)根据流程,菱镁矿粉与氯化铵混合研磨后焙烧得到氨气、二氧化碳和Mn2+,主要化学反应方程式为:
MnCO3+2NH4Cl
MnCl2+2NH3↑+CO2↑+H2O;
(3)由图可知,锰的浸出率随着焙烧温度、氯化铵与菱镁矿粉的质量之比增大而提高,到500℃、1.10达到最高,再增大锰的浸出率变化不明显,故氯化铵焙烧菱镁矿的最佳条件是焙烧温度500℃,氯化铵与菱镁矿粉的质量之比为1.10;
(4)净化过程:
加入少量MnO2氧化亚铁离子为铁离子,加氨水调pH,生成沉淀氢氧化铁和氢氧化铝,加入NH4F,除去Ca2+、Mg2+;
①最合适的试剂为MnO2,氧化亚铁离子,反应的离子方程式为:
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,且不引入新杂质,故答案为B;
②调节溶液pH使Fe3+,A13+沉淀完全,同时不使Mn2+沉淀,根据表中数据可知调节溶液pH范围5.2≤pH<8.8;
(5)碳化结晶中生成MnCO3的离子方程式为Mn2++HCO3-+NH3═MnCO3↓+NH4+,不用碳酸铵溶液替代NH4HCO3溶液,可能的原因是碳酸铵溶液中的c(OH-)较大,会产生Mn(OH)2沉淀。
【点睛】
考查物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,结合题目信息对流程的分析是本题的解题关键,需要学生有扎实的基础知识的同时,还要有处理信息应用的能力,注意对化学平衡常数的灵活运用,综合性强。
2.五氧化二钒常用作化学工业中的催化剂,广泛用于冶金、化工生产。
一种以粗钒(主要含有V2O5、V2O4,还有少量Fe3O4、Al2O3、SiO2等)为原料生产五氧化二钒的工艺流程如下:
已知:
①部分含钒物质的溶解情况:
(VO2)2SO4易溶于水,VOSO4可溶于水,NH4VO3难溶于水。
②部分金属离子[c(Mn+)=0.1mol/L]形成氢氧化物及氢氧化物溶解与pH的关系如下表:
(l)“研磨”的目的是___,“酸溶”时V2O5发生反应的化学方程式为____。
(2)加入NaCIO溶液,含钒元素的粒子发生反应的离子方程式为___。
(3)向三颈烧瓶中加入NaOH溶液时实验装置如图所示,虚线框中最为合适的仪器是___(填标号),调节溶液的pH范围为___,滤渣b为___(写化学式)。
(4)实验显示,沉钒率的高低与温度有关,如图是沉钒率随温度的变化曲线,则沉钒时的加热方法为___。
温度高于80℃,沉钒率下降,其可能原因是____
【答案】增大固体与酸溶液的接触面积,加快反应速率,提高原料的利用率V2O5+H2SO4=(VO2)2SO4+H2O2VO2++ClO-+H2O=2VO2++Cl-+2H+D4.7≤pH<7.8Fe(OH)3、Al(OH)水浴加热(热水浴)温度高于80℃,NH4+水解程度增大成为主要因素,由于NH4+浓度减小,沉钒率下降
粗钒(主要含有V2O5、V2O4,还有少量Fe3O4、Al2O3、SiO2等)经过研磨粉碎,加入硫酸进行酸浸,V2O5、V2O4,还有少量Fe3O4、Al2O3被硫酸溶解形成含有VO2+、VO2+、Fe2+、Fe3+、Al3+的浸出液,由于SiO2不与硫酸反应,经过滤后,得到的滤渣a为SiO2,滤液a为含有VO2+、VO2+、Fe2+、Fe3+、Al3+的滤液,向滤液a中加入具有强氧化性的NaClO溶液,将滤液中的VO2+、Fe2+氧化为VO2+、Fe3+,再加入氢氧化钠溶液,调节溶液pH值,将滤液中的Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去,过滤后得到的滤渣b为Fe(OH)3、Al(OH)3、滤液b为主要含有VO2+的滤液,加入饱和氯化铵溶液,使VO2+转化为NH4VO3沉淀,对生成的NH4VO3沉淀高温煅烧,获得V2O5,据此分析解答。
(l)“研磨”可将块状固体变为粉末状,目的是增大固体与酸溶液的接触面积,加快反应速率,提高原料的利用率;
“酸溶”时V2O5被硫酸溶解形成VO2+,发生反应的化学方程式为V2O5+H2SO4=(VO2)2SO4+H2O;
(2)根据分析,向滤液a中加入具有强氧化性的NaClO溶液,将滤液中的VO2+、Fe2+氧化为VO2+、Fe3+,含钒元素的粒子发生反应的离子方程式为2VO2++ClO-+H2O=2VO2++Cl-+2H+;
(3)加入氢氧化钠溶液,调节溶液pH值,将滤液中的Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去,根据部分金属离子[c(Mn+)=0.1mol/L]形成氢氧化物及氢氧化物溶解与pH的关系表格数据可知,pH值为2.8时,Fe(OH)3完全沉淀,pH值为4.7时,Al(OH)3完全沉淀,pH值为7.8时,Al(OH)3开始溶解,调节溶液的pH范围为4.7≤pH<7.8,滤渣b为Fe(OH)3、Al(OH)3,向三颈烧瓶中加入NaOH溶液时,虚线框中最为合适的仪器是恒压漏斗,能保证仪器内外压强相等,使氢氧化钠溶液顺利流下,答案选D;
(4)由图像可知,当温度为80℃左右钒的沉淀率最高,酒精灯的火焰温度太高,不能直接用酒精灯加热,则在该温度下加热方法应使用水浴加热;
沉钒过程中使用的是饱和氯化铵溶液,铵根离子可水解,温度越高水解程度越大,铵盐不稳定,受热易分解生成氨气,温度高于80℃,NH4+水解程度增大成为主要因素,溶液中NH4+浓度减小,使沉钒率下降。
3.碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。
③常温下,Ksp(CaF2)=1.46×
10−10,Ksp(MgF2)=7.42×
10−11;
Ka(HF)=1.00×
10−4
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,
=______若此时pH为6,c(Mg2+)=amol/L,则c(HF)为______________mol/L(用a表示)
【答案】加快反应速率MnCO3+2NH4Cl
MnCl2+2NH3↑+CO2↑+H2O温度为500℃且m(MnCO3):
m(NH4Cl)=1.10B5.2≤pH<8.81.97
×
10-7CO32-水解程度大于HCO3-,易生成氢氧化物沉淀
根据流程:
将菱锰矿粉(主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素)和氯化铵混合研磨后焙烧:
MnCl2+2NH3↑+CO2↑+H2O,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入MnO2将Fe2+氧化为Fe3+,反应为:
MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液主要溶质主要为MnCl2、NH4Cl,加入碳酸氢铵发生反应:
Mn2++2HCO3-
MnCO3↓+CO2↑+H2O,炭化结晶,过滤,滤饼干燥后得到MnCO3,滤液为NH4Cl溶液,蒸发结晶得到NH4Cl固体,可循环使用,据此分析作答。
(1)“混合研磨”可使物质充分接触,加快反应速率;
(2)“焙烧”时发生的主要反应的化学方程式为MnCO3+2NH4Cl
(3)根据图可知,锰的浸出率随着温度的升高而增大,随着m(NH4Cl):
m(锰矿粉)增大而增到,500℃、m(NH4Cl):
m(锰矿粉)=1.10时,锰的浸出率最高,温度过高,m(NH4Cl):
m(锰矿粉)增大,浸出率变化不大,成本增加,故焙烧温度取500℃、m(NH4Cl):
m(锰矿粉)=1.10即可;
(4)①根据分析,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入氧化剂X的目的将Fe2+氧化为Fe3+,同时在选择氧化剂时,要尽可能不要引入新的杂质,则氧化剂X宜选择MnO2,答案选B;
②根据分析,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液主要溶质主要为MnCl2、NH4Cl,过程中不能让Mn2+沉淀,结合相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围表,Al3+、Fe3+完全沉淀时的pH值分别为5.2和2.8,Mn2+开始沉淀的PH值为8.8,pH可取的范围为5.2≤pH<8.8;
③
≈1.97;
若此时pH为6,即c(H+)=10-6mol/L,c(Mg2+)=amol/L,c(F-)=
mol/L,HF是弱酸,在溶液中部分电离,已知Ka(HF)=
=1.00×
10−4则c(HF)=
=
10-7mol/L;
(5)“碳化结晶”过程中,因为碳酸根离子水解程度大,碳酸铵溶液中c(OH−)较大,易产生Mn(OH)2沉淀,故碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液。
4.
(1)反应3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:
(填“加快”、“不变”或“减慢”)。
①保持体积不变充入Ne,其反应速率___。
②保持压强不变充入Ne,其反应速率____。
(2)在一定条件下发生反应:
6NO(g)+4NH3(g)
5N2(g)+6H2O(g)。
某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为__(选填字母)。
(3)一定条件下,在2L密闭容器内,发生反应2NO2(g)
N2O4(g),n(NO2)随时间变化如下表:
时间/s
1
2
3
4
5
n(NO2)/mol
0.040
0.020
0.010
0.005
①用NO2表示0~2s内该反应的平均速率为___。
②在第5s时,NO2的转化率为__。
【答案】不变减慢cd0.0075mol·
L-1·
s-187.5%
(1)①保持体积不变充入Ne,各反应物和生成物的浓度不变,故反应速率不变;
②保持压强不变充入Ne,容器体积变大,各物质浓度减小,反应速率减慢;
(2)反应达到平衡时正逆反应速率相等,据图可知t2时刻后N2和NO的物质的量不再改变,说明反应到达平衡,所以c、d两个点v(正)与v(逆)相等;
(3)①2s内△n(NO2)=0.04mol-0.01mol=0.03mol,容器体积为2L,所以反应速率为
=0.0075mol·
s-1;
②第5s时,△n(NO2)=0.04mol-0.005mol=0.035mol,转化率为
=87.5%。
判断通入惰性气体或者改变压强对反应速率的影响时,关键看是否改变了反应物和生成物中气体的浓度,若浓度改变则影响反应速率,若浓度不变则不影响反应速率。
5.如图是常见原电池装置,电流表A发生偏转。
(1)若两个电极分别是铁、铜,电解质溶液是浓硝酸,Cu极发生反应_______(填“氧化”或“还原”),其电极反应式为________________;
(2)若两个电极分别是镁、铝,电解质溶液是氢氧化钠溶液,Al电极是_____极(填“正”或“负”),其电极反应式为_________________________________。
(3)若原电池的总反应是2FeCl3+Cu=2FeCl2+CuCl2,则可以作负极材料的是_______,正极电极反应式为_________________________。
【答案】氧化Cu-2e-=Cu2+负Al-3e-+4OH-=AlO2-+2H2OCu(或铜)Fe3++e-=Fe2+
(1)虽然铁比铜活泼,但是铁在浓硝酸中发生钝化,所以该原电池中铜被氧化,即铜电极为负极,失电子发生氧化反应,电极方程式为Cu-2e-=Cu2+;
(2)镁虽然比铝活泼,但镁不与氢氧化钠溶液发生反应,所以该原电池中Al被氧化,即Al为负极,失电子发生氧化反应,电极方程式为:
Al-3e-+4OH-=AlO2-+2H2O;
(3)根据总反应2FeCl3+Cu=2FeCl2+CuCl2可知Cu被氧化,Fe3+被还原,原电池中负极发生氧化反应,所以负极材料为Cu;
正极发生还原反应,电极方程式为Fe3++e-=Fe2+。
第1小题为易错点,虽然铁和铜都能被浓硝酸氧化,但要注意铁在浓硝酸中发生钝化,所以该原电池中铜为负极。
6.高铁电池是一种新型可充电电池该电池能较长时间保持稳定的放电电压。
高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH。
(1)高铁电池的负极材料是___。
(2)放电时,正极发生__(填“氧化”或“还原”)反应;
负极的电极反应式为__。
(3)放电时,__(填“正”或“负”)极附近溶液的碱性增强。
【答案】Zn还原Zn-2e-+2OH-=Zn(OH)2正
放电时该装置相当于原电池,根据原电池有关原理进行解答。
(1)电池的负极上发生氧化反应,正极上发生还原反应。
由高铁电池放电时的总反应方程式可知,负极材料应为Zn。
答案为:
Zn。
(2)原电池放电时,正极得到电子发生还原反应,负极材料为锌,失电子发生氧化反应,由总反应可知溶液为碱性,所以负极反应式为:
Zn-2e-+2OH-=Zn(OH)2。
还原;
(3)放电时K2FeO4中的Fe的化合价由+6价变为+3价,发生还原反应,电极反应式为:
FeO42-+4H2O+3e-=Fe(OH)3+5OH-,正极上生成氢氧根离子导致溶液中氢氧根离子浓度增大,溶液的碱性增强。
正。
7.氮的单质及其化合物性质多样,用途广泛。
完成下列填空:
科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:
2NO+2CO
2CO2+N2+Q(Q>0)。
在某温度下测得该反应在不同时间的CO浓度如下表:
浓度(mol/L)
时间(s)
c(CO)
3.60×
10-3
3.05×
2.85×
2.75×
2.70×
(1)该反应平衡常数K的表达式为___;
温度升高,K值___(选填“增大”“减小”“不变”);
前2s的平均反应速率v(N2)=___;
若上诉反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是___。
(2)工业合成氨的反应温度选择500℃左右的原因是___。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___。
A.N2、H2、NH3的浓度之比为1:
3:
B.容器内的压强保持不变
C.N2、H2、NH3的浓度不在变化
D.反应停止,正、逆反应的速率都等于零
(4)常温下向1molHCl的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是___;
在通入NH3的过程中溶液的导电能力___(选填“变大”“变小”“几乎不变”)
【答案】
减小1.875×
10-4mol/(L·
s)增大压强(或其它合理答案)催化剂在500℃左右具有最佳活性BCc(Cl-)>
c(NH4+)>
c(H+)>
c(OH-)几乎不变
(1)根据平衡常数和化学反应速率(
)的相关公式进行计算;
(2)工业合成氨的反应温度选择500℃左右的主要原因是催化剂在500℃左右具有最佳活性;
(3)根据化学平衡状态的特征判断,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)二者恰好反应生成氯化铵,水解方程式为NH4++H2O
NH3.H2O+H+,溶液呈酸性,进行分析。
(1)平衡常数等于生成物浓度的系数次幂之积除以反应浓度系数次幂之积,根据反应2NO(g)+2CO(g)
2CO2(g)+N2(g),平衡常数
;
该反应为放热反应,温度升高时平衡逆向移动,所以平衡常数减小;
根据速率之比等于各物质系数比可知:
v(CO)=
,前2s内的平均反应速率v(N2)=v(CO)/2=1.875×
10-4mol/(L·
s);
一氧化氮的转化率变大,说明平衡正向移动可以通过增大压强,使平衡正向移动,故答案为:
;
减小;
1.875×
增大压强(或其它合理答案);
(2)工业合成氨的反应温度选择500℃左右的主要原因是催化剂在500℃左右具有最佳活性,故答案为:
催化剂在500℃左右具有最佳活性;
(3)A.浓度之比为1:
2,并不是不变,不能判断是否平衡,A项错误;
B.反应正向进行,体积减小,当压强不变时,已经到达平衡,B项正确;
C.N2、H2、NH3的浓度不再变化,已经到达平衡,C项正确;
D.可逆反应达到平衡时,正、逆反应的速率相等,但不会等于零,D项错误;
故答案为:
BC;
NH3.H2O+H+,溶液呈酸性,即c(H+)>
c(OH-),根据溶液呈电中性有:
c(NH4+)+c(H+)=c(OH-)+c(Cl-),因为c(H+)>
c(OH-),所以c(Cl-)>
c(NH4+),故离子浓度大小关系为:
c(Cl-)>
c(OH-);
溶液中离子浓度几乎不变,所以导电能力几乎不变,故答案为:
c(Cl-)>
几乎不变。
本题易错点(3)注意平衡状态的判断,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
8.
(1)二氧化硫一空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图:
①质子的流动方向为________________(“从A到B”或“从B到A”)。
②负极的电极反应式为________________。
(2)工业上吸收和转化SO2的电解装置示意图如下(A.B均为惰性电极):
①B极接电源的________________极(“负”或“正”)。
②A极的电极反应式是_________________。
【答案】从A到BSO2-2e-+2H2O=SO42-+4H+正2SO32-+4H++2e-=S2O42-+2H2O
(1)①二氧化硫发生氧化反应,氧气发生还原反应,所以二氧化硫所在电极为负极,氧气所在电极为正极,原电池中阳离子移向正极,所以质子移动方向为:
从A到B;
②二氧化硫在负极失去电子发生氧化反应,电极反应式为:
SO2-2e-+2H2O═SO42-+4H+;
(2)①依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极与电源的正极相连,即B极接电源的正极;
②A为阴极,得电子发生还原反应由SO32-生成S2O42-,电极反应式为2SO32-+4H++2e-=S2O42-+2H2O。
9.微型纽扣电池在现代生活中应用