秋季届高三化学月考试题 1Word格式.docx
《秋季届高三化学月考试题 1Word格式.docx》由会员分享,可在线阅读,更多相关《秋季届高三化学月考试题 1Word格式.docx(8页珍藏版)》请在冰豆网上搜索。
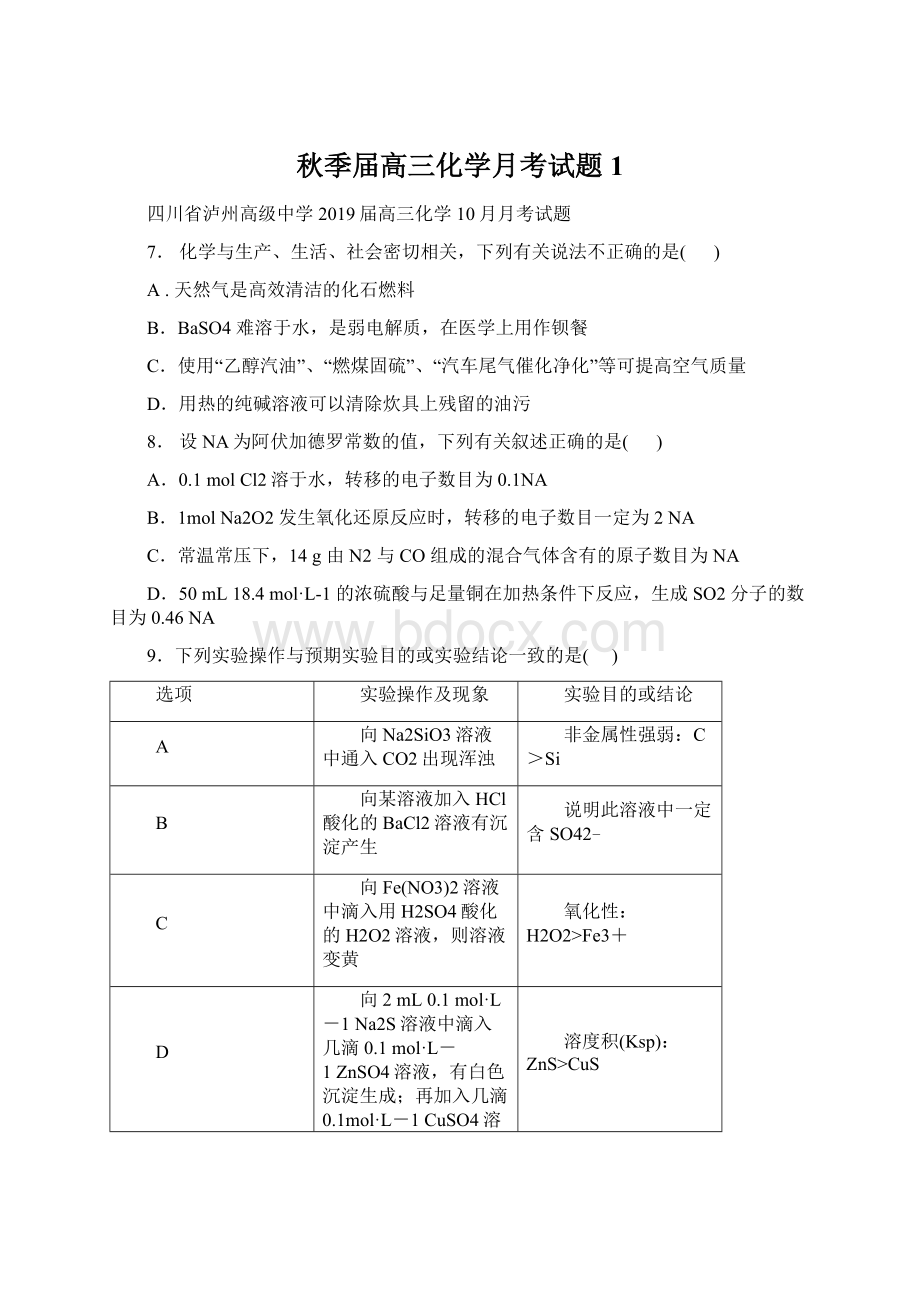
实验操作及现象
实验目的或结论
A
向Na2SiO3溶液中通入CO2出现浑浊
非金属性强弱:
C>Si
B
向某溶液加入HCl酸化的BaCl2溶液有沉淀产生
说明此溶液中一定含SO42﹣
C
向Fe(NO3)2溶液中滴入用H2SO4酸化的H2O2溶液,则溶液变黄
氧化性:
H2O2>
Fe3+
D
向2mL0.1mol·
L-1
Na2S溶液中滴入几滴0.1mol·
ZnSO4溶液,有白色沉淀生成;
再加入几滴0.1mol·
CuSO4溶液,则又有黑色沉淀生成
溶度积(Ksp):
ZnS>
CuS
10、下列有关电解质溶液的说法正确的是(
A.向K2S溶液中加水稀释,
会减小
B.向CuS和FeS的饱和溶液中加入少量Na2S,
保持不变
C.向醋酸溶液中加NaOH至恰好完全反应,水的电离程度先增大后减小
D.向含有MgCO3固体的溶液中加入少量盐酸,
会增大
11、TK时,向2.0L恒容密闭容器中充入1.0molCOCl2,反应COCl2(g)
Cl2(g)+CO(g),经过一段时间后达到平衡。
反应过程中测定的部分数据见下表:
t/s
2
4
6
8
n(Cl2)/mol
0.16
0.19
0.20
0.20
下列说法正确的是(
A.反应在前2s的平均速率v(CO)=0.080mol·
L-1·
s-1
B.保持其他条件不变,升高温度,平衡时c(Cl2)=0.11mol·
L-1,则反应的ΔH<0
C.TK时起始向容器中充入0.9molCOCl2、0.10molCl2和0.10molCO,达到平衡前v正>
v逆
D.TK时起始向容器中充入1.0molCl2和0.9molCO,达到平衡时,Cl2的转化率为80%
12、利用如图所示装置可制取
H2,两个电极均为惰性电极,c为阴离子交换膜。
下列叙述正确的是(
A.a为电源的正极
B.工作时,OH-
向左室迁移
C.生成H2和CH3COONa的物质的量之比为
2:
1
D.右室电极反应为:
C2H5OH+H2O-4e-=CH3COO-+5H+
13、25℃时,用0.1mol/L的HC1溶液滴定10.00mL0.1mol/L的NH3·
H2O溶液,其滴定曲线如图所示。
AG=lg下列分析错误的是
(
A.滴定前HC1溶液的AG=12;
图中a<
B.N点溶液中:
c(Cl-)=2c(NH3.H2O)+2c(NH4+)
C.从M点到N点水的电离程度先增大后减小
D.
M点为完全反应点,V(HCl)=10mL,且c(Cl-)>
c(NH4+)
26.(15分)人教版高中化学选修4实验2-3中用到了硫代硫酸钠,某化学兴趣小组对这一物质展开了如下探究。
实验一:
制备Na2S2O3·
5H2O
通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·
5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
;
S(s)+Na2SO3(aq)
Na2S2O3(aq)
(1)写出A中的化学反应方程式
。
(2)装置B的作用之一是观察SO2的生成速率,B中盛装的液体最好是________。
A、蒸馏水
B、饱和Na2SO3
溶液
C、饱和NaHSO3
溶液
D、饱和NaHCO3溶液
(3)装置E中应盛装
(填“蒸馏水”、“澄清石灰水”、“氢氧化钠溶液”)
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为____________。
实验二:
性质探究
(5)常温下,用pH试纸测定0.1mol·
L-1Na2S2O3溶液pH值
7(填“大于”,“小于”或“等于”)。
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子反应方程式
实验三:
Na2S2O3的应用
(7)用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:
取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;
过滤、洗涤后,用适量稀盐酸溶解。
此时CrO42-全部转化为Cr2O72-;
再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100mol·
L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
滴定次数
3
消耗Na2S2O3标准溶液的体积/mL
18.02
20.03
17.98
18.00
部分反应的离子方程式为:
①Cr2O72-+6I-+14H+===3I2+2Cr3++7H2O
②I2+2S2O32-===S4O62-+2I-
滴定时Na2S2O3标准溶液应该用___________________(填仪器名称)
盛装,该废水中Ba2+的物质的量浓度为_______________________。
27、(14分)Ⅰ.常温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量,请分析上述实验过程,并回答下列问题:
⑴该反应的离子方程式为:
⑵在实验过程中,水的电离程度的变化趋势是先
后
。
(选填“增大”、“减小”、或“不变”)
Ⅱ.现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
⑴相同条件下,取等体积的甲、乙两溶液,各稀释100倍。
稀释后的溶液,其pH大小关系为:
pH甲
pH乙(填“大于”、“小于”或“等于”)。
⑵各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:
V甲
V乙(填“大于”、“小于”或“等于”)。
Ⅲ.有一学生在实验室测某溶液的pH。
实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
⑴该学生的操作是
(填“正确的”或“不正确的”)。
⑵上述操作
一定有误差(填“是”或“不”),请简要分析原因
⑶若用此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是
Ⅳ.一定温度下的某溶液中,c(H+)=10x
mol/L,c(OH―)=10y
mol/L。
x与y的关系如右图所示:
则该温度下0.01mol/LNaOH溶液的pH为
28、(14分)
(1)①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
2NO2(g)
N2O4(g)
△H=-56.9kJ/mol
H2O(g)=H2O(l)
ΔH=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
②已知:
2H2(g)+O2(g)=2H2O(g)
ΔH=—483.6kJ/mol,且断裂1molH-H键1molO=O键的能量分别为436kJ、498kJ,则断裂1moLH-O键所需能量为
kJ。
③汽车燃油不完全燃烧时会产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的
H>0,该设想
实现(填“能”或“不能”)。
④在一定条件下可以将煤转化为清洁能源,该反应为吸热反应,其平衡常数表达式为:
,则它所对应的化学反应方程式为:
在一容积固定的密闭容器中放入足量的焦炭与一定量的水蒸气进行反应,下列有关图像不正确的是(
A.
Ⅰ图表示反应进行过程中气体平均相对分子质量的变化
B.
Ⅱ图表示反应进行过程中气体密度的变化
C.
Ⅲ图表示反应达到平衡后,移去焦炭后水蒸气的百分含量的变化(忽略表面积的影响)
D.
Ⅳ图表示反应达到平衡后,升高温度CO的百分含量的变化
(2)25℃时,已知H2SO3的电离常数Ka1=1×
10-2mol·
L-1,Ka2=6×
10-8mol·
,且已知NaHSO3溶液显酸性,则该温度下HSO3-水解反应的平衡常数K=
mol·
,向NaHSO3溶液中加入少量金属Na,溶液中c(HSO3-)将
(填“增大"
、"
减小"
不变"
或"
不确定”)。
35、(15分)钴(Co)及其化合物在工业上有广泛应用。
为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
①物质溶解性:
LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表;
③钴的常见化合价为:
+2,+3。
Fe3+
Co2+
Co3+
Al3+
pH(开始沉淀)
1.9
7.15
0.23
3.4
pH(完全沉淀)
3.2
9.15
1.09
4.7
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是
。
(2)步骤Ⅱ中盐酸除了酸性作用,还作
剂;
请写出的Co2O3与盐酸反应的离子方程式:
。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过 ;
废渣中的主要成分除了LiF外,还有
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是
。
温度范围/℃
固体质量/g
150~210
4.41
290~320
2.41
890~920
2.25
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
①加热到210℃时,固体质量减轻的原因是
②经测定,加热到210~290℃过程中的生成物只有CO2
和钴的氧化物,此过程发生反应的化学方程式
为:
。
36.本次未命制试题(15分)
泸州高中2016级第5期第10月考试化学答案
7.B
8.C
9.A
10.B
11.C
12.C
13.D
26、(15分)(除7小题第一空1分外,其余每空2分)
(1).
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
(2).
C
(3).
氢氧化钠溶液
(4).
1
(5).
大于
(6).S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-
(7).碱式滴定管
(1分)
0.0024mol·
L-1(未带单位扣1分)
27、(14分)
Ⅰ.⑴NH3·
H2O+H+=NH4++H2O
(2分)
⑵增大
(1分)
减小
(1分)
Ⅱ.
(1)小于
(2)大于
Ⅲ.
⑴不正确的
⑵否
当溶液为中性时,不产生误差
⑶盐酸
Ⅳ.
13(2分)
28、(每空2分,共14分)
(1)①CH4(g)+N2O4(g)==N2(g)+2H2O(l)+CO2(g)
△H=—898.1kJ/mol
②463.4③不能
④C(s)+H2O(g)
H2(g)+CO(g)(可不标状态)
,
A.C.D(少答扣1分,错答不得分)
(2)1×
10-12
减小
35、(15分)
(1)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(2分)
(2)还原剂(1分)
Co2O3+6H++2Cl﹣=2Co2++Cl2↑+3H2O;
(3)7.15
Fe(OH)3;
(4)降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀;
(5))①失去结晶水;
(2分)②3CoC2O4+2O2
Co3O4+6CO2;