届中考化学专项突破复习《化学实验》专练Word文档下载推荐.docx
《届中考化学专项突破复习《化学实验》专练Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《届中考化学专项突破复习《化学实验》专练Word文档下载推荐.docx(20页珍藏版)》请在冰豆网上搜索。
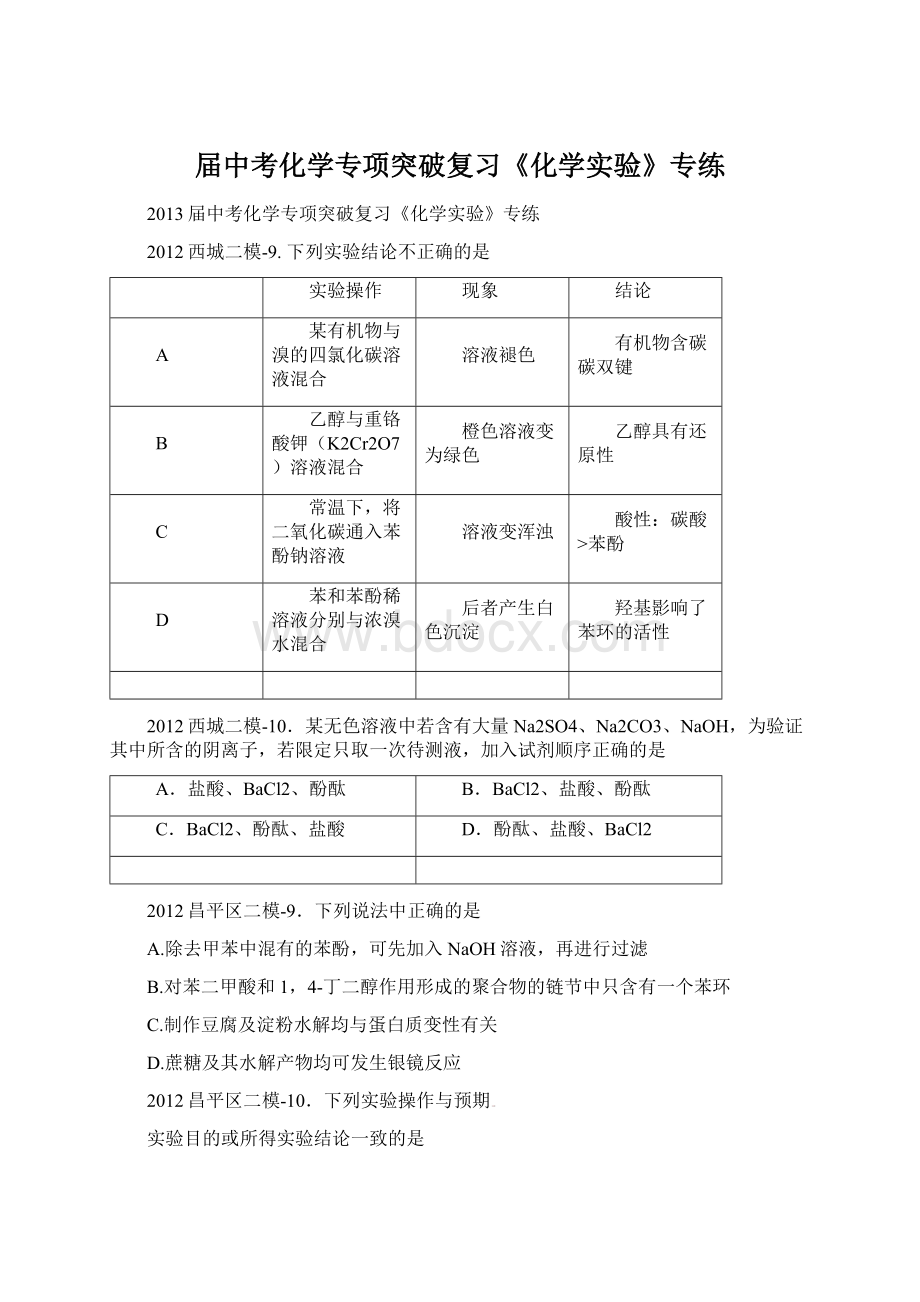
将洁净的铁钉在饱和食盐水中浸泡一段时间;
铁钉上有气泡产生
证明铁发生析
氢腐蚀
测定物质的量浓度相同的盐酸和醋酸溶液的pH;
盐酸pH小于醋酸pH
证明盐酸酸性比醋酸强
硅酸钠溶
液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失
证明非金属性:
Cl>
Si
2012丰台二模-8.下列实验方案不能达到预期目的的是
实验方案
预期目的
将含有HCl的CO2气体通过饱和NaHCO3溶液
除去CO2中的HCl
向X溶液中滴加盐酸酸化的BaCl2溶液
检验X溶液中是否含有SO42-
向醋酸钠溶液中滴入酚酞试液,加热后若红色加深
证明盐类的水解是吸热的
向含有少量苯酚的苯中加入NaOH溶液,振荡、静置、分液
除去苯中的苯酚
2012海淀二模-10.孔雀石的主要成分为xCuCO3·
yCu(OH)2·
zH2O,为测定其中CuCO3的质量分数,称取ag样品进行实验。
下列实验方案可行的是
A.充分加热样品,用碱石灰吸收逸出气体,增重bg
B.加热至样品质量不再发生变化,称得其质量为bg
C.向样品中加入足量的稀盐酸,用排水法收集逸出气体,得bmL气体
D.向样品中加入足量的稀盐酸,充分反应,将生成的气体全部通入到足量Ba(OH)2溶液中,过滤、洗涤、烘干,得bg固体
2012-顺义二模-8.下列说法不正确的是
图Ⅰ图Ⅱ图Ⅲ图Ⅳ
A.图Ⅰ所示装置可制备氢氧化亚铁
B.图Ⅱ所示装置可电解制氯气和氢气
C.图Ⅲ所示装置可验证氨气在水中的溶解性
D.图Ⅳ所示装置和操作可从苯酚中分离出苯
2012-顺义二模-10.下述实验能达到预期目的的是
编号
实验内容
实验目的
将SO2通入KMnO4(H+)溶液中
验证SO2具有漂白性
将乙醇与浓硫酸共热制得的气体,直接通入溴水中
检验产物是乙烯气体
在粗盐水溶液中依次加入过量BaCl2溶液、Na2CO3溶液,过滤后再加适量盐酸
除去粗盐中的SO42—、Ca2+
在淀粉水解后的溶液中,直接加入新制的Cu(OH)2悬浊液,加热至沸腾
检验淀粉水解生成葡萄糖
2012海淀二模-27.(12分)某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
操作
I
先向2mL0.1mol/LFeCl2溶液中滴加KSCN溶液,再滴加新制氯水
II
先向2mL0.1mol/LFeCl3溶液中滴加KSCN溶液,再滴加0.1mol/LKI溶液
滴加KSCN溶液后,溶液变成红
色;
滴加KI溶液后,红色无明显变化
①实验I的现象为。
②FeCl2溶液与新制氯水反应的离子方程式为。
(2)该同学分析了导致实验II现象的可能原因,并对实验方案进行了改进。
改进后的
实验操作和现象如下:
III
向2mL0.1mol/LKI溶液中滴加1mL
0.1mol/LFeCl3溶液,再滴加KSCN溶液
滴加FeCl3溶液后,溶液变成黄色;
滴加KSCN溶液后,溶液变成红色
根据实验III,甲同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简
明的文字说明他得出上述结论的理由。
(3)该同学认为需要进一步设计实验证明根据实验III中现象得出的结论。
请补全下表中
的实验方案。
预期现象及结论
IV
向2mL0.1mol/LKI溶液中滴加1mL
0.1mol/LFeCl3溶液,
(4)上述实验结果表明,Fe3+有可能与I-发生氧化还原反应。
进一步查阅资料知,参加反
应的Fe3+与I-的物质的量相同。
该同学结合上述实验结论,分析了实验III中加入
KSCN后溶液变红的原因,认为Fe3+与I-反应的离子方程式应写为
。
(1)①滴加KSCN后溶液无明显变化,加入氯水后溶液变成红色(各1分)
②2Fe2++Cl2===2Fe3++2Cl-
(2)溶液变成黄色,推测生成了I2(其他合理答案可酌情给分)
(3)
再
滴加淀粉溶液(或CCl4;
或铁氰化钾溶液)
(1分)
预期现象:
溶液变蓝(或溶液分层,下层溶液为紫色;
或生成蓝色沉淀),结论:
Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+)
(现象、结论各1分)
(其他合理答案可酌情给分)
(4)2Fe3++2I-
2Fe2++I2(3分,不写可逆符号扣2分)
2012海淀二模-
28.(15分)最新研究发现,用隔膜电解法处理高浓度乙醛废水具
有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、
电解
阳极发生反应,转化为乙醇和乙酸,总反应为:
2CH3CHO+H2O===CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,
模拟乙醛废水的处理过程,其装置示意图如右图所示。
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入(填化学式)
气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。
电极反应如下:
阳极:
①4OH--4e-==O2↑+2H2O
②
阴极:
①
②CH3CHO+2e-+2H2O==CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量(填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶
液中各组分的物质的量,其中Na2SO4与
CH3COOH的物质的量相同。
下列关于阳极区溶液中各微粒浓度关系的说法
正确的是(填字母序号)。
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>
c(CH3COOH)>
c(CH3COO-)>
c(OH-)
(5)已知:
乙醛、乙醇的沸点分别为20.8℃、78.4℃。
从电解后阴极区的溶液中分离
出乙醇粗品的方法是。
(6)在实际工艺处理中,阴极区乙醛的去除率可达60%。
若在两极区分别注入1m3
乙醛的含量为3000mg/L的废水,可得到乙醇kg(计算结果保留小
数点后1位)。
(1)CH4
(2)CH3CHO-2e-+H2O==CH3COOH+2H+
4H++4e-==2H2↑或4H2O+4e-==2H2↑+4OH-
(写成“2H++2e-==H2↑”不扣分)
(3)不变
(3)abd(3分,对1个得1分,错写1个扣1分,多写1个扣1分,扣完为止)
(5)蒸馏
(6)1.9
2012-顺义二模-26.(14分)硫酸铝铵常用于水的净化以
及工业水的处理。
硫酸铝铵是白色透明结晶硬块,易溶于热水,水溶液呈酸性;
随温度升高、脱去结晶水,产生晶变。
工业用铝土矿(主要成分Al2O3、少量SiO2、Fe2O3、MgO等)为原料制取硫酸铝铵的工艺流程示意图如下:
部分氢氧化物沉淀的pH如下表:
沉淀物
Al(OH)3
Fe(OH)3
Mg(OH)2
开始沉淀pH
3.8
2.7
9.4
完全沉淀pH
5.2
3.2
12.4
请回答下列问题:
(1)步骤③中调节pH使Fe(OH)3沉淀完全,检验Fe3+是否沉淀完全的操作是。
(2)若X为NaOH,步骤④中发生反应的离子方程式是。
(3)用化学平衡移动原理解释步骤⑤中加入硫酸的作用。
(4)硫酸铝铵水溶液呈酸性的原因是(用离子方程式表示)。
浓度均为0.1mol/L
硫
酸铝和硫酸铝铵两种水溶液,c(Al3+)较大的是(填“硫酸铝铵”或“硫酸铝”)溶液。
(5)步骤⑥中,要求温度控制在90—100℃之间至硫酸铵全部溶解,其原因是。
(6)步骤⑦的操作方法包括。
(1)取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;
若溶液不变色,说明Fe3+已沉淀完全。
………………(2分)
(2)Al3+﹢3OH-=Al(OH)3↓………………………………………………(2分)
(3)由于
硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解。
………
………………………………………………………(2分)
(4)Al3+﹢3H2O
Al(OH)3﹢3H+;
NH4++H2O
NH3·
H2O+H+………(2分)
硫酸铝铵………………………………………………………………(2分)
(5)因为硫酸铝铵易溶于热水,有利于生成;
所以
温度控制在90—100℃之间。
(6)冷却,结晶、过滤、洗涤、干燥………………………………………………(2分)
2012-顺义二模-27.(14分)某课外小组欲探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的成分。
已知:
①沸点:
SO2-10℃,SO345℃;
②SO3遇水剧烈反应,放出大量热,产生酸雾。
③98.3%H2SO4可以吸收SO3和酸雾。
提供的药品:
Na2SO3固体、10mol/LH2SO4、催化剂(V2O5)、KMnO4固体、蒸馏水、0.5mol/LBaCl2溶液、98.3%H2SO4、2.0mol/LNaOH溶液、品红溶液等。
(1)该小组同学用Na2SO3固体与10mol/LH2SO4混合制取SO2。
发生装置应该选用下图中装置(填字母)。
(2)若选用上图中b装置制O2,反应的方程式是。
(3)该小组同学为检验反应后混合气体的成分,设计如下装置:
①b中发生反应的化学方程式是 。
②c中盛放的试剂是;
e中盛放的试剂是,其作用是。
③某同学提出用饱和的NaHSO3溶液代替98.3%的浓H2SO4,请你评价该方案是否可行,若可以不必说明理由;
若不可行,简述其理由。
(1)c……………………………………………………………………………………(2分)
(2)2KMnO4K2MnO4+MnO2+O2↑
…………………………………(2分)
(3)①2SO2+O22SO3………………………………………………(2分)
②0.5mol/LBaCl2溶液………………………………………………………(2分)
品红溶液(或KMnO4溶液)……………………………………………………(2分)
检验和除去SO2气体………………………………………………………(2分)
③虽然饱和NaHSO3溶液可除去SO3,但是SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验。
…………………………………………………………(2分)
2012西城二模-26.(14分)利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。
其生产步骤如下:
TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是。
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为。
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因。
(5)步骤④的离子方程式是。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及。
(7)为测定步骤②中所得晶体中FeSO4·
7H2O的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。
若消耗0.1000mol•L-1KMnO4溶液20.00mL,所得晶体中FeSO4·
7H2O的质量分数为(用a表示)。
(1)过滤
(2)TiOSO4+(x+1)H2O==TiO2•xH2O↓+H2SO4(写可逆号也得分)
(3)1:
4(4)FeCO3(s)Fe2+(aq)+CO32-(aq)CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液
(5)Fe2++2HCO3—==FeCO3↓+H2O+CO2↑(6)防止Fe2+被氧化(7)13.9/a
2012
昌平区二模-26.(14分)某酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。
实验室用下图模拟工艺流程,利用常用的酸、碱和废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
氢氧化钠溶液
搅拌
铁红
过量甲
过程Ⅰ
金
工业废水
稀硫酸
过程Ⅱ
(1)甲的化学式是 ,乙的化学式是 ,G的化学式是 。
(2)过程Ⅰ中共发生了个化学反应,写出其中不属于置换反应的离子方程式 。
(3)过程Ⅰ、Ⅱ、Ⅲ、
Ⅳ中均进行的实验操作的名称是。
(4)过程Ⅱ中加入稀硫酸的目的是。
(5)由A生成D的实验现象是。
(6)由D生产铁红的化学方程式是。
(1)Fe(1分)HNO3(1分)CuO(1分)
(2)4(1分)2Fe3++Fe=3Fe2+
(3)过滤(4)除去过程Ⅰ中加入的过量铁粉;
使Fe2+循环利用
(5)生成白色絮状沉淀迅速变成灰绿色,最终变成红褐色
(6)2Fe(OH)3=Fe2O3+3H2O
2012昌平区二模-27.(16分)某校学生实验小组为了证明铜与稀硝酸反应产生一氧化氮,用下图所示装置进行实验,(加热装置和夹持装置均已略去,气密性已检验,F是用于鼓入空气的双连打气球)
实验操作及现象:
Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触
产生气体
Ⅱ.当C处产生白色沉淀时,立刻将B装置上提
Ⅲ.将A中铜丝放入稀硝酸中,给装置A微微加热
装置A中产生无色气体;
装置
E中开始时出现浅红棕色气体
Ⅳ.用F向E中鼓入空气
烧瓶E内气体颜色逐渐加深
Ⅴ.一段时间后
C中白色沉淀溶解
试回答:
(1)操作Ⅰ中产生气体的化学式为__________________________。
(2)操作Ⅰ的目的是。
(3)C中白色沉淀的化学式是,操作Ⅱ中当C产生白色沉淀时立刻将B上提的原因是。
(4)操作Ⅲ中装置A产生无色气体的化学方程式是。
(5)烧瓶E内气体颜色逐渐加深的原因是。
(6)操作Ⅴ现象产生的原因是(结合化学方程式说明)。
(7)D装置的作用是____________________________________。
(1)CO2
(2)用碳酸钙与稀硝酸反应产生的二氧化碳气赶走装置内的空气
(3)CaCO3防止消耗硝酸过多影响铜与硝酸的反应
(4)
(5)CO2比空气重,从长管进入E,并没有把E中空气赶尽,致使部分NO先与未赶尽的空气生成少量红棕色NO2,当再从F鼓入空气时,E中有更多N
O2生成,所以红棕色加深
(6)HNO33NO2+H2O=2HNO3+NO(或4NO+3O2+2H2O=4HNO3)
(7)平衡压强,吸收NO、NO2、CO2尾气,防止污染大气
2012朝阳二模-27.(16分)氯化铁是实验室中的重要试剂。
某同学用mg含有铁锈(Fe2O3)的废铁屑来制取FeCl3·
6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):
操作步骤如下:
Ⅰ.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1、打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3·
6H2O晶体。
(1)A中发生的置换反应
的化学方程式是。
(2)操作Ⅱ中“……”的内容是,烧杯中的现象是,相应的离子方程式和化学方程式是
、。
(3)操作Ⅲ不采用直接加热制FeCl3·
6H2O晶体的原因是(用简要文字并结合离子方程式解释)。
(4)测得B中所得的气体是VmL(标准状况时),由此计算出该废铁屑中铁的质量分数是,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是。
(5)为了准确测定铁的质量分数,还可以另取mg废铁屑和某种常见的还原剂气体在加热时充分反
应到恒重,测得实验后剩余固体质量是wg。
由此求出铁的准确质量分数是(用含m、和w的式子表示)。
(1)Fe+2HCl=FeCl2+H2↑
(2)当A中固体完全消失;
无色溶液逐渐变黄,有气泡产生。
2Fe2++H2O2+2H+=2Fe3++2H2O、2H2O2
2H2O+O2↑
(3)Fe3++3H2O
Fe(OH)3+3H+,加热会促进FeCl3水解,产生Fe(OH)3。
(4)Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少。
(5)
2012房山区二模-27.(15分)一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。
此时装置C中发生的现象是。
(2)反应进
行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为。
(3)拆除C、D装置后,打开弹簧夹,持续将空气通入A中,至A中固体全部消失,再继续通入一段时间空气后,关闭弹
簧夹,停止通入空气。
①该过程中发生反应的离子方程式是、;
②为使A中固体加快溶解速率,以下方法运用合理的是。
a.对A装置加热b.向A内加入少量Fe2O3c.向A内加入少量CuO
d.增大空气通入量e.向A内加入少量FeSO4f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是。
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,则其采用的方法是,其具体操作步骤可续写为:
(1)水面下
降,水顺长导管排入D中(2分)
(2)88.8%(2分)
(3)①4Fe2++O2+4H+=4Fe3++2H2O(2分)
2Fe3++Cu=2Fe2++Cu2+
(2分)
②abde
(4)Cu2(OH)2CO3+H++Fe3+=2Cu2++F
e(OH)3↓+CO2↑(2分,分两步写正确给分)
(5)测定沉淀法(1分),将(4)中所得红褐色沉淀洗涤、干燥、称量、计算(2分)
2012丰台二模-26.(14分)
高锰酸钾是锰的重要化合物和常用的氧化剂。
以下是工业上用软锰矿(主要成分MnO2)
制备高锰酸钾的一种工艺流程。
H2SO4
过量FeSO4
空气
滤渣
H2O
过滤
酸浸
软锰矿
K2MnO4
熔融
粉碎
KOH
滤液...
高纯MnO2
石灰苛化操作I
母液
CO2
KMnO4
K2CO3
操作I
MnO2
晶体
粗晶体
干燥
(1)KMnO4稀溶液是一种常用的消毒剂。
其消毒机理与______相同(填字母)。
a.NaClO溶液b.双氧水c.苯酚d.75%的酒精
(2)操作Ⅰ的名称是_____________;
硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生主要反应的化学方程式为。
(3)上述流程中可以循环使用的物质有(填化学式)。
若不考虑物质循环与制备过程中的损失,则1molMnO2可制得__________molKMnO4。
(4)MnO2在酸性条件下具有强氧化性,可被还原为Mn2+。
为验证MnO2具有强氧化性,下列方案可行的是(填字母)。
A.MnO2固体加入到FeCl3溶液中,再加KSCN溶液,观察溶液是否变红
B.MnO2固体加入到Na2SO3溶液中,再加BaCl2溶液,观察是否有白色沉淀生成
C.MnO2固体加入到FeSO4与KSCN的酸性混合液中,观察溶液是否变红
(5)酸性KMnO4与H2C2O4溶液反应,反应开始时溶液褪色较慢,反应一段时间后褪色会迅速加快,其原因是____。
(1)ab(2分)
(2)过滤(2分)MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O(2分)
(3)KOH、MnO2(2分)2/3(2分)
(4)C(2分)(5)反应中,生成的Mn2+起催化作用(2分)
2012丰台二模-27.(16分)氢化钙(CaH2)固体是登山运