福建省厦门市第一中学学年高二第二学期月考化学试题原卷版Word文档下载推荐.docx
《福建省厦门市第一中学学年高二第二学期月考化学试题原卷版Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《福建省厦门市第一中学学年高二第二学期月考化学试题原卷版Word文档下载推荐.docx(13页珍藏版)》请在冰豆网上搜索。
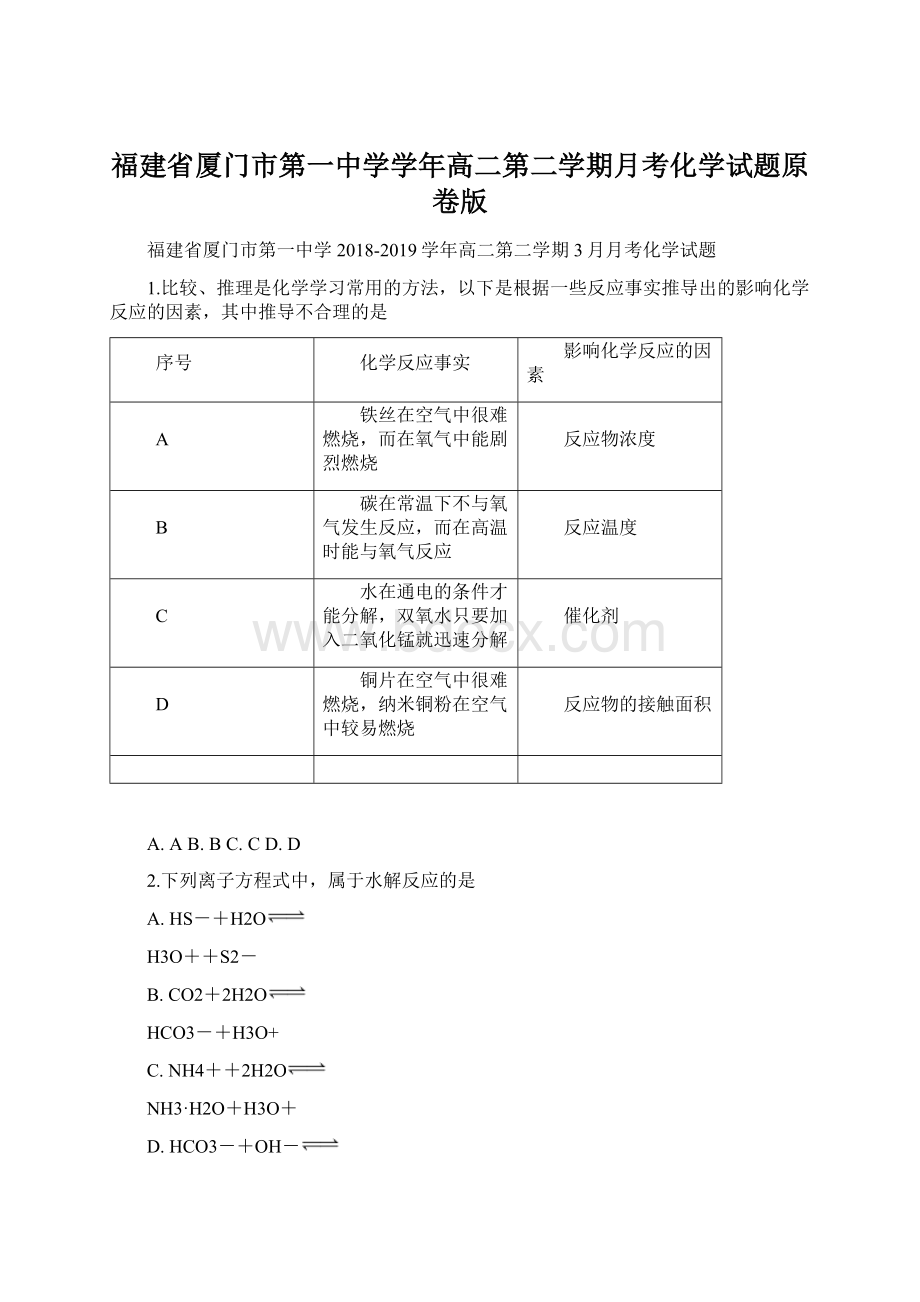
分子一定是活化分子
D.使用催化剂可降低活化能,提高单位体积活化分子百分数
4.Li/Li2O体系的能量循环图如图所示。
已知,△H4>0。
下列说法正确的是
A.△H3<
B.△H3+△H4+△H5=△H6
C.△H6>
△H5
D.△H1+△H2+△H3+△H4+△H5+△H6=0
5.一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。
该装置工作时,下列叙述正确的是
A.石墨电极上的电势比Al电极上的低
B.Al电极区的电极反应式:
A1-3e-+3NH3·
H2O=Al(OH)3+3NH4+
C.每消耗27gAl,有3mol电子通过溶液转移到石墨电极上
D.若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
6.下列说法中正确的是
A.25℃时0.1mol•L﹣1NH4Cl溶液的Kw大于100℃时0.01mol•L﹣1NaCl溶液的Kw
B.常温下,pH均为3的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为1∶108
C.根据溶液的pH与酸碱性的关系,推出pH=6.5的溶液一定显酸性
D.室温下,将pH=2的盐酸与pH=12的氨水等体积混合,溶液显中性
7.常温下,某溶液中由水电离出来的c(H+)=1.0×
10-13mol·
L-1,该溶液可能是()
①二氧化硫②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液
A.①④B.①②C.②③D.③④
8.能促进水的电离,并使溶液中c(H+)>
c(OH-)的操作是
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入明矾晶体 ⑤向水中加NaHCO3固体 ⑥向水中加NaHSO4固体⑦向水中加NH4Cl固体
A.①②④⑤B.①⑤⑦C.③④⑥D.④⑦
9.下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.配制一定浓度的FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C.热的碳酸钠溶液去除油污的效果更好
D.草木灰和铵态氮肥一起使用对农作物的肥效更佳
10.下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7;
②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应;
④常温下0.1mol/L的HF溶液的pH为2.3;
⑤HF能与Na2CO3溶液反应,产生CO2气体;
⑥HF与水能以任意比混溶;
⑦1mol/L的HF水溶液能使紫色石蕊试液变红。
A.①②⑦B.②③⑤C.③④⑥D.①④
11.常压下羰基化法精炼镍的原理为:
Ni(s)+4CO(g)
Ni(CO)4(g)。
230℃时,该反应的平衡常数K=2×
10−5。
已知:
Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:
将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:
将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是()
A.第二阶段,Ni(CO)4分解率较高
B.该反应达到平衡时,4v(Ni(CO)4)生成=v(CO)生成
C.增加c(CO),平衡向正向移动,反应的平衡常数增大
D.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
12.H2S与CO2在高温下发生反应:
CO2(g)+H2S(g)
COS(g)+H2O(g)。
在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
下列说法不正确的是
A.升高温度,H2S浓度增加,表明该反应是放热反应
B.通入CO2后,正反应速率先增大后减小
C.H2S的平衡转化率α=4.5%
D.反应平衡常数K=1/351
13.焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)
S2(g)+2CO2(g)。
一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
A.该反应的∆H>
0B.C点时达到平衡状态
C.增加C的量能够增大SO2的转化率D.T3时增大压强,能增大活化分子百分数
14.常温下,将pH均为11,体积均为V0的AOH和BOH溶液,分别加水稀释至体积V,pH随lg
的变化如图所示。
A.碱性强弱:
AOH>BOH
B.水的电离程度:
a=b>c
C.稀释相同倍数时:
c(A+)<c(B+)
D.中和盐酸的能力:
a=b<c
15.将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)⇌2NH3(g)+CO2(g)。
该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
A.该反应的△H>
B.C点对应状态的平衡常数K(C)=10−3.638
C.NH3的体积分数不变时,该反应一定达到平衡状态
D.30℃时,B点对应状态的
16.四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·
H2O)的电离常数为Kb,且pKb=-lgKb=3.38。
常温下,在体积均为20mL、浓度均为0.1mol·
L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·
L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。
A.曲线1代表四甲基氢氧化铵溶液
B.在b、c、e三点中,水的电离程度最大的点是e
C.b点溶液中:
c(Cl-)=c(CH3NH3+)+c(CH3NH2·
H2O)
D.常温下,CH3NH3Cl水解常数
数量级为10-11
17.已知常温下部分弱酸的电离常数如表,下列说法不正确的是
弱酸
电离常数
CH3COOH
Ka=1.76×
10-5
H2SO3
Ka1=1.23×
10-2、Ka2=5.6×
10-8
HF
Ka=6
8×
10-4
A.在1mol/LNaHA(酸式盐)溶液中不一定存在:
c(Na+)=c(H2A)+c(HA-)+c(A2-)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:
c(CH3COO-)>
c(Na+)>
c(H+)>
c(OH-)
C.常温下,pH均等于3的醋酸溶液与盐酸等体积混合后,溶液的pH变小
D.常温下,相同体积、相同物质的量浓度的NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由大到小的顺序是:
Na2SO3>
NaHSO3>
NaF
18.25℃时,向1L0.1mol/L的一元酸HR溶液中逐渐通入氨气(已知25℃时一水合氨的电离平衡常数为K=1.76×
10-5),保持溶液的温度和体积不变,混合溶液的pH与粒子浓度比值的对数变化关系如图所示。
下列叙述错误的是
A.25℃时,0.1mol/L的一元酸HR的电离平衡常数为Ka=10-5
B.当通入0.1mol氨气时,c(NH4+)>
c(R-)>
c(OH-)>
c(H+)
C.当c(R-)=c(HR)时,溶液为酸性
D.HR为弱酸,25℃时随着氨气的通入,c(R-)/[c(OH−)•c(HR)]逐渐增大
19.H2R为二元弱酸,向一定体积的0.1mol/L的H2R溶液中逐滴加入一定浓度的NaOH溶液,溶液中不同形态的粒子(H2R、HR-、R2-)的物质的量分数a(X)随pH的变化曲线如图所示[a(X)=c(X)/[c(H2R)+c(HR-)+c(R2-)]]。
下列说法错误的是
A.常温下,K2(H2R)=1.0×
10-11
B.常温下,HR-在水中的电离程度大于其水解程度
C.pH=9时,c(Na+)>
c(HR-)+2c(R2-)
D.pH=7时,c(H2R)=c(HR-)
20.用石墨作电极电解AlCl3溶液时,如下图所示的电解变化曲线合理的是
A.①④B.②④C.①③D.②③
21.将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应Mn(s)+Sn2+(aq)
Mn2+(aq)+Sn(s)(已知含Sn2+水溶液为米黄色)。
(1)为加快反应速率可以采取的措施有____________、____________;
(2)不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________。
(3)下列能说明反应已达平衡的有____________(填编号)。
A.溶液的颜色不发生变化B.溶液中c(Mn2+)=c(Sn2+)
C.体系中固体的质量不变D.Mn2+与Sn2+浓度的比值保持不变
(4)室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=____________。
若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时c(Mn2+)=____________(不考虑离子水解的影响)。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为______。
22.碳及其化合物广泛存在于自然界。
请回答下列问题:
(1)海洋是地球上碳元素的最大吸收池。
①溶于海水中的CO2主要以四种无机碳形式存在,即:
CO2、H2CO3、___________、___________。
②在海洋碳循环中,可通过如上图所示的途径固碳。
写出钙化作用的离子方程式___________。
(2)过量CO2溶解于海水将使许多海洋生物面临巨大威胁。
研究者提出,用下图所示方法从海水中提取CO2,可以降低环境温室气体CO2的含量。
①a室的电极反应式是__________;
②利用该装置产生
物质X可处理b室排出的海水,获得可排回大海的合格海水,X的化学式是__________。
(3)已知:
H2O的Kb=1.7×
10-5,H2CO3的Ka1=4.3×
10-7、Ka2=5.6×
10-11。
工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。
所得溶液的pH___________7(填“>”、“=”或“<”)。
烟气需冷却至15.5℃~26.5℃的可能原因是____________。
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。
往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
23.CO还原脱硝技术可有效降低烟气中的NOx的排放量。
回答下列问题:
I.CO还原NO的脱硝反应:
2CO(g)+2NO(g)
2CO2(g)+N2(g)△H
(1)汽车在行驶过程中会产生有害气体CO、NO,它们之间能发生上述反应:
①该反应平衡常数K表达式为_________;
②该反应的K极大(570K时为1×
1059),但汽车上仍需装备尾气处理装置,其可能原因是_______;
(2)以Mn3O4为脱硝反应的催化剂,研究者提出如下反应历程,将历程补充完整。
第一步:
_________;
第二步:
3MnO2+2CO=Mn3O4+2CO2
(3)在恒温恒容的密闭容器中,充入等物质的量的CO和NO混合气体,加入Mn3O4发生脱硝反应,t0时达到平衡,测得反应过程中CO2的体积分数与时间的关系如右图所示。
①比较大小:
a处v正______b处v逆(填“>”、“<”或“=”)
②NO的平衡转化率为_______。
II.T℃时,在刚性反应器中发生如下反应:
CO(g)+NO2(g)
CO2(g)+NO(g),化学反应速率v=kPm(CO)Pn(NO2),k为化学反应速率常数。
研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:
(4)若反应初始时P(CO)=P(NO2)=akPa,反应tmin时达到平衡,测得体系中P(NO)=bkPa,则此时v=_________kPa·
s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_________(Kp是以分压表示的平衡常数)。
24.二甲醚(CH3OCH3)是一种新兴化工原料,具有甲基化反应性能。
I.二甲醚的生产:
二甲醚的生产原理之一是利用甲醇脱水成二甲醚,化学方程式如下:
反应i2CH3OH(g)
CH3OCH3(g)+H2O(g)ΔH1
(1)已知:
甲醇、二甲醚的气态标准燃烧热分别为-761.5kJ·
mol-1、-1455.2kJ·
mol-1,且H2O(g)=H2O(l)ΔH=﹣44.0kJ·
mol﹣1。
则反应i的ΔH1=_________kJ·
mol﹣1.
(2)反应i中甲醇转化率、二甲醚选择性的百分率与不同催化剂的关系如下表所示,生产时,选择的最佳催化剂是_________。
甲醇转化率/%
二甲醚选择性/%
SiO2-TiO2/SO42-
35.1
98.1
SiO2-TiO2/Fe3+
52.9
98.7
GSAL-108
81.0
SiO2-Al2O3
62.1
96.4
注:
反应条件:
常压、温度270℃,甲醇液体空速14mL/(g·
h)
(3)选定催化剂后,测得平衡时的甲醇转化率与温度的关系如图所示。
经研究产物的典型色谱图发现该过程主要存在的副反应为:
反应ii2CH3OH(g)
C2H4(g)+2H2O(g)ΔH2=﹣29.1kJ·
mol﹣1
①工业上生产二甲醚的温度通常在270-300℃,高于330℃之后,甲醇转化率下降。
根据化学平衡移动原理分析其原因可能是_________;
根据化学反应速率变化分析其原因可能是_________。
②某温度下,以CH3OH(g)为原料,平衡时各物质的分压数据如下表:
物质
CH3OH(g)
CH3OCH3(g)
C2H4(g)
H2O(g)
分压/MPa
16
0.288
0.016
…
则反应i中,CH3OH(g)的平衡转化率α=_________。
(用平衡分压代替平衡浓度计算;
结果保留两位有效数字。
)
II.二甲醚的应用:
(4)下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
该电池的负极反应式为:
25.硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3+H2O
[B(OH)4]-+H+,Ka=5.72×
10-10。
①25℃时,0.175mol/L的H3BO3溶液pH约为_________(取整数)。
②已知碳酸H2CO3的电离平衡常数为Ka1=4.4×
10-7,Ka2=5.6×
10-11。
将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:
BPO4(s)+4Na(s)+2H2(g)
Na3PO4(s)+NaBH4(s)△H<0
①体系中H2的物质的量与反应时间的关系如表所示:
t/min
2
4
6
8
10
n(H2)/mol
2.0
1.5
1.2
0.9
0.8
下列有关叙述正确的是(填标号)_________。
a.当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b.10min时向容器内通入少量H2,则重新达平衡前ν(放氢)>
ν(吸氢)
c.保持温度不变,平衡后再充入1molH2,达新平衡时H2的浓度为0.4mol/L
d.升高温度,放氢速率加快,重新达到平衡时容器压强增大
②下图为相同时间,NaBH4的产率与反应温度的关系曲线。
NaBH4的产率在603K之前随温度升高而增大的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
①通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6kJ热量,写出该反应的热化学方程式_________。
②t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。
lgt1/2随pH和温度的变化如图所示。
溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;
T1_________T2。
(填“>
”或“<
”)