硫及其重要化合物Word格式.docx
《硫及其重要化合物Word格式.docx》由会员分享,可在线阅读,更多相关《硫及其重要化合物Word格式.docx(9页珍藏版)》请在冰豆网上搜索。
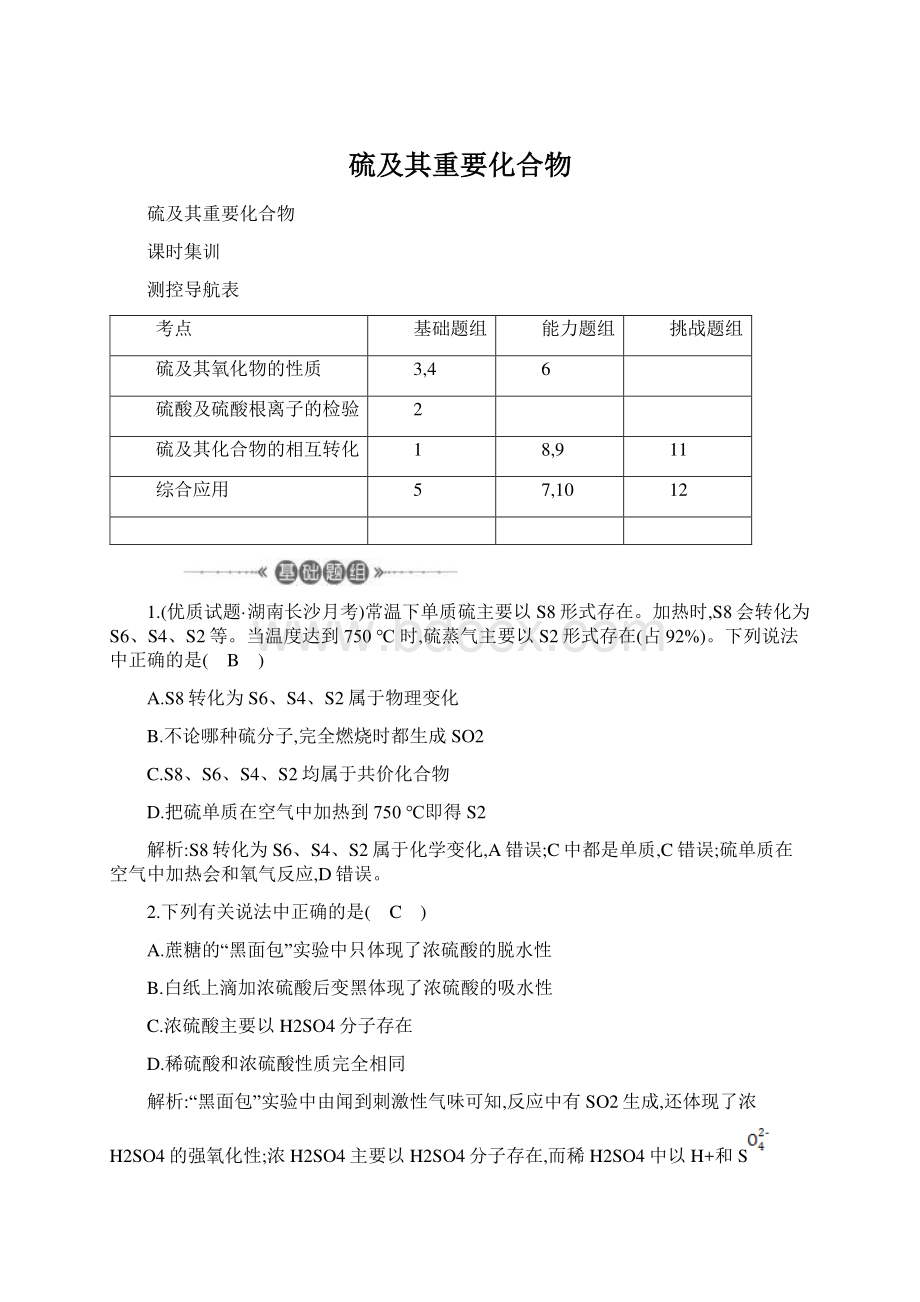
3.(优质试题北京西城区期中)下列事实中,能用同一化学原理解释的是(C)A.氯气和二氧化硫都能使品红溶液褪色B.二氧化硫和乙烯都能使溴水褪色C.二氧化硫和乙烯都能使酸性高锰酸钾溶液褪色D.大量Na2SO4和甲醛都能使蛋白质从溶液中析出解析:
二氧化硫与品红化合生成无色物质,氯气与水反应生成的HClO,具有强氧化性使品红褪色,原理不同,A错误;
二氧化硫和乙烯都能使溴水褪色,前者是氧化还原反应,后者是加成反应,两者原理不同,B错误;
二氧化硫和乙烯都能使酸性高锰酸钾溶液褪色,都体现还原性,原理相同,C正确;
硫酸钠溶液使蛋白质产生盐析,甲醛使蛋白质变性,两者原理不同,D错误。
4.(优质试题甘肃天水期中)下列实验中不能出现沉淀现象的是(B)A.NO2和SO2气体同时通入BaCl2溶液中B.SO2气体通入BaCl2溶液中C.SO2气体通入Ba(NO3)2溶液中D.SO2气体和过量NH3同时通入BaCl2溶液中解析:
由于酸性HClH2SO3,所以SO2气体通入BaCl2溶液中,不能发生任何反应;
SO2气体和过量NH3同时通入BaCl2溶液中,溶液显碱性会电离产生大量的S,S可以与溶液中的Ba2+结合形成BaSO3沉淀。
5.(优质试题江西新余一模)某兴趣小组在实验室用铜和硫酸为原料多种方法制取硫酸铜。
制备方法如下:
.方法一:
(1)浓硫酸试剂瓶上适合贴上的标签是(填序号)。
(2)甲同学取6.4g铜片和10mL18molL-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。
甲同学为了验证其中白色沉淀主要成分,设计下列实验:
实验步骤:
倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:
;
实验结论:
所得白色固体的化学式为。
(3)乙还观察到加热过程中,起初液面以上出现大量白色烟雾,在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。
淡黄色固体消失的原因是(用化学方程式回答)。
直到最后反应完毕,发现试管中还有铜片剩余,乙根据自己所学的化学知识,认为试管中还有硫酸剩余。
他这样认为的理由是。
.方法二:
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是:
2Cu+O22CuO,CuO+H2SO4CuSO4+H2O。
对比甲的方案,你认为丙同学的优点是,。
.方法三:
(5)丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色。
写出反应的化学方程式:
。
解析:
(1)浓硫酸具有强烈的腐蚀性、强氧化性,所以选择的标签为BD。
(2)硫酸铜粉末为白色,而硫酸铜溶液为蓝色,无水硫酸铜溶于水得到蓝色溶液,看到现象为沉淀中白色物质溶解,溶液变蓝色;
则所得白色固体为CuSO4。
(3)硫与浓硫酸反应生成二氧化硫和水,化学方程式为S+2H2SO4(浓)3SO2+2H2O;
随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应。
(4)依据方程式可知:
丙的方案中,硫元素全部转化为硫酸铜,产生等量的硫酸铜,丙消耗的硫酸更少,而且不产生污染物SO2。
(5)铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色,是发生了氧化还原反应所致,该反应为Cu+H2O2+H2SO4CuSO4+2H2O。
答案:
(1)BD
(2)沉淀中白色物质溶解,溶液变蓝色CuSO4(3)S+2H2SO4(浓)3SO2+2H2O随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应(4)产生等量的硫酸铜,丙消耗的硫酸更少不产生污染物SO2(5)Cu+H2O2+H2SO4CuSO4+2H2O6.将少量SO2气体通入BaCl2和FeCl3的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。
针对上述变化,下列分析正确的是(D)A.该实验表明SO2有漂白性B.白色沉淀为BaSO3C.该实验表明FeCl3有还原性D.反应后溶液酸性增强解析:
此反应中二氧化硫作还原剂,被氧化为硫酸,生成的沉淀为硫酸钡,反应中溶液由棕黄色变成浅绿色,三价铁变为二价铁,该实验表明FeCl3具有氧化性,反应后生成HCl,酸性增强。
7.探究浓硫酸和铜的反应,下列装置或操作正确的是(C)A.用装置甲进行铜和浓硫酸的反应B.用装置乙收集二氧化硫并吸收尾气C.用装置丙稀释反应后的混合液D.用装置丁测定余酸的浓度解析:
铜和浓硫酸反应需要加热才可以进行,A错误。
8.为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加如图所示的试剂。
对实验现象的解释或结论错误的是(D)选项实验现象解释或结论Aa中溶液褪色还原性:
SI-Bb中加硫酸后产生淡黄色沉淀S和S2-在酸性条件下发生反应Cc中滴入酚酞试液变红,再加BaCl2溶液后产生白色沉淀且红色褪去S+H2OHS+OH-,所以滴入酚酞变红;
Ba2+SBaSO3(白),使水解平衡左移,红色褪去Dd中产生白色沉淀Na2SO3溶液已被氧化变质解析:
Na2SO3具有还原性,加入盐酸酸化的硝酸钡,生成BaSO4沉淀,无法说明Na2SO3溶液已被氧化变质。
9.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。
A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去。
则下列有关说法正确的是(D)A.X使蔗糖变黑的现象主要体现了X的强氧化性B.若A为铁,则足量A与X在室温下即可完全反应C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生D.工业上,B转化为D的反应条件为加热、使用催化剂解析:
由题意,X为浓H2SO4,D为SO3,B为SO2,蔗糖变黑,主要体现了浓硫酸的脱水性;
浓硫酸和铁在常温下发生钝化;
若A为碳单质,则C为CO2,与少量澄清石灰水反应,生成Ca(HCO3)2,没有沉淀产生;
SO2SO3需要催化剂和加热才能实现。
10.(优质试题山东菏泽三模)二氧化硫为无色气体,有强烈刺激性气味,是大气主要污染物之一。
某化学兴趣小组欲制备并探究SO2的某些性质。
【SO2的制备】用亚硫酸钠与较浓的硫酸反应制备SO2的装置图如图1(夹持仪器省略):
(1)装置图中的错误是;
B中发生反应的化学方程式为;
D的作用是。
【SO2的性质】探究SO2气体性质的装置如图2所示:
(2)装置中的现象是,写出装置中通入足量SO2的离子方程式:
(3)在上述装置中通入过量的SO2,为了验证中发生了氧化还原反应,取中溶液分成两份,并设计了如下实验:
方案一:
往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去;
方案二:
往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是,原因是,写出解释该原因的离子方程式:
(4)SO2可以用来制备硫代硫酸钠,硫代硫酸钠可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。
实验室可通过Na2S、Na2CO3和SO2共同反应来制取Na2S2O3。
写出如图3所示装置三颈瓶中制取Na2S2O3的化学方程式:
(1)根据图1装置,收集二氧化硫时导气管应长进短出,所以C处有错,装置B中发生的反应为Na2SO3+H2SO4(浓)Na2SO4+H2O+SO2;
SO2污染空气,D的作用是进行尾气吸收。
(2)二氧化硫通入硫化钠溶液发生氧化还原反应生成淡黄色沉淀硫单质;
足量二氧化硫和硫化钠溶液反应的离子方程式为2S2-+5SO2+2H2O3S+4HS。
(3)过量的二氧化硫能溶于水,也能使酸性高锰酸钾溶液褪色,所以方案一不合理,反应的离子方程式为5SO2+2Mn+2H2O5S+2Mn2+4H+。
(4)实验室可通过Na2S、Na2CO3和SO2共同反应生成二氧化碳和Na2S2O3,反应的化学方程式为2Na2S+Na2CO3+4SO23Na2S2O3+CO2。
(1)集气瓶C中导管长短反了Na2SO3+H2SO4(浓)Na2SO4+H2O+SO2吸收尾气中的SO2,防止污染环境
(2)有浅黄色沉淀生成2S2-+5SO2+2H2O3S+4HS(3)方案一过量的二氧化硫能溶于水,也能使酸性高锰酸钾溶液褪色5SO2+2Mn+2H2O5S+2Mn2+4H+(4)2Na2S+Na2CO3+4SO23Na2S2O3+CO211.导学号16972107某硫酸厂废气中SO2的回收利用方案如图所示。
下列说法错误的是(C)A.X可能含有2种盐B.Y可能含有NH4HSO4C.a是SO3D.(NH4)2S2O8中S的化合价不可能为+7解析:
废气中的SO2与氨水反应有:
SO2+2NH3H2O(NH4)2SO3+H2O、SO2+NH3H2ONH4HSO3,A正确;
硫酸是强酸,(NH4)2SO3+2H2SO42NH4HSO4+SO2+H2O,B正确;
根据B选项知,产生的气体是SO2,C错误;
S最外层电子数为6,最高价为+6价,不可能是+7,D正确。
12.导学号16972108为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验:
反应产物的定性探究,按如图装置(固定装置已略去)进行实验:
(1)F装置的烧杯中发生反应的离子方程式是;
B装置中的现象是。