上海市九年级化学上学期第三章《溶液》简答题专练Word下载.docx
《上海市九年级化学上学期第三章《溶液》简答题专练Word下载.docx》由会员分享,可在线阅读,更多相关《上海市九年级化学上学期第三章《溶液》简答题专练Word下载.docx(38页珍藏版)》请在冰豆网上搜索。
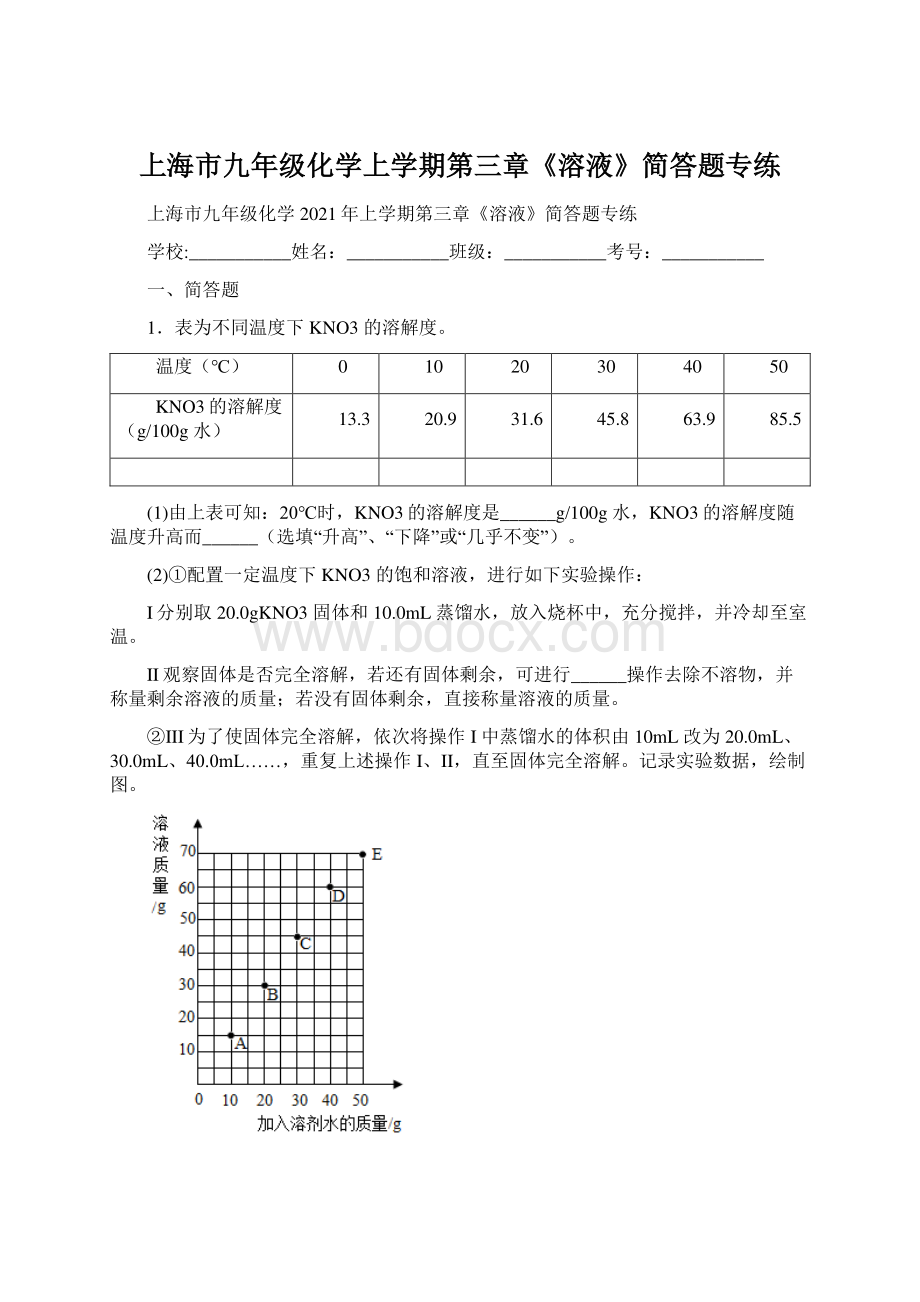
若D点对应的是120g水,则溶质质量为_g如图可知溶液A点转变成B点状态,可通过增加溶剂(加20g水)的方式实现。
则溶液从B点转变成C点状态,可通过_方式实现;
A、B、C、D四点对应的溶液溶质质量分数大小关系是_。
3氯化钠与硝酸钾的部分溶解度如下(单位:
g/100g水)。
温度()20406080100氯化钠36.036.637.338.439.8硝酸钾31.663.9110169246请你根据表格中的数据,将氯化钠的溶解度曲线补充完成。
(在虚线框内作图)_。
在20时,将50克硝酸钾溶解在100克水中,形成的是_(填“饱和”或“不饱和”)溶液,若升温至40,则烧杯中溶液的溶质质量分数为_(精确到0.1%)某温度时,氯化钠与硝酸钾的溶解度相等均为Sg/100g水,则S的最小范围是_。
在固体硝酸钾中混有少量氯化钠可以通过溶解,蒸发浓缩,降温结晶,过滤等步骤分离提纯硝酸钾。
可以利用该方法分离的理由是_。
A固体混合物中硝酸钾的含量较高,氯化钠的含量较低。
B硝酸钾的溶解度受温度影响变化较大。
C40至100,硝酸钾的溶解度始终大于氯化钠。
4如图是A、B两种固体(不含结晶水)物质的溶解度曲线,依图回答:
_时,A、B两物质的溶解度相等;
t1时,将A、B各mg分别加到均盛有50g水的两只小烧杯中,充分搅拌后,若其中有一个烧杯中有固体剩余,则该物质是_(填“A”或“B”);
t3时,A物质饱和溶液的溶质的质量分数为_;
在不改变溶质质量分数的情况下,将该A的饱和溶液变为不饱和溶液的方法是_;
烧杯中盛有一定质量、温度为80、溶质为A的溶液,将其置于室温环境中,测定不同温度时析出固体A的质量测定结果记录如下表溶液的温度/7565503520析出固体A的质量/g002.04.58.4不考虑水蒸发,则65时,该溶液是否为饱和溶液?
_(填“是”、“否”或“无法判断”)根据如图A、B两种固体物质的溶解度曲线,下列说法错误的是_At2时,A、B两物质的溶液中所含的溶质相同Bt2时,A、B饱和溶液的溶质质量分数相同Ct3时,A、B的饱和溶液降温至t2,A析出的固体比B多Dt3时,A、B的饱和溶液降温至t2,A、B所含的溶剂质量不变5水是生命的源泉,也是不可缺少的资源某矿泉水的主要矿物质成分及含量如下表:
成分CaKZnF含量(mg/L)2030.060.02这里Ca、K、Zn、F是指_(填“元素、原子、单质”)家用净水机中用活性炭的作用是_能确认水是由氧元素和氢元素组成的实验是_(填字母)氢气在氧气中燃烧生成水水的蒸发水的电解水的净化如图所示是a、b、c三种物质的溶解度曲线,根据图示回答:
P点的含义是_t2时,将30ga物质加入到50g水中不断搅拌,溶液质量为_g要把t1时C物质的不饱和溶液变为饱和溶液,有关说法正确的是_A可以采取升高温度的方法B溶剂的质量一定不变C溶质的质量分数一定变大D溶质的质量可能不变若a溶液中含有少量b,则提纯a的方法是_将t3时将等质量的a、b、c三种物质饱和溶液降温到t1时,三种溶液的溶剂质量大小关系是_6硝酸钾和氯化铵的溶解度曲线如图所示。
t1时氯化铵的溶解度为_。
在温度不变的情况下,把氯化铵的不饱和溶液变为饱和溶液的方法是_。
硝酸钾中混有少量氯化铵,提纯硝酸钾的方法是_。
t2时将等质量的两种物质的饱和溶液依次降温至t1和t,下列说法正确的是_。
(填编号)At1时,剩余溶液的质量可能相等Bt1时,剩余溶液中溶剂的质量可能相等Ct2与t1之间某一温度时,溶液中溶质的质量分数可能相等Dt2与t之间某一温度时,溶液中溶质的质量可能相等t1时在分别盛有100g水的两个烧杯中,加入50g硝酸钾或50g氯化铵,充分搅拌后现象如图所示。
烧杯甲中溶液的溶质是_,乙中上层清液溶质的质量分数为_。
7下表是NaCl、KNO3在不同温度时的溶解度,根据数据回答。
温度/0102030405060溶解度NaCl35.735.836.036.336.637.037.3(g/100g水)KNO313.320.931.645.863.985.5110氯化钠的溶解度受温度变化的影响_(填“很大”或“很小”)。
50时,KNO3的溶解度_(填“”、“”或“”)NaCl的溶解度;
向烧杯中加入100g水和49.0gKNO3固体配成50的溶液,再冷却到20,烧杯中析出固体的质量为_g。
KNO3中混有少量的NaCl,提纯的方法是_(填“降温结晶”或“蒸发结晶”)。
要比较NaCl和KNO3在水中的溶解性强弱,测定的数据可以是:
相同温度下,等质量的溶质完全溶解达到饱和时所需水的质量;
或_。
如图是有关硝酸钾溶液的实验操作及变化情况,说法正确的是_(填编号)。
A操作I一定是降温Ba与b的溶剂质量可能相等Ca与c的溶质质量一定相等Db与c的溶质质量分数一定相等8如图是硝酸钾和氯化钠的溶解度曲线,回答下列问题。
50时,硝酸钾的溶解度是_;
硝酸钾的溶解度随温度的升高而_(填“增大”或“减小”)。
硝酸钾和氯化钠都属于_物质(填“难溶”、“微溶”、“可溶”或“易溶”)。
“海水晒盐”利用的方法是_(填“蒸发结晶”或“降温结晶”)。
20时,如要提纯9g粗盐(粗盐中氯化钠含量约为80%),溶解时应选择_(填“10mL”、“25mL”或“100mL”)规格的量筒量取所需要的水最为合适,理由是:
_。
在20时,将等质量的硝酸钾和氯化钠分别加入到各盛有100g水的甲、乙两个烧杯中,充分搅拌后现象如图2所示,说法错误的是_(填序号)。
A烧杯乙中的上层溶液是饱和溶液B烧杯甲中溶液的溶质是硝酸钾C烧杯甲中溶液质量比烧杯乙中溶液质量大D将温度升高到50,烧杯乙中的固体不一定全部溶解二、实验题9下表是硝酸钾和氯化钠的部分溶解度数据,回答下列问题。
温度()020406080溶解度(g/100g水)氯化钠35.736.036.637.338.4硝酸钾13.331.663.9110.0169.060时,硝酸钾的溶解度是_。
20,50g水中加入30g硝酸钾,所得溶液的质量是_g。
若硝酸钾中混有少量的氯化钠,提纯硝酸钾可采取的方法是_。
在20时,将等质量的硝酸钾和氯化钠分别加入到各盛有100g水的甲、乙两个烧杯中,充分搅拌后如图,说法错误的是_(填序号)。
A烧杯甲中溶液一定是不饱和溶液B烧杯乙中溶液的溶质是硝酸钾C若使烧杯乙中固体全部溶解,其溶液浓度一定增大D将温度升高到50,烧杯乙中的固体一定全部溶解20时,在100g水中溶解NaCl和KNO3,进行以下实验:
.溶液c所含溶质为_,固体a为_g。
.对整个实验过程分析正确的是_。
A固体b是纯净物B溶液c、d中NaC1质量分数相等C溶液d中硝酸钾的质量小于氯化钠的质量D实验过程中硝酸钾溶液始终是不饱和溶液10根据固体物质甲、乙的溶解度曲线图,回答下列问题:
(1)t1时,甲的溶解度是_。
(2)t2时,将10g乙投入50g水中,充分溶解后形成的是_(选填“饱和”“不饱和”)溶液。
(3)t1时,甲、乙两溶液的质量分数相同,此时溶液的质量分数可能为_(选填编号)。
a.22/122b.40/140c.30/130d.20/120(4)t1时,对有20g甲和16g乙组成的混合物进行如下实验:
(甲、乙溶于水后不会相互反应,也不影响溶解度)形成甲的饱和溶液的是_(选填编号);
B中固体成分是_。
11下表是和在不同温度时的溶解度,回答问题。
温度/102030405060溶解度/g35.836.036.336.637.037.320.931.645.863.985.5110.0I.两种物质中,溶解度受温度影响变化较大的是_。
II.除去中少量的,步骤是:
加水溶解,蒸发浓缩,_,过滤,洗涤,干燥。
.50时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50,剩余溶液的质量:
溶液_(填“大于”、“等于”或“小于”)溶液。
IV.时,按图示操作:
A中溶液_(填“饱和”或“不饱和”)溶液,C中溶液的总质量是_g。
12溶液与人们的生产、生活密切相关。
图1为甲、乙两种固体物质的溶解度曲线。
(1)溶解度随温度升高而增大的物质是_(填“甲”或“乙”)。
(2)某同学按图2所示进行实验,得到相应温度下的A、B、C三种溶液,在A、B、C三种溶液中属于饱和溶液的是_(填字母)。
向C中再加入25g甲,充分搅拌,恢复到t2时,所得溶液中溶质的质量分数为_(结果精确到0.1%)。
(3)将t2时的甲、乙两种物质的饱和溶液降温至t1,所得溶液中溶质的质量分数:
甲_乙(填“”“”或“”)。
13下表是硝酸钾在不同温度时的溶解度(单位:
g/100g水)温度12040607080S(KNO3)13.331.663.9110100169分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度是_;
请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线_。
60时,50g水中最多溶解_gKNO3。
除去KNO3晶体中混有的少量NaCl,通过:
溶解、蒸发浓缩、_、_、洗涤、干燥得到比较纯净的KNO3晶体。
将硝酸钾的饱和溶液变为不饱和溶液,说法正确的是_(选填编号)。
A溶解度一定不变B溶剂质量一定增大C溶质质量一定不变D溶质质量分数一定减小20时,实验室配制一瓶最浓的硝酸钾溶液。
在配制过程中操作顺序是_(填编号),溶质质量分数为_(精确0.1%),装瓶后贴上标签并写上_。
取上述配制的20100g硝酸钾的饱和溶液(如A烧杯)进行如下操作,请回答:
上述溶液中一定是不饱和溶液的是_(填“A、B、C、D、E、F”),所含溶质的质量B_F(填“”、“”、“”或“=”)。
(4)经实验测定,获得不同温度时硝酸钾的溶解度数据。
(5)分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度时_.(6)请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线。
_温度溶解度(g/100g水)2031.64063.950145601107014080169三、综合应用题16下表是甲、乙、丙三种物质的部分溶解度(单位:
g/100g水),请回答。
温度()102030405060甲35.836.036.336.637.037.3乙20.931.645.863.985.5110.0丙0.1820.1650.1600.141x0.121
(1)10时,甲物质的溶解度是_g/100g水。
(2)三种物质中溶解度受温度影响较大的是_;
(3)物质在水中的溶解性与其溶解度(20)的关系示意图如下,则丙物质在水中的溶解性是_;
(4)30时,乙物质饱和溶液的溶质质量分数是_;
(列式即可,不要求计算)(5)50时,三种物质的溶解度由大到小的顺序是_;
(6)向不同温度的100g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图所示。
相关分析正确的是_;
a溶液温度:
b溶液质量:
=c溶液一定是不饱和溶液d使中的固体恰好全部溶解,溶质质量分数不变(7)气体的溶解度也有一定的变化规律,不同温度下,氧气的溶解度随压强变化如下图所示,图中t2对应温度为30,则t1对应的温度_。
A小于30B等于30C大于30D无法确定(8)t时,某物质(固体)的饱和溶液中,溶质与溶液的质量比是n:
m,则在t时,该物质的溶解度为_。
17溶液在生活、生产中有广泛的用途。
(1)在农业生产上,常需要用质量分数为16%的氧化钠溶液选种。
某同学配制1000g质量分数为16%的氯化钠溶液,需要氯化钠的质量为_g;
水的体积为_mL(水的密度近似看作1g/mL)。
(2)利用风吹日晒可以从海水中提取粗盐,粗盐中一般含有少量泥沙等杂质。
以下是制备较纯氯化钠的实验流程,请回答问题。
操作1的原理是_,此操作中玻璃棒的作用是_,操作2的名称是_,其中用到的仪器有铁架台(含铁圈)、酒精灯、玻璃棒、坩埚钳、_,实验结束后计算精盐的产率为_,如果该产率超过100%,可能的原因是_(填序号)。
A食盐没有全部溶解就进行过滤B操作2溶液飞溅C实验结束后称量的精盐很潮湿D过滤时滤纸有破损(3)已知食盐在不同温度下的溶解度数据如下表所示:
温度(C)0102030405060溶解度(克)35.735.83636.336.637.037.3常温下的实验流程中加10mL水,能否使3.0g粗盐中的氯化钠全部溶解?
说明理由_。
化学课上同学们研究物质溶解性的实验如下图所示:
某同学将1.85g氯化钠加入5mL水中,充分振荡后静置,现象如图甲所示,他认为图甲试管中的溶液为该温度下氧化钠的饱和溶液,判断的依据是_。
再对该试管进行加热,得到如图乙所示的溶液,则可判断加热溶液的温度范围是_。
该同学认为得到的是不饱和溶液,你同意他的判断吗?
说出理由_。
18为了增强导电性,实验室用溶质质量分数为的氢氧化钠溶液进行水的电解实验。
实验一:
配制溶质质量分数为的氢氧化钠溶液。
将烧杯放入电子天平上称量时,先要进行_操作。
再将氢氧化钠固体慢慢放入烧杯内,直到电子天平显示出_g数据为止。
实际配制的溶液中溶质的质量分数小于,其原因不可能是_。
A氢氧化钠固体不纯B固体倒入烧杯时洒落到电子天平上C配制时所用烧杯内残留部分水D倒入试剂瓶时有少量液体溅出实验二:
水的电解实验用如图装置进行水的电解实验.如图试管1得到的气体是_。
该反应的方程式为_。
.电解水实验证明了水由_组成。
电解水过程中保持不变的微粒是_(填写微粒名称)。
.时,将等质量的甲、乙固体,分别加入到盛有水的烧杯中,充分搅拌后现象如图1,加热到时现象如图2(不考虑水分蒸发),甲、乙固体溶解度曲线如图3。
下列说法正确的是_(填字母序号)。
A图3中N表示的是甲的溶解度曲线B图2中甲、乙溶液的溶质质量分数相等C图2中甲溶液是不饱和溶液D图1中甲溶液溶质质量分数大于乙溶液溶质质量分数19水是宝贵的自然资料,让我们一起走进“水”的世界。
下图电解水实验中,反应的化学方程式是_。
水电解过程发生改变的微粒名称是_。
医疗上常用0.9%NaCl溶液作生理盐水,配制1000g生理盐水需要氯化钠固体的质量为_还可以制取碳酸饮料,该过程中发生反应的化学方程式为_。
某化学兴趣小组欲进行粗盐的初步提纯。
粗盐的提纯实验步骤包括:
a计算产率,b过滤,c溶解,d蒸发,e称量。
实验步骤的正确顺序是:
e、_、a(填序号)。
若NaCl的产率偏低,则可能的原因是_(填字母)。
A过滤时滤纸有破损B蒸发后所得精盐未完全蒸干,含有水C溶解含泥沙的粗食盐时,加入的水量不足提示:
产率=100%已知KCl的溶解度20时为34g/100g水,40时为40g/100g水。
某实验小组做了如下实验。
A中所得溶液中溶质与溶剂的质量比为_;
溶质的质量分数相等的是_。
I.B和CII.B和E.C和DIV.D和E20水是我们熟悉的物质。
为了测定水的组成,进行如下探究:
甲方案:
电解水时玻璃管内的现象是_;
b管内生成的气体是_;
检验a管内产生气体的方法是_。
生成气体的体积比是_,该实验说明水是由氢、氧元素组成的理论依据是_;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。
若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由2.7%变为3.0%。
试计算.参加反应的水的物质的量_mol(根据化学方程式列式计算)。
.电解前氢氧化钠溶液的质量为_g。
乙方案:
该方案的实验目的是_,氢气在氧气中燃烧,反应的化学方程式是_,现象_;
该实验能否达到实验目的,并阐述理由_。
下表是KNO3、NaCl在不同温度下的部分溶解度数据。
温度()0102030405060708090100KNO313.320.932.045.864.085.5110.0138.0169.0202.0246.0NaCl35.735.836.036.336.637.037.337.838.439.039.8.以上两种物质溶解度的变化受温度影响较小的是_。
.在40时,将40gKNO3溶解在50g水中,形成溶液的质量是_g。
若升温至60,形成的溶液为_(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为_。
.根据表中数据,找出60.0g水能够溶解66.0gKNO3的温度范围是_。
.固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为_。
.气体在水中的溶解度也有一定的变化规律。
下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是_。
AP1P2BP1P2CP1P2D无法确定参考答案131.6升高过滤550dE【详解】
(1)由上表可知:
20C时,KNO3的溶解度是31.6g,KNO3的溶解度是随温度升高而升高,故答案:
31.6g;
升高。
(2)取20.0gKNO3固体和10.0mL蒸馏水,水的密度为1g/cm3,所以水的质量为10g,放入烧杯中,充分搅拌,并冷却至室温。
由图可知,A点加入溶剂水的质量为10g,对应的溶液质量为15g,则溶液中KNO3的质量为15g-10g=5g,可通过过滤操作去除不溶物,故答案:
过滤。
由图可知,A点加入溶剂水的质量为10g,对应的溶液质量为15g,则溶液中KNO3的质量为15g-10g=5g,此时溶液达到饱和状态,KNO3的溶解度为=50g;
由KNO3的溶解度表可知,30C时KNO3的溶解度是45.8g,40C时KNO3的溶解度是63.9g,此时KNO3的溶解度为50g,45.8g50gAB【详解】:
(1)上层清液为澄清石灰水是均一的、稳定的混合物,属于溶液;
下层未完全溶液的部分石灰乳不是均一的、稳定的,是悬浊液;
(2)CuSO溶液溶液各部分颜色相同、溶液各部分谘质质量分数相同、溶液久置后颜色不变说明它是均一的、稳定的;
滴入NaOH溶液有蓝色沉淀生成,是硫酸铜溶液和氢氧化钠溶液的化学反应,故不能说明CuSO溶液是均一、稳定的,故选D;
(3)20时,NaCl的溶解度是36g,40g氯化钠投入100g水中,只能溶解36g,所以所得溶液溶质的质量分数=100%=26.5%;
20时,硝酸钾的溶解度是31.6g,30g硝酸钾投入100g水中全部溶解,所以所得溶液溶质的质量分数=100%=23.1%;
20时,胆矾的溶解度是32g,胆矾溶于水后溶液中的溶质是硫酸铜,且25g可以完全溶于水100g,所以所得溶液溶质的质量分数=12.8%;
(4)由图示可知,20时,该物质的溶解度是40g;
设120g水中溶解溶质的质量为x时达到饱和。
x=48g根据溶解度的特点可知,溶液从B点转变成C点状态,可通过加20g溶质方式实现;
根据图示知,由于图中的都是该温度下达到饱和时的溶质和溶剂情况,所以直线上的二个点的质量分数相等,而B点明显相对A点而言是,水多而溶质相同,所以质量分数AB,C、D是饱和溶液,A、B是不饱和溶液,所以C、D溶质的质量分数大于A、B溶质的质量分数。
所以A、B、C、D四点对应的溶液溶质质量分数大小关系是:
C=DAB。
故答案为
(1)A;
B;
(2)D;
(3)26.5%;
23.1%;
12.8%;
(4)40;
48;
过加20g溶质;
3饱和33.3%36.0S17.4降温结晶相同温度下,等质量的溶剂完全溶解达到饱和时所需溶质的质量BD【详解】由表中数据可知:
氯化钠的溶解度受温度变化影响较小;
由表中数据可知:
50时,KNO3溶解度大于NaCl的溶解度;
50时KNO3的溶解度是85.5g,向烧杯中加入100g水和49.0g氯化铵配成50的溶液,此时溶液为不饱和溶液;
再冷却到20,20时KNO3的溶解度是31.6g,烧杯中析出固体的质量为:
49.0g-31.6g=17.4g;
硝酸钾的溶解度随温度的升高增大明显,故KNO3中混有少量的NaCl,可先将混合物溶于水配成高温下的饱和溶液,然后再采用降温结晶的方法就可以提纯KNO3;
或相同温度下,等质量的水中达到饱和时所溶解的溶质质量;
A、操作I是将不饱和溶液转化为饱和溶液,不一定是降温,也可能是增加溶质、蒸发溶剂,故选项说法错误;
B、操作I是将不饱和溶液转化为饱和溶液,b是饱和溶液,若采用的是增加溶质的方法,溶质的质量不相等,但水的质量可能相等,故选项说法正确;
C、a是一定温度下的不饱和溶液,b转化为c的过程中,有硝酸钾析出,a与c的溶质质量不相等,故选项说法错误;
D、b与c均为相同温度下的饱和溶液,溶质质量分数一