精修版化学高考经典演练123 常见气体的实验室制法含答案Word文档下载推荐.docx
《精修版化学高考经典演练123 常见气体的实验室制法含答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《精修版化学高考经典演练123 常见气体的实验室制法含答案Word文档下载推荐.docx(14页珍藏版)》请在冰豆网上搜索。
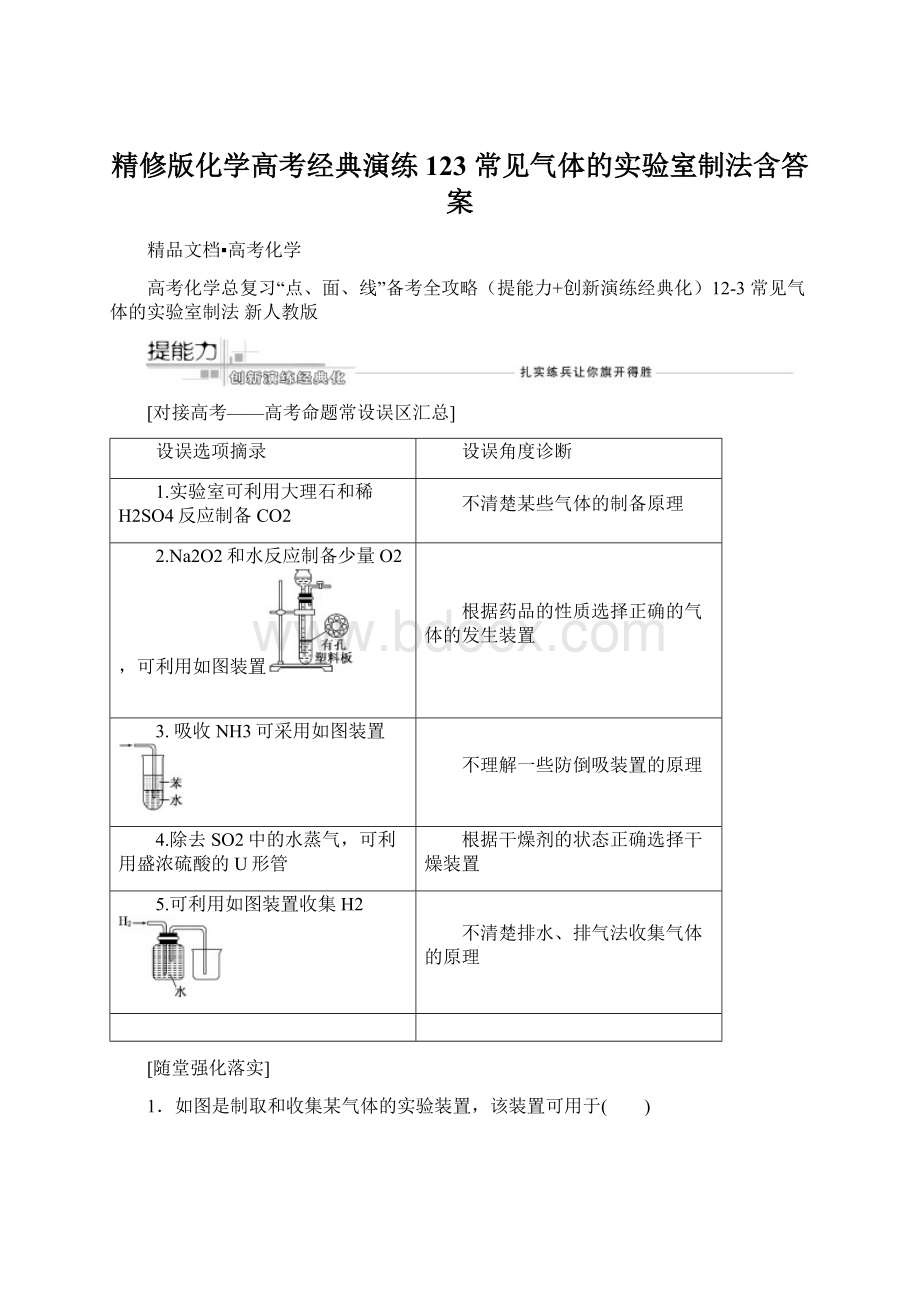
A.瓶中盛满水,从B口进气,用排水法收集NO2
B.瓶中盛适量浓硫酸,从A口进气来干燥NH3
C.从B口进气,用排空气法收集CO2
D.瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
NO2
能与水发生反应,不能用排水法收集NO2,NH3不能用酸性干燥剂(如浓H2SO4)干燥;
CO2的密度比空气大,收集CO2时应A口进气,相当于向上排空气法收集。
D
3.下列各组气体在常温下能共存且能用向上排空气法收集的是( )
A.NO和O2 B.HCl和NH3
C.H2和COD.SO2和CO2
NO与O2反应生成NO2,不能共存;
HCl与NH3反应生成NH4Cl,不能共存;
H2和CO能共存但均不能用向上排空气法收集;
SO2和CO2的密度大于空气,故可用向上排空气法收集,D项正确。
4.
实验室采用如图装置制备气体,下列有关说法不正确的是( )
A.实验前必须检查装置的气密性
B.该装置可以用于制备氢气、氧气和氨气
C.为了防止固体颗粒堵塞导气管,常在试管口放一团棉花
D.若用该装置制备氧气,并用排水法收集,实验结束时要先将导管撤出水槽,再停止加热
此装置只能用于加热固体制备气体,如制备氧气、氨气,不可以用于制备氢气。
5.下列能达到
实验目的的是( )
A.除去杂质气体CO2B.收集并吸收多余的Cl2
C.干燥Cl2D.吸收HCl制盐酸
A选项,导气管应该“长进短出”;
B选项,Cl2密度比空气密度大,Cl2会直接进入NaOH溶液,收集不到气体;
D选项,HCl易溶解于水,发生倒吸。
C
6.下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。
请回答下列问题:
(1)能用作干燥氨气的装置有________(填字母);
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有________(填字母);
(3)在氯气和铁反应实验中,
能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有________(填字母);
(4)能用于乙烯与溴水反应制二溴乙烷的实验装置有________(填字母);
(5)若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是_____________
___________________________________________________________。
(1)氨气极易溶于水,一般用固态干燥剂,所以选D、E装置;
(2)A装置可用于向上排空气或排饱和食盐水溶液收集氯气,A还可以排水收集一氧化氮气体;
B排饱和食盐水溶液收集氯气,还可以排水收集一氧化氮气体。
(3)A为气体的净化装置。
(4)乙烯与溴水反应不需要特殊的反应条件,所以选A,将乙烯通入溴水即可。
(5)二氧化硫易溶于水,且与氢
氧化钠溶液反应,需要防止倒吸。
(1)D、E
(2)A、B (3)A (4)A
(5
)防止倒吸
[提能综合检测]
一、单项选择题(本题包括7小题,每小题4分,共28分)
1.关于下列各实验装置图的叙述中,正确的是( )
A.装置①可用于分离沸点不同且互溶的液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4Cl为原料,装置③可用于实验室制备少量的NH3
D.装置④中从b口进气可用排水法收集NO2、CO等气体
装置①是蒸馏装置,可用于分离沸点不同且互溶的液体混合物;
装置②中的导气管插入水中,将导致倒吸;
装置③中,NH4Cl受热分解产生的NH3和HCl在试管口又重新化合生成NH4Cl,故不能用来制取NH3;
NO2与水反应,故不能用排水法收集。
A
2.下列各图所示装置,肯定不符合气密性要求的是( )
D中上下移动容器时两液面保持水平,说明漏气。
3.如图是实验室常见的气体制取、干燥和收集装置。
若用过氧化氢和催化剂二氧化锰制取干燥的氧气,则合理的装置组合为( )
A.①⑤⑧B.③④⑦
C.②⑤⑥D.②④⑧
用H2O2制O2的反应原理为2H2O2
2H2O+O2↑,由反应物的状态和反应条件可选②作为制取装置。
干燥O2可选用④或⑤装置,要收集干燥的O2只能用⑥装置,故合理的装置组合为②⑤⑥或②④⑥。
4.下图中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号
气体
a
b
c
NH3
浓氨水
生石灰
碱石灰
CO2
盐酸
碳酸钙
饱和NaHCO3
NO
稀硝酸
铜屑
H2O
浓硝酸
NaOH溶液
A中干燥氨气的碱石灰为固态,应装于干燥管中,不可用洗气瓶,用氨气不可用向上排空气法收集,故A错误;
B中饱和NaHCO3溶液的作用是除去挥发出来的HCl气体,B正确;
C中生成的NO能与空气中的氧气反应,不能用排空气法收集,故C错误;
D中NaOH溶液能与NO2反应,致使收集不到NO2,故D错误。
5.下列气体制备与收集装置错误的是( )
D选项,NO气体易与空气中氧气发生反应,不能用排空气法收集。
A、B、C选项气体的反应原理、发生装置、收集装置都正确。
6.要组装一套实验室利用液体和液体反应制备气体的装置,现设计了如下的五步操作,正确的程序是( )
①将蒸馏烧瓶固定在铁架台上
②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网
③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集装置中
④检查装置的气密性(利用固定装置微热的方法检查气密性)
⑤在蒸馏烧瓶中装好分液漏斗,连接好导气管
A.②①⑤④③B.④①②⑤③
C.①②⑤④③D.①⑤④②③
实验仪器的安装原则:
从下向上,从左向右。
首先放置酒精灯,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网;
把烧瓶固定在铁架台上,在烧瓶上装好分液漏斗,连好导气管,检查气密性;
装置不漏气后,再加液体药品开始反应,制取气体。
7.下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。
下列选项中正确的是( )
发生装置的药品
干燥和集气装置
A.
双氧水和二氧化锰
图1
B.
大理石和稀盐酸
C.
铜和稀硝酸
图2
D.
生石灰和浓氨水
A项产生O2,应用向上排空气法收集;
B项产生的CO2不能用碱石灰干燥,也不能用向下排空气法收集;
C项生成的NO不能用排空气法收集;
D项产生的NH3可用碱石灰干燥,可用向下排空气法收集。
二、双项选择题(本题包括3小题,每小题6分,共18分)
8.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A.干燥SO2 B.实验室制取并收集O2
C.装置气密性的检查D.分离乙醇和乙酸的混合液
A选项SO2不与CaCl2反应,正确;
B选项氧气比空气密度大,应用向上排空气法收集;
C选项正确;
D选项乙醇和乙酸互溶,不能用分液法分离。
9.为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入( )
A.饱和NaHCO3溶液;
无水CaCl2固体
B.饱和NaHCO3溶液;
浓硫酸
C.浓硫酸;
饱和NaHCO3溶液
D.饱和Na2CO3溶液;
稀硫酸
用大理石和盐酸反应制得的CO2中,含有少量HCl,可用饱和NaHCO3溶液除去;
干燥CO2可用浓硫酸或无水CaCl2固体作干燥剂。
注意:
应先净化,后干燥。
AB
10.下列实验装置正确的是( )
A项是实验室制取氯气的装置;
B项收集氧气应该“长进短出”;
C项氯化铵固体分解生成氨气和氯化氢,氨气和氯化氢在试管口又化合成氯化铵固体,得不到氨气,甚至可能会堵塞导管;
D项浸有NaOH溶液的棉花团,能防止SO2扩散到空气中。
AD
三、非选择题(本题包括4小题,共54分)
11.(13分)下表是实验室制备气体的有关内容:
实验内容
实验原理
①
制备氧气
H2O2→O2
②
制备氨气
NH
4Cl→NH3
③
制备氯气
HCl→Cl2
(1)上述气体中:
从制备过程看,必须选择合适的氧化剂才能实现的是________(填气体的化学式)。
(2)写出实验室用H2O2制备O2的化学方程式:
_______________________________。
(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质:
①通入氯气后,A中的现象是_______________________________________________;
②C装置中发生反应的离子方程式为_____________________________________;
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤、现象及结论):
________________________________________________________________________;
____________________________________________
____________________________;
________________________________________________________________________。
④整套实验装置存在的明显缺陷是无尾气吸收装置;
吸收多余的氯气用氢氧化钠溶液,请写出该反应的离子方程式_____________________
_____________________,在此反应中若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子数为________个。
(1)实验室用H2O2制备O2的化学方程式为
2H2O2
2H2O+O2,H2O2本身既是氧化剂又是还原剂;
制备氨气发生的为复分解反应;
只有制备氯气时,HCl→Cl2,HCl作为还原剂,必须加入合适的氧化剂才能实现。
(3)①通入氯气后,A中的现象是溶液变为蓝色。
②C装置中发生反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。
③Na2SO3被氧化为Na2SO4。
④1molCl2与NaOH反应,转移电子为1mol,所以若有2.24L(0.1mol)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为0.1mol即6.02×
1022个。
(1)Cl2
(2)2H2O2
2H2O+O2
(3)①溶液变为蓝色 ②2Fe2++Cl2===2Fe3++2Cl-
③取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴加氯化钡溶液,产生白色沉淀,则证明亚硫酸钠被氧化。
④Cl2+2OH-===Cl-+ClO-+H2O 6.02×
1022
12.(13分)某化
学兴趣小组为了探究某些气体的性质,设计了如图所示的实验装置。
实验时将A、D中产生的气体同时通入C中。
(K为止水夹,部分夹持仪器已略去)
回答下列问题:
(1)简述实验前检查A部分装置的气密性的方法_____________________
___
(2)仪器E的名称是_______________________,锥形瓶内小试管F的作用是________________________________________________________________________。
(3)若b是生石灰,a是________时,在C中有白烟产生,写出生成白烟的化学方程式________________________________________________________________________
(4)若a是质量分数为75%的硫酸,b是亚硫酸钠粉末,在C中盛适量的BaCl2溶液时,写出C中发生反应的离子方程式_________________________________________。
(5)从环保的角度出发,上述实验装置中需要改进的是___________________________。
A中生成的是Cl2,D中锥形瓶中加一小试管可以减少液体的用量,同时对长颈漏斗形成液封。
若D中用生石灰和浓氨水作用会生成NH3,NH3与Cl2在C中发生反应生成NH4Cl,产生白烟;
若D中用浓硫酸和Na2SO3固体反应,生成SO2,在C中Cl2、SO2、BaCl2溶液发生反应,有BaSO4生成。
该装置缺少尾气处理装置,会对空气产生污染。
(1)关闭止水夹K,经分液漏斗向蒸馏烧瓶加水,稍后若水不能加入,说明A的气密性良好(或向B中加适量水,将A的导管出口浸入水中,关闭分液漏斗活塞,用酒精灯或手给蒸馏烧瓶微热,若B中导管出口有气泡逸出,熄灭酒精灯或松开手后,导管内有高出液面的水柱,一段时间不降,说明气密性良好)
(2)蒸馏烧瓶 减少液体用量并形成液封,防止气体逸出
(3)浓氨水 3Cl2+8NH3===6NH4Cl+N2(分步写化学方程式也可)
(4)Cl2+SO2+Ba2
++2H2O===2Cl-+BaSO4↓+4H+(分步写离子方程式也可)
(5)在C管口外接尾气处理装置,防止污染空气
13.(14分)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
(1)A中发生反应的化学方程式为__________________________________。
(2)各装置的正确连接顺序为(填写装置序号)A→________→________→________→D。
(3)装置C的作用是_____________________________________________________,
写出装置D中反应的离子方程式________________________________________。
(4)反应开始后,B中硬质玻璃管内的现象为____________________________________;
可以检验生成物中含有Fe3+的试剂是______________(填写试剂名称)。
(5)
该小组欲用右图所示装置收集尾气,并测量多余气体的体积。
①若右图所示量气装置由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
②为提高测量的准确性,右图装置中的液体可用__________,收集完气体后,读数前应进行的操作是________________________。
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积________(填“偏大”“偏小”或“无影响”)。
根据实验目的,则A为制Cl2装置,MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,氯气中存在的HCl、H2O杂质应先通入E中除
去HCl,再通入C中除去H2O,干燥Cl2进入B中与Fe反应,多余Cl2用D吸收,则仪器连接顺序为A→E→C→B→D;
Fe在Cl2中燃烧出现红棕色烟,Fe3+的检验试剂为KSCN溶液,出现血红色溶液;
由于Cl2在饱和NaCl溶液中的溶解能力小,因此须用排饱和NaCl溶液来收集Cl2,且读数前必须使左右两仪器中液面相平;
由于滴定管刻度由上而下变大,则俯视时引起读数偏小,即液面上升量
偏大,相当于所收集气体体积偏大。
(1)4HCl(浓)+MnO2
MnCl2+Cl2+2H2O
(2)E→C→B
(3)干燥Cl2,防止FeCl3的水解
Cl2+2OH-===Cl-+ClO-+H2O
(4)红棕色的烟 硫氰酸钾
(5)①碱式 ②饱和NaCl溶液 上下移动滴定管,使左右两边液面相平 ③偏大
14.(14分)氢化钙固体是登山运动员常用的能源提供剂。
某兴趣小组拟选用如下装置制备氢化钙。
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)。
(2)根据完整的实验装置进行实验,实验步骤如下:
检查装置气密性后,装入药品;
打开分液漏斗活塞________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式__________________________________________;
②该同学的判断不正确,原因是______________________________________
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象________________________________________________________________________
(
5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是________________________。
本题主要考查制取氢化钙的实验步骤、实验装置的连接以及氢化钙的鉴别与用途,意在考查考生的实验操作、探究能力。
(1)用盐酸和锌反应制取氢气,再与钙反应得氢化钙,其中通氢气前要除去杂质HCl并干燥除去水,制取氢化钙的装置要与盛有无水氯化钙的干燥管连接,从而防止空气中的水蒸气与其反应。
(2)首先收集氢气并验纯,然后加热反应,最后关闭活塞。
(3)氢化钙与水反应生成氢氧化钙和氢气,方程式为CaH2+2H2O===Ca(OH)2+2H2↑,金属钙与水反应也生成氢氧化钙和氢气。
(4)区别金属钙和氢化钙,可根据氢化钙中含有氢元素,让其燃烧生成水,并用无水硫酸铜来检验。
(1)i→e,f→d,c→j,k(或k,j)→a
(2)B、A、D、C
(3)①CaH2+2H2O===Ca(OH)2+2H2↑
②金属钙与水反应也有类似现象
(4)取适量氢化钙,在加热条件下与干燥氧气反应,将反应气体产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;
取钙做类似实验,观察不到白色变为蓝色
(5)氢化钙是固体,携带方便