高三专题平衡常数的计算问题Word格式文档下载.docx
《高三专题平衡常数的计算问题Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《高三专题平衡常数的计算问题Word格式文档下载.docx(24页珍藏版)》请在冰豆网上搜索。
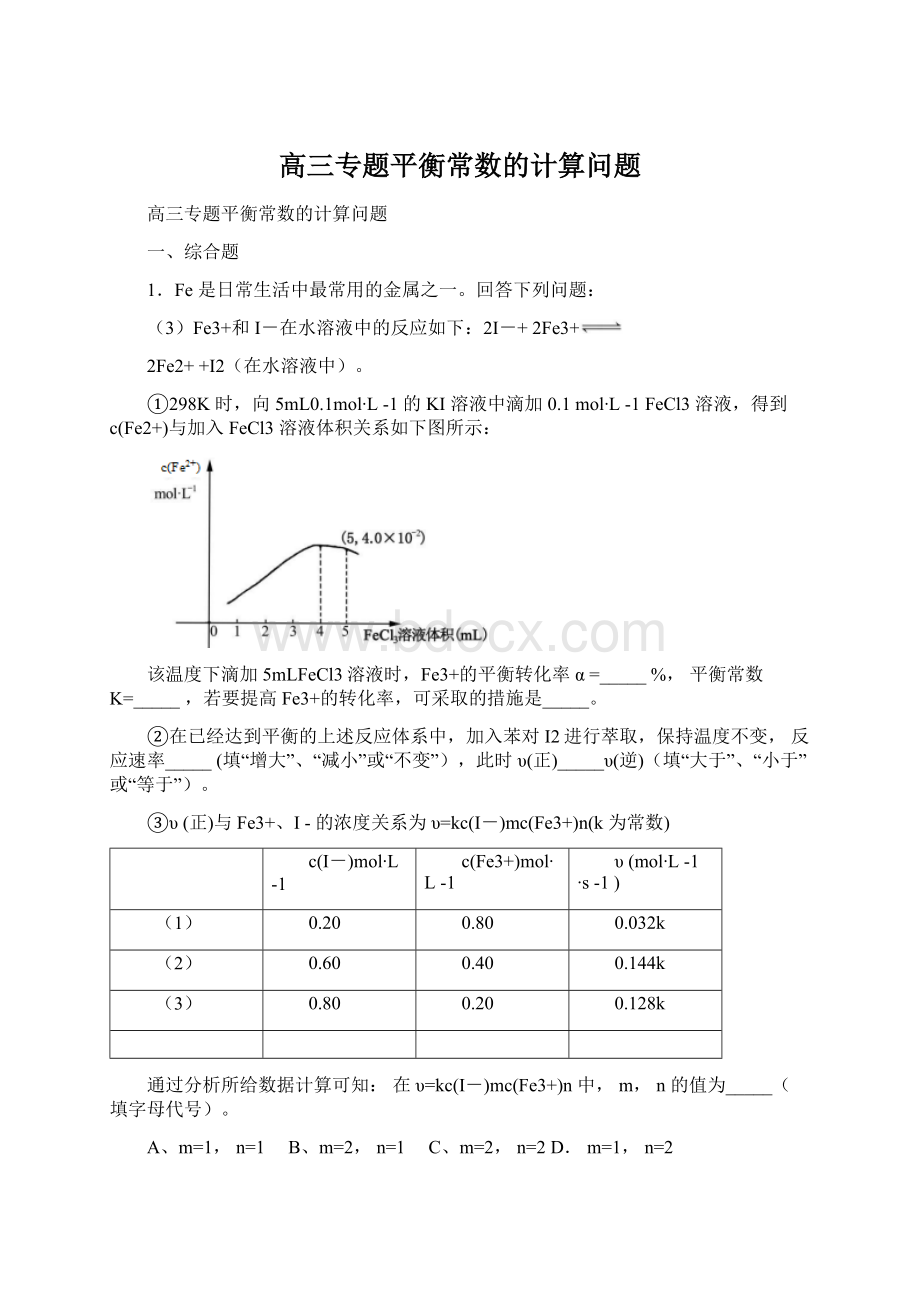
mol-1
3.废气中的含氮氧化物是主要的大气污染物,因此脱出废气中的含氮氧化物对于保护大气环境具有重要的意义。
常温下,在通入O2的条件下用0.1mol/L的NaOH溶液吸收NO,产物为NaNO3和NaNO2。
已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×
10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数Ka=5.1×
10-4),则:
①
=________mol/L
②反应后溶液中NO3-的浓度约为___________mol/L
③某溶液中c(NO2-)=1.0×
10-6mol/L,取该溶液5mL,加入一滴0.1mol/L硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀______________。
(Ksp(AgNO2)=2×
10-8)
【答案】5.1×
1060.034mol/L滴入硝酸银溶液后:
c(NO2-)≈1.0×
10-6mol/L,
≈1.0×
10-3mol/L,c(NO2-)×
c(Ag+)≈1.0×
10-6×
1.0×
10-3=1.0×
10-9<
Ksp(AgNO2),故不能生成沉淀
4.研究发现,NOx和SO2是雾霾的主要成分。
SO2主要来源于煤的燃烧。
燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:
亚硫酸:
Ka1=2.0×
10-2Ka2=6.0×
10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:
_________________________
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。
通入NO的电极反应式为____________________;
若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
【答案】HSO3-的水解常数K=Kw/Ka1=5.0×
10-13<
Ka2=6.0×
10-7(HSO3-的电离常数),所以显酸性6H++NO+5e-=NH
+H2O32
5.工业上利用β-锂辉矿(LiAlSi2O6和少量MgO、CaCO3杂质)
制备金属锂,工艺流程如下:
一定温度下,Ksp(CaCO3)=
2.5×
10-9,Ksp(Li2CO3)=
1.6×
10-3,若反应Ⅱ
的溶液中c(Ca2+)和c(Li+)均为1.0
mol·
L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO32-)应控制的范围为_________;
实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,分析使用草酸钠的原因为_____________________。
【答案】2.5×
10-9mol·
L-1<
c(CO32-)≤1.6×
10-3mol·
L-1草酸钙难溶于水,而草酸锂易溶于水2Li++CO32-=Li2CO3↓
6.从工业含锌废渣(主要成分为ZnO,还含有SiO2、Fe3+、Cu2+、Pb2+等杂质)制取ZnCO3∙2Zn(OH)2的一种工艺如下:
除Cu2+、Pb2+时,也可加入(NH4)2S使其生成硫化物沉淀。
已知Ksp(CuS)=6.3⨯10-36,Ksp(PbS)=8.0⨯10-28,要使溶液中Cu2+、Pb2+的浓度均小于1.0⨯10-5mol·
L-1,则沉淀时需控制S2-的浓度至少为_____mol·
L-1。
【答案】8.0⨯10-23
7.研究表明:
丰富的CO2可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
将CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气。
现在10L恒容密闭容器中投入1molCO2和2.75
mol
H2,发生反应:
CO2(g)+
3H2(g)
CH3OH(g)+H2O(g)。
在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
①能判断该反应达到化学平衡状态的是_______(填字母)。
a.c(H2):
c(CH3OH)=3:
1b.容器内氢气的体积分数不再改变
C.容器内气体的密度不再改变d.容器内压强不再改变
②上述反应的△H______0(填“>
”或“<
”),图中压强p1____p2(填“>
”)。
③经测定知Q点时容器的压强是反应前压强的9/10,则Q点H2的转化率为____________。
④N点时,该反应的平衡常数K=______(计算结果保留两位小数)。
(3)用生石灰吸收CO2可生成难溶电解质CaCO3,其溶度积常数Ksp=2.8×
10-9。
现有一物质的量浓度为2×
10-4mol/L纯碱溶液,将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为___mol/L。
【答案】bd<
>
20.5%1.045.6×
10-5
8.煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。
请回答下列问题:
煤气燃烧后含硫杂质转化成的SO2,可以被氨水吸收,已知25℃时,NH3·
H2O的Kb=1.8×
10-5,H2SO3的Ka1=1.3×
10-2,Ka2=6.2×
10-8.将SO2通入氨水中,当溶液呈中性时,溶液中的c(NH4+)/c(HSO3-)=_____________________.此时溶液中各离子浓度大小关系为:
_____________________
【答案】2.24c(NH4+)>
c(HSO3-)>
c(SO32-)>
c(H+)=c(OH-)
9.
(1)25℃时,利用pH试纸测得0.1mol•L-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;
向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(2)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
若某次捕捉后得到pH=10的溶液,则溶液c(CO32-)∶c(HCO3-)=_______。
[常温下K1(H2CO3)=4.4×
10-7、K2(H2CO3)=5×
10-11]。
【答案】10-5mol·
L-1减小、1:
2或0.5
10.一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
甲醇是重要的化学工业基础原料和清洁液体燃料。
工业上可利用CO或CO2来生产燃料甲醇。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应
平衡常数
温度℃
500
800
①2H2(g)+CO(g)
CH3OH(g)
K1
2.5
0.15
②H2(g)+CO2(g)
H2O(g)+CO(g)
K2
1.0
2.50
③3H2(g)+CO2(g)
CH3OH(g)+H2O(g)
K3
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。
则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。
据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
(2)一种甲醇燃料电池,使用的电解质溶液是2mol·
L-1的KOH溶液。
(3)一定条件下甲醇与一氧化碳反应可以合成乙酸。
通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:
2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________mol/L。
【答案】=K1·
K2、b/(a-2b)
11.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
生成氢氧化物沉淀的pH
Mn(OH)2
Fe(OH)2
Fe(OH)3
Cu(OH)2
开始沉淀时
8.3
6.3
2.7
4.7
完全沉淀时
9.8
3.7
6.7
滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是_____,在CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=_________(Ksp(CuS)=1.2×
10-36,Ksp(MnS)=2.5×
10-13)。
【答案】MnS+Cu2+=Mn2++CuS、4.8×
10-24
12.“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)已知973K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973K时,测得:
NO2(g)⇌NO(g)+
O2(g)K1=0.018;
SO2(g)+
O2(g)⇌SO3(g)K2=20;
则反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)的K3=________
②973K时,向容积为2L的密闭容器中充入SO2、NO2各0.2mol。
平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
当温度升高时,SO2(g)+NO2(g)⇌SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”),判断理由是______________________。
(2)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。
研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。
下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;
Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·
L-l·
min-1。
反应时间/min
10
20
30
40
Ⅰ
c(NO3-)/10-4mol·
L-1
8
3.2
1.6
0.8
0.64
Ⅱ
L-1(含少量Cu2+)
0.48
0.32
(3)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。
(已知常温下K1(H2SO3)=1.5×
10-2,,K2(H2SO3)=1.02×
10-7)
A.c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-)
B.c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)
C.c(Na+)>
c(SO32-)>
c(HSO3-)>
(OH-)c>
c(H+)
D.c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
【答案】0.3637.5%减小温度升高时,-lg(
)减小,则
增大,化学平衡向逆向移动,化学平衡常数减小H+与Fe粉反应生成H2Fe与置换出的Cu构成原电池,加快NO3-的去除速率3.84×
10-5CD
13.碳元素与人们的日常生活、生活和科学研究密不可分。
请回答下列问题。
(1)利用活性炭的还原性可处理机动车的尾气(氮氧化物),发生如下反应C(s)+2NO(g)
N2(g)+CO2(g)△H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
时间/mim
浓度/(mol/L)
50
NO
2.0
1.16
0.6
N2
0.42
a
b
1.2
CO2
①0~20
min内的平均反应速率v(CO2)=_______mol·
L-1·
min-1;
第一次达到平衡的平衡常数K=__________。
②30
min时只改变某一条件,则改变的条件可能是______________(填字母编号)。
a.升高温度b.降低温度c.再通入一定量的NO
d.缩小容器的体积e.加入合适的催化剂f.增大容器休积
(2)炼钢炉中发生复杂的化学反应,其中包括反应:
C(s)+CO2(g)
2CO(g)
△H>
0。
将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。
达到平衡时,容器内气体体积分数与温度的关系如下图:
①CO2体积分数为86%时,CO2的转化率为______________%(结果保留一位小数,下同)。
②已知:
气体分压P分=P总×
气体体积分数,达到平衡时用气体的分压代替气体浓度所表示的平衡常数为Kp,则900℃时,Kp=______________(用含p总的代数式表示)。
【答案】0.04mol·
min-14cd7.5%14.73p总
14.镧系金属元素鈰(Ce)常见有+3、+4两种价态,鈰的合金耐高温,可以用来制造喷气推进器零件。
常温下,当溶液中的某离子浓度
时,可认为该离子沉淀完全。
据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3+已完全沉淀。
【答案】9
15.甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250
℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=__________;
若要进一步提高甲醇积分数。
可采取的措施有________。
【答案】ABD、0.148、增大压强(降低温度)
16.Ⅰ.甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应①:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)ΔH1=−49.58kJ·
mol−1
(1)对于反应①,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填字母)。
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
(2)若在1L密闭容器中充入3molH2和1molCO2发生反应①,250℃时反应的平衡常数K=__________;
【答案】ABD、0.148增大压强(或降低温度)
17.氧化铝(Al2O3)和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)
Si3N4(s)+12HCl(g)△H<0
某温度和压强条件下,分别将0.3molSiCl4(g)、0.2molN2(g)、0.6molH2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是_________mol/(L·
min)。
②若按n(SiCl4):
n(N2):
n(H2)=3:
2:
6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应______(填“增大”、“减小”或“不变”)。
(2)298K时,Ksp[Ce(OH)4]=1×
10—29。
Ce(OH)4的溶度积表达式为Ksp=_______________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×
10-5mol·
L-1,需调节pH为______以上。
【答案】0.024、减小、c(Ce4+)•[c(OH-)]48
18.氮的氧化物是造成大气污染的主要物质。
研究氮氧化物的反应机理,对于消除环境污染有重要意义。
(1)已知2NO(g)+O2(g)
-2NO2(g)△H的反应历程分两步:
①2NO(g)
N2O2(g)(快)△H1<
0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2(g)+O2(g)
2NO2(g)(慢)△H2<
0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:
E1__
E2
(填“>
”、“<
”或“=”)其判断理由是__________;
2NO(g)+O2(g)
2NO2(g)
的平衡常数K与上述反应速率常数k1正、k1逆、k2正、
k2逆的关系式为_______;
已知反应速率常数k随温度升高而增大,若升高温度后k2正、
k2逆分别增大a倍和b倍,则a____b
”或“=”);
一定条件下,2NO
(g)+O2(g)
2NO2
(g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO):
n(O2)=2:
1,则总反应的化学方程式为_______________;
脱硝率与温度、负载率(分子筛中催化剂的质量分数)
的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N22O-→+O2-+1/2O2+V。
______________
【答案】<活化能越大,一般分子成为活化分子越难,反应速率越慢k1正.k2正/(k1逆.k2逆)<温度升高,反应①、②的平衡均逆移,由于反应①的速率大,导致c(N2O2)减小且其程度大于k2正和c(O2)增大的程度,使三者的乘积即v2正减小6NO+3O2+2C2H4
3N2+4CO2+4H2O350℃、负载率3.0%2Ni3++O2-→2Ni2++VO+1/2O2
19.硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。
一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
(1)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+==Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为_____________mol·
已知该温度下,Ksp[Mg(OH)2]=5.6×
10-12,当电解质溶液的pH=6时,_______(填“有”或“无”)Mg(OH)2沉淀析出。
(忽略反应过程中溶液的体积变化)
II.MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2===MgSO3+H2O
②MgSO3+SO2+H2O===Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
④2MgSO3+O2===2MgSO4
已知25℃时,Kap(MgSO3)=3.86×
10-3,Kap(CaSO3)=3.1×
10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。
镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为_____________。
【答案】
0.045mol·
L-1无MgSO3的溶解度比CaSO3的大,MgSO3比CaSO3更易氧化
20.工业废水中常含有一定量的Cr2O72-,易被人体吸收积累而导致肝癌。
处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。
(1)已知Ksp[Cr(OH)3]=1×
10-30。
室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×
10-6mol·
L-1],需调节溶液的pH至少为__________________。
(2)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为