沉淀溶解平衡曲线图形分析选择专练Word格式.docx
《沉淀溶解平衡曲线图形分析选择专练Word格式.docx》由会员分享,可在线阅读,更多相关《沉淀溶解平衡曲线图形分析选择专练Word格式.docx(39页珍藏版)》请在冰豆网上搜索。
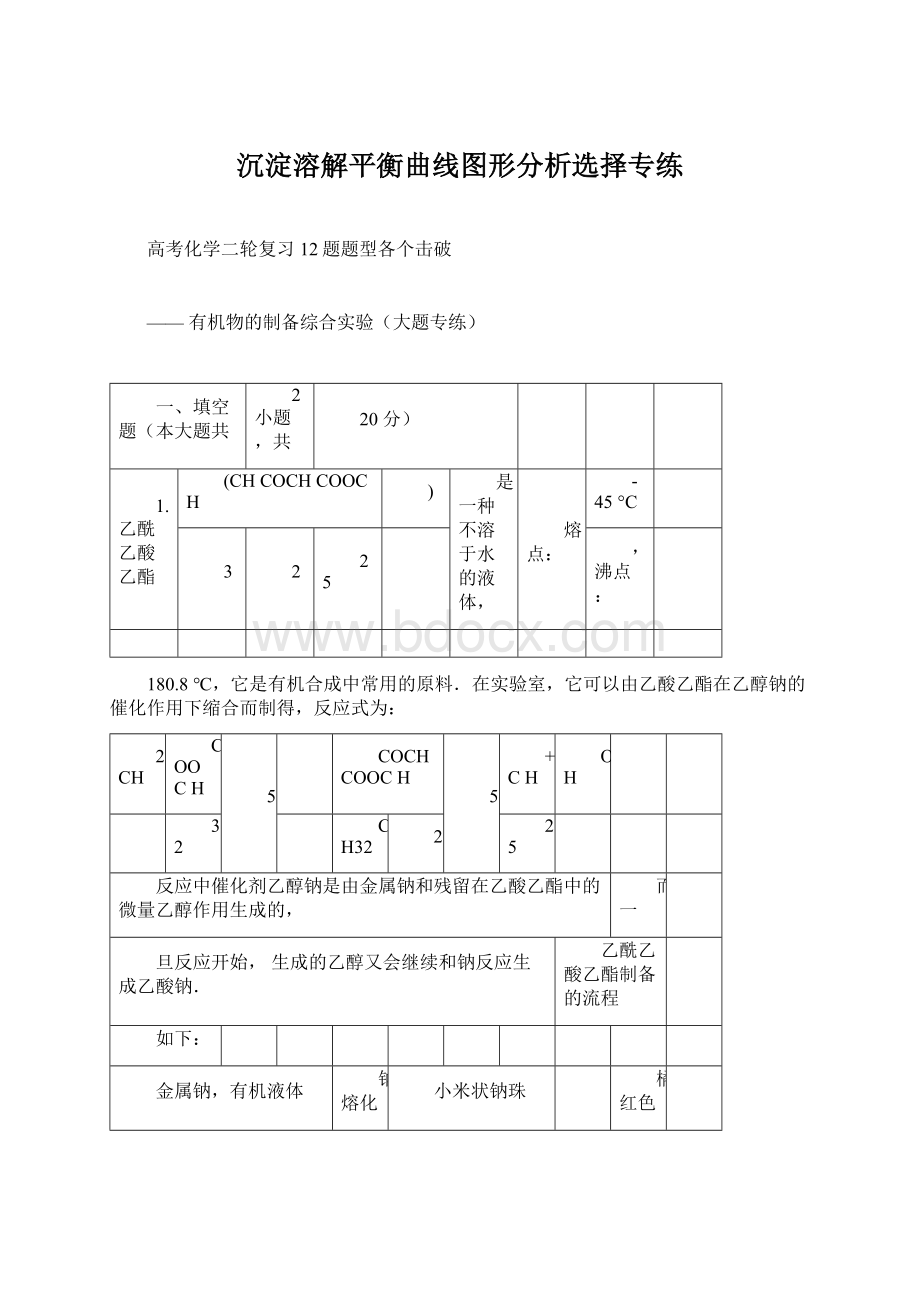
对二甲苯
四氯化碳
密度(g/cm3)
0.97
0.88
0.87
0.86
1.60
熔点(℃)
97.8
5.5
-95
13.3
-22.8
沸点(℃)
881.480
111
138.4
76.8
最好选用______来熔化钠.是否能用四氯化碳?
______(填“是”或“否”)
理由是______.
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管.缓缓加热,保持瓶中混合液微沸状
态.在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是______,
烧瓶配上长导管的作用是______,导管上端接一干燥管的目的是______.
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是______,写出步骤⑦实验
操作的主要仪器______(填最主要一种).
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品.
第1页,共25页
粗产品乙酰乙酸乙酯
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是______.
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示.
冷凝管的进出水方向应______口进,______口出.毛细管的作用是______.
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是______.
2.【实验化学】
苯甲酸常用于抗真菌及消毒防腐.实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装
置如图1所示(加热、搅拌和仪器固定装置均已略去).实验过程如下:
①将5.4mL甲苯、100mL水、几粒沸石加入250mL三颈瓶中.
②装上冷凝管,加热至沸后分批加入16g高锰酸钾,回流反应4h.
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中.
④滤液加入盐酸酸化后,抽滤(装置如图2)、洗涤、干燥得苯甲酸粗产品.
在苯甲酸制备过程中发生反应:
(1)图1冷凝管中冷水应从______管进入(填“a”或“b”),图2中仪器X的名称
为______.
(2)实验中分批加入KMnO4的原因是______.
(3)判断甲苯被氧化完全的实验现象是______.
(4)
抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是
______.
(5)
第一次过滤时,若溶液呈红色,可加入下列试剂处理
______(填字母).
A.H2OB.CCl4C.NaHSO3D.HNO3
(6)苯甲酸在不同温度下溶解度见下表:
T/℃
4
18
75
溶解度/g
0.18
0.27
2.20
洗涤苯甲酸晶体时应用
______洗涤.
第2页,共25页
二、简答题(本大题共6小题,共40分)
3.甲酸(HCOOH)是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。
某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。
请回答下列问题。
Ⅰ.甲酸能与醇发生酯化反应
该兴趣小组用如图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验。
有关物质的性质如下:
沸点/℃
密度(g·
cm-3)
水中溶解性
甲醇
64.5
0.79
易溶
甲酸
100.7
1.22
甲酸甲酯
31.5
0.98
(1)装置中,仪器A的名称是_______,长玻璃管c的作用是______________。
(2)甲酸和甲醇进行酯化反应的化学方程式为_________________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为_______。
Ⅱ.甲酸能脱水制取一氧化碳。
一定条件下,CO能与NaOH固体发生反应CO+NaOHHCOONa。
(1)为了证明“CO与NaOH固体发生了反应”,设计下列定性实验方案:
取固体产物,配成溶液,__________________________________________。
第3页,共25页
(2)测定产物中甲酸钠(HCOONa)的纯度:
准确称取固体产物8.0g配制成100mL溶
液,量取20.00mL该溶液于锥形瓶中,再加入_____作指示剂,用1.5mol·
L-1的盐
酸标准溶液滴定剩余的NaOH,平行滴定三次,平均消耗盐酸的体积为5.05mL,
则产物中甲酸钠的质量分数为______(计算结果精确到0.1%)。
4.乙酸乙酯是一种用途广泛的精细化工产品。
某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:
①氯化钙可与乙醇形成微溶于水的CaCl2·
6C2H5OH②有关有机物的沸点:
试剂乙醚乙醇乙酸乙酸乙酯
沸点/℃34.778.511877.1
Ⅰ.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式:
___________________________。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是_________(填入正确选项前的字母)。
A.25mLB.50mL
C.250mLD.500mL
(3)球形干燥管的主要作用是
___________________________________________________。
(4)如预先向饱和Na2CO3溶液中滴加几滴酚酞溶液,目的是
__________________________。
Ⅱ.提纯方法
①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。
有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是_________、_________。
第4页,共25页
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的________、__________、________________。
5.1-乙氧基萘常用作香料,也可合成其他香料.实验室制备1-乙氧基萘的过程如图
1:
1-萘酚的性质与苯酚相似,有难闻的苯酚气味.相关物质的物理常数:
相对分
沸点
溶解度
物质
状态
子质量
(℃)
水
乙醇
1-萘酚
144
无色或黄色菱
96℃
278℃微溶于水
易溶于乙
形结晶或粉末
醇
1-乙氧基萘
172
无色液体
5.5℃
267℃不溶于水
46
-114.1℃
78.5℃
任意比混
溶
(1)将72g1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合.将混合液置于
如图2所示的容器中加热充分反应.实验中使用过量乙醇的原因是______.
(2)装置中长玻璃管的作用是:
______.
(3)该反应能否用实验室制备乙酸乙酯的装置______(选填“能”或“不能”),简述理由______.
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层.为提纯产物有以
下四步操作:
①蒸馏;
②水洗并分液;
③用10%的NaOH溶液碱洗并分液;
④用
无水氯化钙干燥并过滤.正确的顺序是______(选填编号).
a.③②④①b.①②③④c.②①③④
实验测得1-乙氧基萘的产量与反应时间、温度的变化如图
所示,时间延长、
温度升高,1-乙氧基萘的产量下降可能的两个原因是______.
(6)
提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为______.
第5页,共25页
6.实验室用溴化钠、浓硫酸和醇制备溴乙烷(CH3CH2Br)和1-溴丁烷
(CH3CH2CH2CH2Br)的反应原理如下
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?
CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?
CH3CH2CH2CH2Br+H2O
可能存在的副反应有:
醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为
Br2等.有关数据列表如下:
溴乙烷
正丁醇
1-溴丁烷
密度/g?
cm-3
0.7893
1.4604
0.8098
1.2758
沸点/℃
78.5
38.4
117.2
101.6
请回答下列问题:
(1)
溴乙烷和1
-溴丁烷的制备实验中,下列仪器最不可能用到的是
______.(填字母
a.圆底烧瓶
b.量筒
c.温度计
d.普通漏斗
(2)
制备实验中常采用
80%的硫酸而不用98%的浓硫酸,其主要原因是______.
(3)
在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于
______;
但在制
备1-溴丁烷时却不能边反应边蒸出产物,其原因是
将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、
静置后,
1-溴丁烷在______(填“上层”、“下层”或“不分层”
),加入NaHSO3溶液的
目的是______.
将实验(4)所得的1-溴丁烷粗产品干燥后,进行
______
操作,即可得到纯净的
1-
溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇
(CH3CH2CH2CH2OH)7.4g.NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是______.(保留2位有效数字)
7.己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如图表:
物质密度熔点沸点溶解性
第6页,共25页
0.962g
25.9℃160.8
℃20℃时水中溶解度为3.6g,可混溶于乙醇、苯
环己醇
/cm3
1.360g
152℃337.5
在水中的溶解度:
15℃时1.44g,25℃时2.3g,
己二酸
℃
易溶于乙醇、不溶于苯
实验步骤如下:
Ⅰ.在三口烧瓶中加入
16mL50%的硝酸,再加入1~2粒沸石,滴液漏斗中盛放有
5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在
60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min,直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
(1)本实验所用50%的硝酸物质的量浓度为______.滴液漏斗的细支管a的作用是
(2)仪器b的名称为______,使用时要从______通入冷水.
(3)NaOH溶液的作用是______,溶液上方倒扣的漏斗作用是______.
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是______.
(5)进行该实验时要控制好环己醇的滴入速率,防止反应过于剧烈,否则可能造成
较严重的后果,试列举两条可能的后果:
(6)为了除去可能的杂质和减少产品损失,可分别用______和
______洗涤晶体.
8.苯甲酸是一种重要的化工原料.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
密度/(g
溶解性
名称
性状
熔点/℃
?
mL-1
无色液体易燃
110.6
0.866
9
不溶
互溶
易挥发
苯甲酸
白色片状或针
112.4(100
℃左右
1.2659
状晶体
升华)
248
微溶
苯甲酸在水中的溶解度如下表:
第7页,共25页
温度/℃4
0.20.3
2.2
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
一、制备苯甲酸
在三颈瓶中加入2.7mL甲苯、100mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动水,在石棉网上加热至沸腾,然后分批加入8.5g高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置.
二、分离提纯
在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水
洗涤,挤压去水分后放在沸水浴上干燥,得到粗产品.
三、测定纯度
称取mg产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴
酚酞,然后用标准浓度KOH溶液滴定.
(1)装置a的名称是______,其作用为______.
(2)甲苯被高锰酸钾氧化的原理为
□
+□MnO2↓+□H2O+□
请完成并配平该化学方程式.
(3)分离提纯过程中加入的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成.加入草酸的作用是______,请用离子方程式表示反应原理______.
(4)产品减压过滤时用冷水洗涤的原因是______.
(5)选用下列______操作,可以将粗产品进一步提纯.(选填字母)
A.溶于水后过滤B.溶于乙醇后蒸馏
C.用甲苯萃取后分液D.升华
(6)测定纯度步骤中,滴定终点溶液的颜色变化是______.若m=1.200g,滴定时用
去0.1200mol?
L-1标准KOH溶液20.00mL,则所得产品中苯甲酸的质量分数为
______.
三、实验题(本大题共
4小题,共
40分)
9.水杨酸对正辛基苯基酯是一种紫外线吸收剂,常用作新型塑料的防老化剂。
Ⅰ.制备水杨酸对正辛基苯基酯的实验过程如下:
步骤1:
将水杨酸晶体投入如图甲的仪器Y中,再加入适量的氯苯作溶剂并充分搅
拌使晶体完全溶解,最后加入少量的无水三氯化铝。
第8页,共25页
步骤2:
按如图甲所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅
拌条件下滴加POCl3,反应制得水杨酰氯。
该反应的化学方程式为
。
步骤3:
将Y中混合液升温至80℃,再加入对正辛基苯酚[
],温度控制在100℃左右,不断搅拌。
步骤4:
过滤、蒸馏、减压过滤;
酒精洗涤、干燥即得产品。
(1)仪器X、Y的名称分别是____________________、____________________。
实
验时,冷凝管中的冷却水进口为__________(填“a”或“b”)。
(2)步骤1中加入无水三氯化铝的作用是
_______________________________________________________________________
__________________________________________________。
(3)步骤3中发生反应的化学方程式为
____________________________________________________。
Ⅱ.POCl3可由PCl3制备。
有关物质的部分性质如下:
已知图乙是实验室制备PCl3的装置(部分仪器已省略)。
第9页,共25页
(4)碱石灰的作用有两点:
一是防止空气中的O2和水蒸气进入装置与产品发生反应;
二是____________________________________________。
(5)向仪器A中通入干燥的Cl2之前,应先通入一段时间的干燥CO2,其目的是
___________________。
(6)测定产品中PCl3纯度的方法如下:
迅速称取1.00g产品,与水反应完全后配成500mL溶液,取出25.00mL溶液加入21.25mL0.040mol·
L-1碘溶液,充分反应后再用0.040mol·
L-1Na2S2O3溶液滴定
过量的碘,终点时消耗25.00
mLNa2S2O3溶液。
I2+2Na2S2O3=2NaI+
Na2S4O6。
假设测定过程中没有其他反应,则产品中PCl3的质量分数为__________。
10.苯乙酸铜是合成优良催化剂、
传感材料——纳米氧化铜的重要前驱体之一。
下面是
它的一种实验室合成路线:
制备苯乙酸的装置示意图如下图(加热和夹持装置等略):
苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
①在250mL三口瓶a中加入70mL70%硫酸。
配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是____________________________。
②将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至
130℃继续反应。
在装置中,仪器b的作用是____________;
仪器c的名称是
__________,其作用是______________。
反应结束后加适量冷水,再分离出苯乙酸
粗品。
加入冷水的目的是____________________。
下列仪器中可用于分离苯乙酸粗
品的是____________(填字母)。
第10页,共25页
A.分液漏斗B.漏斗C.烧杯D.直形冷凝管E.玻璃棒
③提纯粗苯乙酸的方法是______________,最终得到44g纯品,则苯乙酸的产率是
__________(精确到1%)。
11.香兰素是世界上产量最大的合成香料,主要用作定香剂、协调剂及调味剂。
实验室采用愈创木酚和乙醛酸缩合,氧化,脱羧合成甲基香兰素。
反应原理如下:
①部分物质的物理性质如下:
相对分子
熔点
质量
(℃)(℃)
愈创木酚
124
31
204
微溶于水,易溶于苯、氯仿等
乙醛酸
74
98
易溶于水,微溶于乙醇、苯等
甲基香兰
152
42
281
不溶于冷水,微溶于热水,易溶于醇、甲
素
苯等
②乙醛酸在强碱条件(pH>
10.0)下易发生自身歧化生成乙醇酸盐和乙二酸盐。
③反萃取是将被萃取物从有机相返回水相的过程,是萃取的逆过程。
Ⅰ.缩合:
如上图组装装置,于三颈烧瓶中加入4.00gNaOH