专题一有关氢氧化钠变质的问题Word下载.docx
《专题一有关氢氧化钠变质的问题Word下载.docx》由会员分享,可在线阅读,更多相关《专题一有关氢氧化钠变质的问题Word下载.docx(21页珍藏版)》请在冰豆网上搜索。
用试管取少量样品溶液,向其中滴入两滴酚酞溶液.
若酚酞溶液变为红色,则猜想成立.
若酚酞溶液无明显变化,则猜想不成立.
猜想二:
硫酸钠溶液
用试管取少量样品溶液,向其中先加入适量稀 _________ 酸,然后滴入氯化钡溶液.
若溶液先没有明显变化,后出现白色沉淀,则猜想成立.若与上述现象不同,则猜想不成立.
请你参与这一探究活动,根据上表回答下列问题:
(1)小明同学对猜想一所描述的实验现象和作出的结论是否正确?
请判断并说明理由. _________ .
(2)小明验证猜想二是否成立时设计的实验中加入的是稀 _________ 酸.如果小明的猜想二成立,则产生白色沉淀的化学反应方程式为 _________
(3)你认为该样品溶液中的溶质还可能是(填化学式) _________ .
4、生活中的食品包装内常附带有一小包干燥剂(其主要成分为生石灰),可小明买回食品打开包装后却发现食品内的干燥剂结成了小块,对此他产生疑问:
此干燥剂是否依然还能起到干燥作用?
并对此做出猜想如下:
此干燥剂没有变质,仍能起到干燥作用.
此干燥剂变质已经失效;
猜想三:
此干燥剂可能部分变质;
设计实验如下表所示:
实验操作
实验现象
实验结论
取少量此干燥剂加入 _________ ,观察现象
_________
说明此干燥剂中
存在有生石灰
取少量干燥剂,加入适量的稀盐酸观察现象
含有 _________ ;
由此小明可以做出如下结论:
食品包装袋内的干燥剂部分变质;
在此过程中生石灰与水和 _________ 同时作用,反应方程式为:
5、学校实验室的废液缸中收集了同学们在实验室制取CO2后的所有废液.小红同学想探究废液中溶质的成分,请你一同参与探究并回答下列问题.
[提出问题]废液中的溶质是什么物质?
[作出猜想]小红认为废液中溶质只有CaCl2.
你认为还可能含有的溶质是 _________ (填化学式).
[查阅资料]CaCl2溶液呈中性,石灰石中杂质不与稀盐酸反应,也不溶于水.
[实验与结论]
(1)如果要证明你的猜想是正确的,你选择的试剂是 _________ ,实验中可以看到的现象是 _________ .(其它合理答案均可)
(2)若实验证明你的猜想是正确的,要想使处理后的废液只有CaCl2溶液,应向废液中加入过量的 _________ (下列物质的选项),反应完成后过滤.
A.硝酸银B.碳酸钠C.碳酸钙D.氢氧化钙
(3)实验前,实验老师共配制1000g14.6%的稀盐酸,若要将其全部反应掉,至少需要多少克80%的石灰石?
实验结束后,搜集所有废液,废液中溶质的质量分数是多少?
(写出完整的计算过程,计算结果如算不尽,保留一位小数)
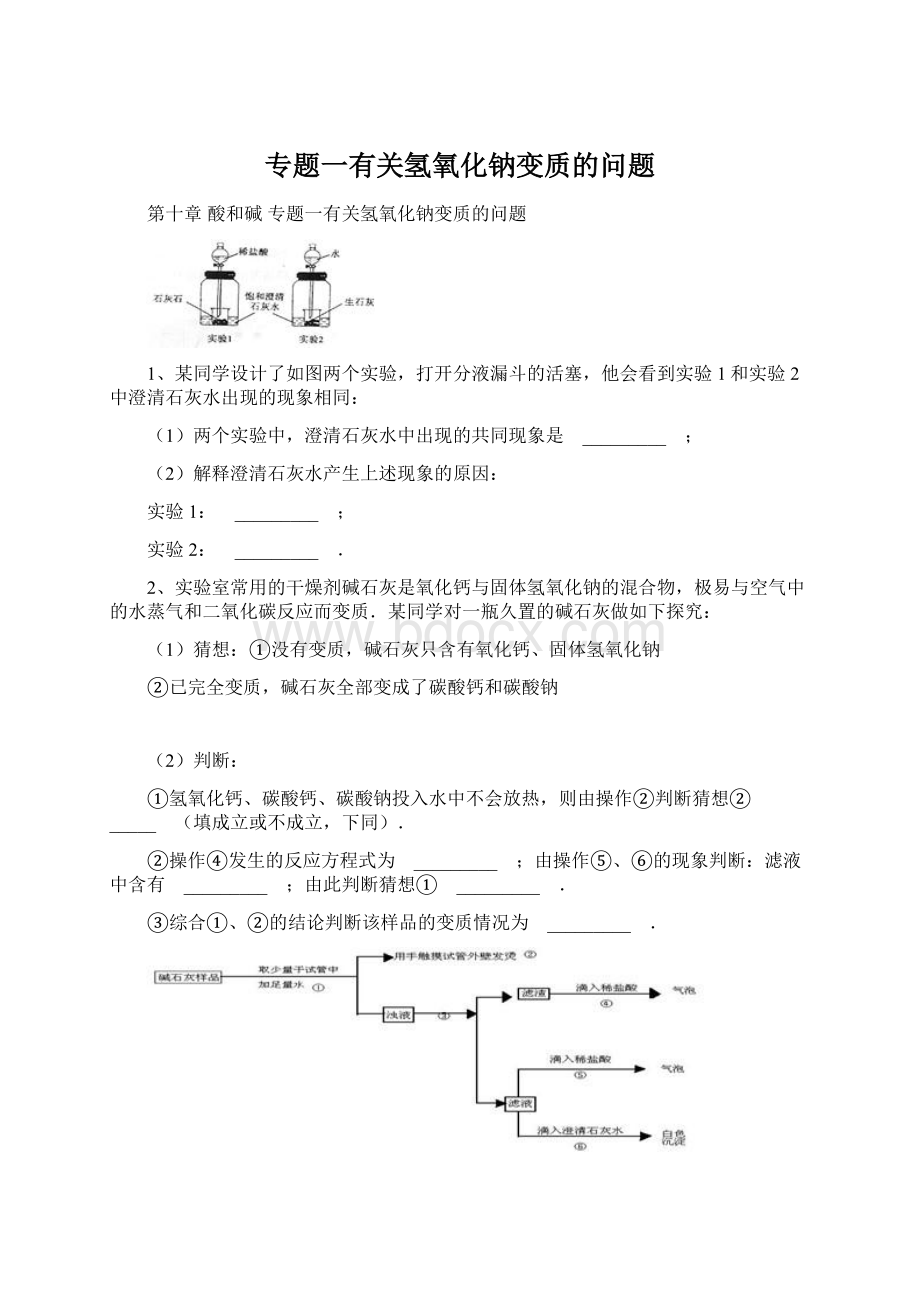
6、锌、镁、铝等与盐酸反应时,放出大量的热.如图所示,把试管放入盛有20℃饱和澄清石灰水的烧杯中,试管中开始放入几块镁片,再滴入5mL盐酸.试完成下列问题:
(1)写出试管中发生反应的方程式:
_________ ,它属于(填“吸热”或“放热”) _________ 反应.
(2)实验时可观察到烧杯内的澄清石灰水变 _________ ,
其原因是 _________ .
7、小艾同学在妈妈买回的某食品包装袋内发现有一包白色颗粒状固体A的小纸袋,上面写着“生石灰干燥剂,请勿食用”.小艾同学随手将小纸袋放在窗台上,过一段时间后发现纸袋内的白色颗粒粘在一起成为块状固体B.小艾同学请你和同学们一起对块状固体B进行探究:
(1)猜想一:
块状固体B中除氧化钙外,还可能有 _________ (写两种).
(2)猜想二:
块状固体B溶于水可能有 _________ (选填“放热”或“吸热”)现象.
(3)取块状固体B加入盛有一定量水的试管内,振荡、静置、过滤,得到少量白色固体C.就白色固体C同学们展开了热烈讨论,一起猜想.
a.小艾同学认为白色固体C可能是氢氧化钙;
小聪同学认为白色固体可能是碳酸钙;
小明同学认为白色固体可能是氧化钙和碳酸钙的混合物;
小颖认为白色固体还可能是 _________ 的混合物.
b.上述猜想中,一定错误的是 _________ 同学的猜想,理由(用化学方程式表示):
_________ .该反应的基本类型属于 _________ 反应.
c.就上述三种正确的猜想中,请你设计一个实验验证哪一个猜想是正确的,请完成下列表格:
通过实验探究可知:
_________ 同学的猜想是正确的.
8、小强为探究氢氧化钠溶液中到底是哪一种粒子(H2O、Na+、OH﹣)能使酚酞指示剂变色,设计了一组实验,实验步骤如下:
(1)在第一支试管中加入约2ml蒸馏水,滴入几滴无色酚酞试液,观察现象.
(2)在第二支试管中加入约2mlNaCl溶液(pH=7),滴入几滴无色酚酞试液,观察现象.
(3)在第三支试管中加入约2mlNaOH溶液,滴入几滴无色酚酞试液,观察现象.
通过上述试验探究,小强得到的结论应是:
实验
(1)看到的现象是无色酚酞试液不变色,得出的结论是H2O _________ 使酚酞变色,
实验
(2)看到的现象是 _________ ,得出的结论是Na+离子 _________ .
实验(3)看到的现象是 _________ ,得出的结论是 _________ .
9、某同学在实验结束进行废液处理时,将碳酸钠溶液、稀盐酸倒入到指定的洁净容器中,看到有气泡产生,待不再产生气泡时,又倒入了氢氧化钙溶液,发现该容器中有白色沉淀产生,这一现象引起了他的注意.为了解以上三种物质之间的反应情况,他决定从倒入氢氧化钙反应后所得溶液中的溶质组成入手进行探究.
(1)他决定从倒入氢氧化钙溶液后所得到的溶液中的溶质组成入手进行探究.并作出了两种猜想(猜想①和猜想②).请你再补充一种猜想(猜想③).
猜想①:
溶质为氯化钠、氢氧化钠;
猜想②:
溶质为氯化钠、氢氧化钠、氢氧化钙;
猜想③:
溶质为 _________ .
(2)比较三种猜想,说明该同学作出猜想①的理由 _________ .
(3)比较三种猜想的异同,如果猜想②成立,设计实验,用两种方法加以证明.按相关要求填写实验报告.
方法一
方法二
10、某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实
验.请你与他们一起完成以下探究活动:
对固体猜想:
猜想I:
全部是Na2CO3,猜想的依据是 _________ 猜想Ⅱ:
全部是NaOH.猜想Ⅲ:
部分是NaOH,部分是Na2CO3.
实验和推断:
(1)若现象A为有气泡产生,则加入的X溶液是 _________ ,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是 _________ .
(2)若X是Ba(OH)2溶液,现象A为有白色沉淀生成,现象B为无色酚酞试液变红,则白色沉淀为 _________ (填化学式),该实验 _________ (填“能”或“不能”)说明样品中有NaOH.
(3)若X是BaCl2溶液,猜想Ⅲ成立的实验现象是 _________ , _________ .
11、同学们在学习碱的化学性质时,进行如图所示的实验.
(1)A实验注入氢氧化钠溶液后,可观察到的现象是 _________ ;
(2)C实验中观察到试管内有白色沉淀产生,写出该反应的化学方程式:
(3)实验结束后,同学们将A、B、C三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问.
【提出问题】废液中含有哪些物质?
【交流讨论】
①小明通过实验观察,认为废液中一定含有的物质是水、氯化钠、指示剂和 _________ (写物质名称);
一定不含有的物质是 _________ (写物质名称).
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?
同学们有如下猜想:
小明认为:
只有碳酸钠
小东认为:
只有氢氧化钠
小刚认为:
是氢氧化钠和碳酸钠
你认为还有可能是 _________ (写一种猜想).
【实验设计】小聪想用氯化钙溶液来验证小明、小东、小刚的猜想.通过查阅资料获悉氯化钙溶液呈中性,并设计如下实验.
若溶液呈红色,则 _________ 的猜想正确;
若溶液呈无色,则 _________ 的猜想正确.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需要考虑 _________ .
答案与评分标准
一、填空题(共3小题)
(1)两个实验中,澄清石灰水中出现的共同现象是 澄清的石灰水变浑浊 ;
石灰石和稀盐酸反应产生的二氧化碳使澄清的石灰水变浑浊(或CO2+Ca(OH)2=CaCO3↓+H2O) ;
生石灰和水反应产生的热使温度升高,石灰水中的氢氧化钙的溶解度随温度的升高而降低 .
考点:
反应现象和本质的联系;
二氧化碳的化学性质;
溶解时的吸热或放热现象;
固体溶解度的影响因素;
碱的化学性质。
专题:
结合课本知识的信息。
分析:
可以根据石灰水的性质和物质之间反应的实质方面进行分析、判断,从而得出正确的结论.
解答:
解:
(1)石灰水遇二氧化碳变浑浊,饱和的石灰水溶液温度升高时也会变浑浊,因为氢氧化钙的溶解度随着温度的升高而减小.故填:
澄清的石灰水变浑浊.
(2)实验1中石灰水变浑浊的原因是:
石灰石和稀盐酸反应产生的二氧化碳使澄清的石灰水变浑浊(或CO2+Ca(OH)2=CaCO3↓+H2O).
实验2中石灰水变浑浊的原因是:
生石灰和水反应产生的热使温度升高,石灰水中的氢氧化钙的溶解度随温度的升高而降低.
点评:
解答本题的关键是要掌握物质的性质和物质的溶解度与温度的关系,只有这样才能对问题做出正确的判断.
①氢氧化钙、碳酸钙、碳酸钠投入水中不会放热,则由操作②判断猜想② 不成立 (填成立或不成立,下同).
②操作④发生的反应方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑ ;
滤液中含有 碳酸钠 ;
由此判断猜想① 不成立 .
③综合①、②的结论判断该样品的变质情况为 只是部分变质为碳酸钠和碳酸钙 .
药品是否变质的探究;
生石灰的性质与用途;
混合物组成的推断题。
氧化钙可以与水发生化学反应生成氢氧化钙而变质,同时放出大量的热,而生成的氢氧化钙还可以与二氧化碳发生化学反应,生成碳酸钙;
固体氢氧化钠极易吸收空气中的水蒸气而潮解,由于这两种物质都具有吸水性,所以常用作干燥剂.而氢氧化钠还易与二氧化碳发生化学反应生成碳酸钠而变质.
①根据题干所给信息,取碱石灰样品少量,放入试管中,加足量水,用手触摸试管外壁发烫,说明样品与水接触放出了大量的热,故样品中应含有生石灰或氢氧化钠,所以可确定样品为完全变质,故本题答案为:
不成立;
②碱石灰样品加足量水后得到了浊液,说明有不溶于水的物质产生,根据生石灰和氢氧化钠的变质情况,由反应的化学方程式:
CaO+H2O=Ca(OH)2,Ca(OH)2+CO2=CaCO3↓+H2O,2NaOH+CO2=Na2CO3+H2O,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,可以推断此不溶于水的物质为碳酸钙,所以操作④是碳酸钙与盐酸的反应,根据⑤,滤液中滴入盐酸有气泡产生,说明溶液中含有能与酸反应产生气体的物质,可能为碳酸盐,根据⑥,滴入澄清石灰水溶液变浑浊,说明含有能和钙离子结合成沉淀的例子存在,综合⑤⑥现象,说明溶液中含有可溶性的碳酸钠,所以碱石灰已经变质,故本题答案为:
CaCO3+2HCl=CaCl2+H2O+CO2↑,碳酸钠,不成立;
③溶于水发烫,说明还含有生石灰或氢氧化钠,根据碱石灰样品加足量水后得到了浊液,推断此不溶于水的物质为碳酸钙,综合⑤⑥现象,说明溶液中含有可溶性的碳酸钠,所以说明药品只是部分变质为碳酸钠和碳酸钙,故本题答案为:
只是部分变质为碳酸钠和碳酸钙.
本题通过实验室常见干燥剂碱石灰是否变质的实验探究,综合考查氢氧化钠、生石灰的性质,以及与水、酸碱盐之间的化学反应.
用试管取少量样品溶液,向其中先加入适量稀 盐 酸,然后滴入氯化钡溶液.
请判断并说明理由. 使酚酞溶液变红的不一定是氢氧化钠溶液,如碳酸钠溶液也能使酚酞溶液变红等 .
(2)小明验证猜想二是否成立时设计的实验中加入的是稀 盐 酸.如果小明的猜想二成立,则产生白色沉淀的化学反应方程式为 Na2SO4+BaCl2=BaSO4↓+2NaCl
(3)你认为该样品溶液中的溶质还可能是(填化学式) NaCl、Na2CO3、NaHCO3等 .
缺失标签的药品成分的探究;
证明硫酸和可溶性硫酸盐(SO42-检验方法);
酸碱指示剂及其性质;
书写化学方程式、文字表达式、电离方程式。
实验方法和过程的探究。
可以根据硫酸钠溶液的性质,来选择试剂进行验证;
(1)能够使无色酚酞变红的物质不仅仅是氢氧化钠,碳酸钠也可以使酚酞变红;
(2)硫酸钠可以和氯化钡反应生成白色的难溶于酸的沉淀硫酸钡,所以可以据此写出该反应的化学方程式;
(3)根据破损的标签可以知道只要是含有钠元素的可溶性物质都有可能.
硫酸钠可以和氯化钡反应生成白色的沉淀,为了防止碳酸根离子干扰实验现象,应该先用盐酸来酸化;
(1)能够使无色酚酞变红的不仅仅是氢氧化钠,碳酸钠溶液同样能够使酚酞变红,并且也含有钠元素,所以猜想一的实验结论不正确;
(2)猜想二应该加入稀盐酸来酸化溶液,然后再加入氯化钡来验证该溶液是否为硫酸钠溶液,故可以写出该反应的化学方程式;
(3)只要是含有钠元素的可溶性的物质皆有可能.
故答案为:
用试管取少量样品溶液,向其中先加入适量稀盐酸,然后滴入氯化钡溶液.
(1)使酚酞溶液变红的不一定是氢氧化钠溶液,如碳酸钠溶液也能使酚酞溶液变红等;
(2)Na2SO4+BaCl2=BaSO4↓+2NaCl;
(3)NaCl、Na2CO3、NaHCO3等.
熟练掌握常见钠盐的化学性质,要注意区分碳酸钠和氢氧化钠这两种物质,它们都能使酚酞变红,但是碳酸钠可以和盐酸反应生成气体,记住化学方程式:
BaCl2+Na2SO4═BaSO4↓+2NaCl.
二、解答题(共8小题)
取少量此干燥剂加入 一定量的水中 ,观察现象
管壁温度上升
有气泡冒出
含有 碳酸钙 ;
在此过程中生石灰与水和 二氧化碳 同时作用,反应方程式为:
CaO+H2O═Ca(OH)2,CO2+Ca(OH)2═CaCO3↓+H2O .
食品干燥剂、保鲜剂和真空包装的成分探究;
碳酸钠、碳酸氢钠与碳酸钙;
氧化钙能和水反应生成氢氧化钙,同时放出热量,氢氧化钙能和二氧化碳反应生成碳酸钙;
碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳气体.根据反应物和生成物及其质量守恒定律可以书写化学方程式;
当干燥剂中仍含有氧化钙时就还有干燥作用,检验氧化钙可根据它溶于水放热的性质;
碳酸盐和盐酸反应生成二氧化碳,根据此反应验证干燥剂中含有碳酸钙;
根据反应原理书写化学方程式.
取少量此干燥剂加入一定量的水中,观察现象
管壁温度上升
有气泡冒出
含有碳酸钙;
二氧化碳;
CaO+H2O═Ca(OH)2、CO2+Ca(OH)2═CaCO3↓+H2O.
解答本题要掌握各种物质的性质和物质之间相互作用时的实验现象方面的内容,能根据反应原理正确的书写化学方程式.
你认为还可能含有的溶质是 HCl (填化学式).
(1)如果要证明你的猜想是正确的,你选择的试剂是 紫色石蕊试液 ,实验中可以看到的现象是 紫色石蕊试液变红 .(其它合理答案均可)
(2)若实验证明你的猜想是正确的,要想使处理后的废液只有CaCl2溶液,应向废液中加入过量的 C (下列物质的选项),反应完成后过滤.
实验探究物质的组成成分以及含量;
猜想与事实验证。
科学探究。
根据题目信息可知,碳酸钙和盐酸反应生成氯化钙和二氧化碳和水,所以反应后的溶液的溶质可能是氯化钙和剩余的反应物,但是碳酸钙是沉淀,因此溶质可能是氯化钙和盐酸.
(1)根据盐酸的酸性即可.
(2)根据盐酸的性质(盐酸和盐反应)即可,也涉及除杂的一些知识.
(3)列出化学方程式计算即可.
碳酸钙和盐酸反应生成氯化钙和二氧化碳和水,所以反应后的溶液的溶质可能是氯化钙和剩余的反应物,但是碳酸钙是沉淀,因此溶质可能是氯化钙和盐酸,故答案为:
HCl.
(1)盐酸是酸性,能使紫色石蕊试液变红,这是酸碱指示剂的性质,故答案为:
紫色石蕊试液、紫色石蕊试液变红.
(2)这个题有三个要求:
①能和盐酸反应,②和盐酸反应的产物必须是氯化钙或者沉淀,③加入的物质也必须是沉淀;
因此碳酸钙最合适;
碳酸钙和盐酸反应的产物是氯化钙和二氧化碳和水,最后的溶质全部是氯化钙;
C
(3)HCl的质量是1000×
14.6%═146g,设生成的氯化钙质量是X,需要的碳酸钙的质量是Y,二氧化碳的质量是Z.
2HCl+CaCO3═CaCl2+CO2↑+H2O
7310011144
146yxZ
═
得:
X═222g
Y=200g
Z=88g
所以石灰石的质量是:
200÷
80%═250g
反应后溶液的质量是:
1000+200﹣88═1112g
溶液中溶质(CaCl2)的质量分数是:
×
100%═20.0%
答:
若要将其全部反应掉,至少需要250g克80%的石灰石;
废液中溶质的质量分数是20.0%.
这个题需要注意的是溶液的质量计算,盐酸的质量是1000,而不是146;
计算时要规范.
Mg+2HCl=MgCl2+H2↑ ,它属于(填“吸热”或“放热”) 放热 反应.
(2)实验时可观察到烧杯内的澄清石灰水变 浑浊 ,
其原因是 氢氧化钙的溶解度随温度的升高反而减小 .
金属的化学性质;
酸的化学性质;
物质发生化学变化时的能量变化;
实验性简答题。
(1)根据镁在金属活动顺序表中的位置去分析,即镁在氢之前,所以会与酸反应;
(2)根据氢氧化钙溶解度随温度的升高而降低去分析即可.
(1)在金属活动顺序表中镁在氢之前,所以会与酸反应,同时放出热量,
Mg+2HCl=MgCl2+H2↑放热;
(2)利用镁与稀盐酸反应会放出热量,使烧杯里澄清石灰水的温度升高.而氢氧化钙的溶解度随温度升高反而减小,则溶不