溶液 溶解度专题Word格式.docx
《溶液 溶解度专题Word格式.docx》由会员分享,可在线阅读,更多相关《溶液 溶解度专题Word格式.docx(17页珍藏版)》请在冰豆网上搜索。
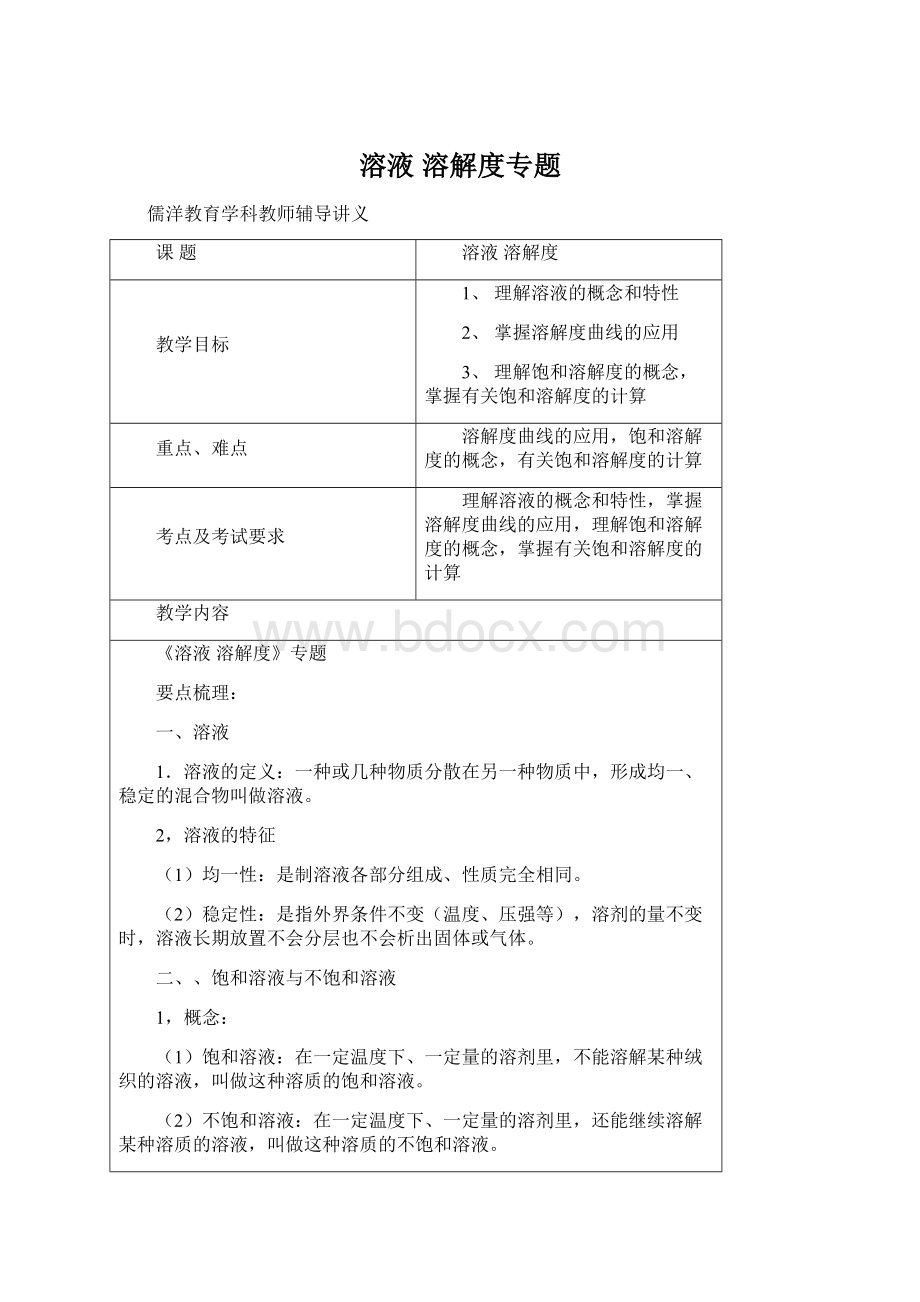
②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。
此时,溶液必定是饱和溶液。
③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。
在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。
④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液,也就是说,在溶液中存在未溶解的溶质。
(2)溶解度曲线变化的规律
大多数固体物质的溶解度随温度的升高而增大,一般表现在曲线“坡度”比较“陡”,如硝酸钾;
少数固体物质的溶解度受温度的影响较小,表现在曲线的“坡度”比较“平缓”,如氯化钠;
极少数固体物质的溶解度随温度的升高而减小,表现在曲线的“坡度”下降,如熟石灰。
四、结晶的方法:
(1)蒸发结晶(蒸发溶剂法):
将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。
适用范围:
溶解度受温度变化影响不大的物质,如氯化钠。
(2)降温结晶(冷却热饱和溶液法)冷却热的饱和溶液,使溶质从溶液中结晶析出。
溶解度受温度变化影响较大的物质,如氯酸钾。
五、有关溶液的计算
注意:
溶质必须是已溶解的,未溶解的不是溶液的一部分
1.基本公式:
溶液质量=溶质质量+溶剂质量
2.以下公式必须先满足的前提条件:
在一定温度下的饱和溶液里:
①
=
②
③溶质质量:
溶剂质量:
溶液质量=溶解度:
100克:
(100克+溶解度)
3.溶质质量分数=
×
100%=
100%
在一定温度下的饱和溶液里:
溶解度(S克)与溶质的质量分数(p%)的关系
S=
p%=
4.加水稀释浓溶液过程中,溶质质量不变(增加水的质量为m)
浓溶液质量×
浓溶液溶质质量分数=稀溶液质量×
稀溶液溶质质量分数
=(浓溶液质量+m)×
稀溶液质量质量分数
精题导解:
考点1:
溶液
例1:
关于溶液的叙述正确的是
A溶液都是无色的B饱和溶液一定是浓溶液
C糖水的溶质是水D医用生理盐水是溶液
考点二:
饱和溶液与不饱和溶液之间的转化
例2:
右图为A物质的溶解度曲线。
M、N两点分别表示A物质的两种溶液。
下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)
A.从N→M:
先向N中加入适量固体A再降温
B.从N→M:
先将N降温再加入适量固体A
C.从M→N:
先将M降温再将其升温
D.从M→N:
先将M升温再将其蒸发掉部分水
考点三:
溶解度曲线的意义
例3:
甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是()
A.t1℃时,甲、乙各30g分别加入70g水中均能恰好完全溶解
B.t2℃时,甲和乙的饱和溶液中溶质的质量分数相等
C.t2℃时,在lO0g水中放入60g甲,所得溶液溶质的质量分数为37.5%
D.t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
考点四:
溶液的配制
例4:
要配制100g溶质质量分数为10%的氯化钠溶液,下列操作中正确的是()
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90ml水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
方法指引:
1、溶液中溶质、溶剂的判定
(1)固体、气体溶于液体时,固体、气体是溶剂;
(2)两种液体相溶时,量多的是溶剂,量少的是溶质。
(3)溶液中若有水存在,无论水的量多还是量少,水都是溶剂。
(4)在不指明溶剂时,溶剂一般是水。
2.判断溶液是否饱和的方法:
一般说,要确定某一溶液是否饱和,只要看在一定温度下有没有不能继续溶解的剩余溶质存在,如有,且溶质的质量不再减少,则为该溶质的饱和溶液;
否则为该溶质不饱和溶液。
3.(3)溶解度曲线的应用
①判断某种物质在不同温度下的溶解度大小。
②比较不同物质在同一温度下溶解度的大小。
③判断物质溶解度受温度影响变化的趋势。
④如何通过改变温度和增加溶质,将不饱和溶液变为饱和溶液。
⑤如何通过改变温度或蒸发溶剂,使溶质从溶液中析出
冲关训练:
基础题:
1.下列物质中既存在离子又存在分子的是()
A.氯化钠晶体B.金刚石
C.氯化钠溶液D.液氧
2.下列关于溶液的说法错误的是()
A.饱和溶液析出晶体后,其溶质的质量分数可能不变
B.在溶液里进行的化学反应,通常比较快
C.同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D.不饱和溶液转化为饱和溶液,溶质质量分数可能不变
3.用氯化钠配制l00g溶质质量分数为20%的氯化钠溶液,现有下列操作:
①溶解;
②称取氯化钠;
③过滤;
④量取水;
⑤计算;
⑥蒸发结晶。
正确的操作顺序是
(A)①②③④(B)⑤②④①
(C)①③⑤②④①(D)①③⑥⑤②④①
4.现有60℃的饱和NaCl溶液,与该溶液有关的量有:
①水的质量;
②溶液中溶质NaCl的质量;
③NaCl的质量分数;
④60℃时NaCl的溶解度:
⑤溶液的质量。
用序号填空:
(1)将该饱和溶液稀释,不变的量有:
;
(2)将该饱和溶液降温至20℃,一定变化的量有。
提升题:
5.右图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。
(1)当温度为10℃时,碳酸钠的溶解度为;
(2)当温度时,氯化钠的溶解度大于碳酸钠的溶解度;
(3)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”。
请你解释原因:
“夏天晒盐”;
“冬天捞碱”。
“夏天晒盐”。
6.右图是A、B两种物质的溶解度曲线,根据图示回答下列问题:
(1)t1℃时,向两只盛有100g水的烧杯中,分别加入A、B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是___________溶液(填“A”或“B””)。
(2)t2℃时,欲配制等质量的A、B两种物质的饱和溶液,所需水的质量关系是A________B。
(填写“>”、“<”或“=”,下同)
(3)将t2℃的A、B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A______B。
(4)将t2℃的A、B两种物质的饱和溶液各200g,升温至t1℃,欲使它们仍为饱和溶液,若不改变溶剂质量,所需加入固体溶质的质量关系是A_______B。
7.实验室要配制50g溶质质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的药品,设计三种配制方案填入下表
配制方案(只要说明配制时所需的各种药品及用量即可)
方案一
方案二
方案三
练习1
1.要使溶解度增大采用的方法是(
)
A.增加水B.增加KNO3C.不断搅拌D.升高温度
2.下列物质中,随着温度的升高,在水中的溶解度减小的是(
A.熟石灰B.食盐C.硝酸钾D.氮气
3.在30℃时,50g水中最多溶解A物质5g,在60℃时50g水最多能溶解B物质10g则(
A.A的溶解度比B大B.B的溶解度比A大C.二者的溶解度相等D.无法比较
4.在20℃时,30g水最多溶解1.3g的某物质,则该物质为(
A.难溶物质B.可溶物质C.微溶物质D.易溶物质
5.20℃时,甲、乙两烧杯内依次放入饱和的KNO3溶液100g、200g,若各蒸发5g水,再恢复到20℃后,两杯中析出晶体质量为(
A.甲>乙B.甲<乙C.甲=乙D.不一定
6.不能影响物质溶解度大小的因素是(
A.温度高低B.溶质、溶剂的量C.溶剂种类D.溶质种类
7.将80℃的KNO3饱和溶液冷却至20℃,有晶体析出,此刻得到的溶液为20℃时的(
A.饱和溶液B.不饱和溶液C.稀溶液D.浓溶液
8.计算物质的溶解度时,该溶液一定是(
A.浓溶液B.稀溶液C.饱和溶液D.不饱和溶液
9.已知在60℃时,100gKNO3溶液加热蒸发水分后,得到50gKNO3晶体,则下列说法正确的是(
A.原溶液一定是饱和溶液B.60℃时KNO3的溶解度为50g
C.60℃时KNO3的溶解度为100gD.无法计算它的溶解度
10.有t℃时浓度相同的两份KNO3溶液A和B,A为100g,B为80g,将其恒温蒸发20g水后,A刚好饱和,则关于B溶液正确的说法是(
A.也刚好是饱和溶液B.仍是不饱和溶液C.是饱和溶液,并有晶体析出D.有晶体析出剩余不饱和溶液
11.要增大CO2在水中的溶解度,可采用的方法是(
A.加压降温B.加压升温C.减压降温D.减压升温
12.下列说法正确的是(
A.一定温度和压强下,一定量的饱和溶液所含该溶质的量一定是该条件下的最大值
B.所有物质的溶解度都随温度的升高而增大
C.在温度一定时,同一物质的饱和溶液一定比不饱和溶液的浓度大
D.对于任何固体物质来说,用加热的方法都可以得到它的浓溶液
13.已知下列物质在20℃时的溶解度,其中属于可溶物质的是(
A.CaCO3为0.0013gB.食盐为36gC.熟石灰为0.17gD.KClO3为7.4g
14.t℃时,某物质的溶液220g,蒸发去15g水后,析出晶体6g,又蒸发去10g水,析出6g晶体,再蒸去10g水又析出晶体的质量为(
A.4gB.6gC.10gD.15g
练习2
1.下列说法中正确的是()
A.在100g水里最多能溶解36g食盐,所以食盐的溶解度为36g
B.所有固体物质的溶解度都随着温度的升高而增大
C.有过剩溶质存在于其中的溶液,一定是这种物质在该温度时的饱和溶液
D.20℃时100g水里溶解了30gKNO3,所以KNO3的溶解度是30g
2.打开汽水瓶塞时会有大量气泡冒出,产生这一现象的原因是二氧化碳气体的溶解度()
A.随压强的增大而增大B.随压强的减小而减小C.随温度的升高而升高D.随温度的降低而减小
3.60℃时,50g水中溶解10.48gM恰好达到饱和,则M属于()
A.易溶物质B.可溶物质C.微溶物质D.无法确定
4.现有a、b两种物质在t1℃的饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体。
则能表示a、b两种物质的溶解度曲线是()
5.20℃时50g水中最多溶解10gX,40℃时100g水中最多溶解20gY,则X、Y两种物质溶解度的大小关系是()
A.X<YB.X>YC.X=YD.无法比较
6.25℃时,在甲、乙两个烧杯中分别盛有硝酸钾饱和溶液200g和100g,然后分别都蒸发掉10g水,再冷却到25℃。
现烧杯中析出m1gKNO3晶体,乙烧杯中析出m2gKNO3晶体。
则m1与m2的大小关系是()
A.m1=m2B.m1>m2C.m1<m2D.m1=2m2
7.“20℃时KClO3的溶解度为7.4g”,它表示()
A.20℃时100gKClO3饱和溶液中含KClO37.4g
B.20℃时,KClO3在水中溶解7.4g,溶液达到饱和状态
C.100g水最多溶解7.4gKClO3D.20℃时,100g水溶解7.4gKClO3时,溶液达到饱和状态
8.20℃时食盐的溶解度为36g,20℃时将20g食盐放入50g水中,充分搅拌后,所得饱和食盐溶液的质量为()
A.70gB.69gC.68gD.67g
9.下图是A、B、C三种物质的溶解度曲线。
(1)20℃时,A、B、C三种物质溶解度由大到小的顺序是。
(2)35℃时,A、B、C的饱和溶液各wg,均冷却至20℃时,析出晶体最多的是,最少的是,没有晶体析出的是。
(3)30℃时,a点表示100g水中溶解A物质的质量,要使其变为30℃的饱和溶液,需要加入A物质的质量是。
适应性综合训练
本卷可能用到的相对原子质量:
H=1O=16N=14C=12Na=23S=32P=31Cl=35.5K=39Mg=24Mn=55Fe=56Al=27Zn=65
一、选择题(每小题只有一个选项符合题意,每小题2分,共30分)
1.日常生活中的下列现象,属于物理变化的是()
A.冰雪融化B.燃放烟花C.牛奶变酸D.煤气中毒
2.吸烟有害健康,烟气中含有能与血液中血红蛋白结合的有毒气体,它是()
A.氮气B.氧气C.二氧化碳D.一氧化碳
3.下列物质属于纯净物的是()
A.可口可乐B.合金C.啤酒D.葡萄糖
4.新型净水剂铁酸钠(Na2FeO4)中,铁元素的化合价是()
A.+2价B.+6价C.+5价D.+3价
5.钛和钛合金是21世纪的重要金属材料。
它们具有优良的性能,如熔点高、密度小、可塑性好、机械性能好、抗腐蚀能力强,钛合金与人体有很好的“相容性”。
根据它们的主要性能,不合实际的用途是()
A.用于核潜艇设备的制造B.用于制造航天设备
C.用来做保险丝D.可用来制造人造骨
6.下列用途中,利用了物质化学性质的是()
A.用稀盐酸除铁锈B.用干冰作人工降雨剂
C.用金刚石切割玻璃D.用活性炭吸咐毒气
7.下列各组物质,按化合物、单质、混合物顺序排列的是()
A.烧碱、液态氧、碘酒B.生石灰、熟石灰、白磷
C.干冰、铜、氯化氢D.空气、氮气、胆矾
8.油炸食物不宜多吃,因为食物长时间煎炸后所产生的微量的丙烯醛(化学式C3H4O)
等有毒物质,会损害人体健康。
下列有关丙烯醛的说法不正确的是()
A.丙烯醛中碳、氢、氧的原子个数比为3:
4:
1B.丙烯醛是无机物
C.丙烯醛是由碳、氢、氧三种元素组成的化合物D.丙烯醛的相对分子质量是56
9.下列化学实验基本操作,正确的是()
A.稀释浓硫酸时,把浓硫酸慢慢倒入盛水的量筒中并搅拌
B.用滴管滴加液体时,为防止液滴飞溅应紧贴试管内壁
C.向燃着的酒精灯里添加酒精
D.用托盘天平称量药品时,称量物放在左盘,砝码放在右盘
10.在蔬菜生长的过程中,常喷洒农药防治病虫害。
据有关专家介绍,用碱性溶液或水浸泡,可使残留在蔬菜上的农药的毒性降低。
因此,买来的蔬菜在食用前最好用稀碱水或清水浸泡一段时间。
浸泡蔬菜时可加入适量()
A.纯碱B.白酒C.白糖D.食醋
11.用下列溶液分别滴入NaOH溶液、Ca(OH)2溶液、稀H2SO4中,产生三种不同现象的是()
A.FeCl2溶液B.KNO3溶液C.Na2CO3溶液D.无色酚酞试液
12.在某化学实验小组的研究报告里使用了如下化学符号,其中不正确的是()
A.镁离子:
Mg2+B.两个氮原子:
2N2
C.五氧化二磷:
P2O5D.氯化钾:
KCl
13.将mgKNO3的不饱和溶液恒温蒸发水分,直至有晶体析出。
在此变化过程中,溶
液中溶质质量分数(a%)与蒸发时间(t)的变化关系可用下图表示的是()
14.手机使用的锂电池板是新型的高能电池,以质量轻、电容量大而受到重视。
某种锂电池的总反应可表示为Li+MnO2=LiMnO2。
下列说法中正确的是()
A.LiMnO2为新型的氧化物B.LiMnO2为锂、锰、氧的合金
C.该反应属于化合反应D.该反应中Mn的化合价没有变化
15、A、B、C、D、E是常见的五种无色气体,它们之间转化关系如图所示(图中反应条
件已略去,X在常温下为液体),则下列推断正确的是()
A、D是H2B、E是CH4
C、C是H2D、B是CO
二、填空题(26分)
16、(3分)从给定化合价的
、
五种元素中,选择适当的元素写出下列有关物质的化学式:
酸性氧化物______________;
无氧酸______________;
单质______________。
17、(6分)我们的日常生活与化学有着密切的联系。
请在①氢气、②石墨、③干冰、④酒精、⑤食醋、⑥纯碱这几种物质中选用适当物质填空(填序号):
写字用的铅笔中含______;
司机驾车前饮用的饮料中,不能含有的是______;
属于未来新型能源的是______;
厨房调味品中pH小于7的是______;
可以用作制冷剂的是______;
可用于家庭清洗油污的是______。
18、(7分)我省德兴市铜矿蕴藏丰富,炼铜历史悠久。
⑴该地产的一种矿石叫辉铜矿,主要成分为硫化亚铜(Cu2S),其中铜的化合价是______,铜元素与硫元素的质量比为______。
⑵当地还产一种矿石叫孔雀石,成分Cu2(OH)2CO3,加热时生成三种氧化物。
该反应的化学方程式为___________________________________________,反应类型是____________。
反应中生成的黑色氧化物在一定条件下能被还原,生成红色固体,在该反应中可加入的还原剂有______、______等。
19、(6分)亚硝酸钠(化学式NaNO2)是一种外观极像食盐,且具有食盐一样咸味的有毒物质,因此这种工业用盐常被冒充食盐掺假或被误作食盐作用,导致多起中毒事故发生。
请你阅读下表有关资料,并结合已有化学知识,用三种方法鉴别亚硝酸钠和氯化钠。
项目
亚硝酸钠
氯化钠
溶解性
15℃时溶解度为81.5g
15℃时溶解度为35.8g
熔点
271℃
801℃
沸点
(320℃时发生分解主出有臭味气体)
1413℃
水溶液酸碱性
碱性
中性
方案
选取的试剂
实验现象和结论
⑴
⑵
⑶
20、(4分)某研究小组将足量的A、B两种金属同时分别放入两份质量分数相同的少量稀盐酸中,根据实验现象,绘制的反应生成H2的体积
(气体体积都在相同状况下测定)与反应时间的关系如上图所示。
根据此图,请你写出两条结论。
(1);
(2)。
三、情景分析题(共8分)
21、(4分)食品包装盒中常放一小袋粉末状物质,该物质对食品同时具有防潮和防氧化作用。
某同学从超市购买的食品包装盒中取出装有粉末状物质的小袋,撕开发现袋里有板结的铁锈。
试推测粉末状物质是什么?
其作用原理是什么?
22、(4分)天然气水合物是一种在高压低温条件下由水和天然气形成的冰态物,主要分布在海底和陆地冻土带沉积物中。
经勘探发现天然气水合物存储量巨大,有望成为主要能源。
请回答下列问题:
(1)天然气水合物中,水分子形成一种空间笼状结构,CH4和少量的N2、CO2等分子填入笼内的空隙中,无固定的化学计量关系,因此天然气水合物属于(选填“纯净物”或“混合物”)。
若某种天然气水合物中甲烷存在的形式是CH4·
5.75H20,则两者质量比为m(CH4):
m(H2O)=。
(2)若将天然气从其冰态物中分离出来,有三种方法:
①在一定温度下,使气体从水合物中分离出来;
②在一定压力下,使气体从水合物中分离出来;
③通过加入甲醇或盐类等物质,可降低水合物的凝固点。
四、实验与探究题(每空2分,共22分)
23、
(10分)在实验室中,利用右图装置可以制取并收集多种气体(必要时可以加热)。
(1)李明同学想利用该装置制取干燥的O2,应对装置作何改进?
。
a中发生反应的化学方程式为;
b中盛放的试剂是。
(2)李明同学还想利用上述实验装置制取H2和CO2,请你对他的方案给予评价:
制取的气体
a中盛放的试剂
b中盛放的试剂
评价
(回答是否可行;
若不可行,说出理由)
H2
Zn、稀H2SO4
浓H2SO4
CO2
大理石、稀盐酸
24、(12分)取一片洗净晾干的鸡蛋壳(主要成分为碳酸钙,不考虑其他杂质),放在酒精喷灯火焰上灼烧一段时间后,放置冷却。
某同学设计了下列实验方案探究灼烧后残留固体的组成,请将有关内容记录在下表中。
残留固体的成分
探究的步骤
可能观察到的现象
结论及化学反应方程式
⑴可能有氧化钙。
取残留固体加水溶解,过滤,向滤液中滴加几滴无色酚酞试液。
现象:
结论:
⑵还可能有碳酸钙。
另取残留固体滴加足量盐酸。
①
方程式:
五、计算题(25题6分,26题8分,共14分)
25、
(1)2003年8月以来,我国齐齐哈尔等地相继发生了侵华日军遗留的芥子气泄漏伤人事件。
芥子气化学式为(C4H8Cl2S),求:
芥子气的相对分子质量_________,芥子气中碳、氢元素的质量比_________。
(2)请根据下图要求,自编一道有关溶液的计算题,并进行解答。
26、用13g锌粒与适量的某硫酸溶液恰好完全反应来制取氢气。
⑴计算生成氢气的质量;
⑵若所用硫酸溶液的质量为50g,计算该硫酸溶液中溶质的质量分数。