高考桂林市崇左联合调研考试高三理综化学卷二模Word下载.docx
《高考桂林市崇左联合调研考试高三理综化学卷二模Word下载.docx》由会员分享,可在线阅读,更多相关《高考桂林市崇左联合调研考试高三理综化学卷二模Word下载.docx(16页珍藏版)》请在冰豆网上搜索。
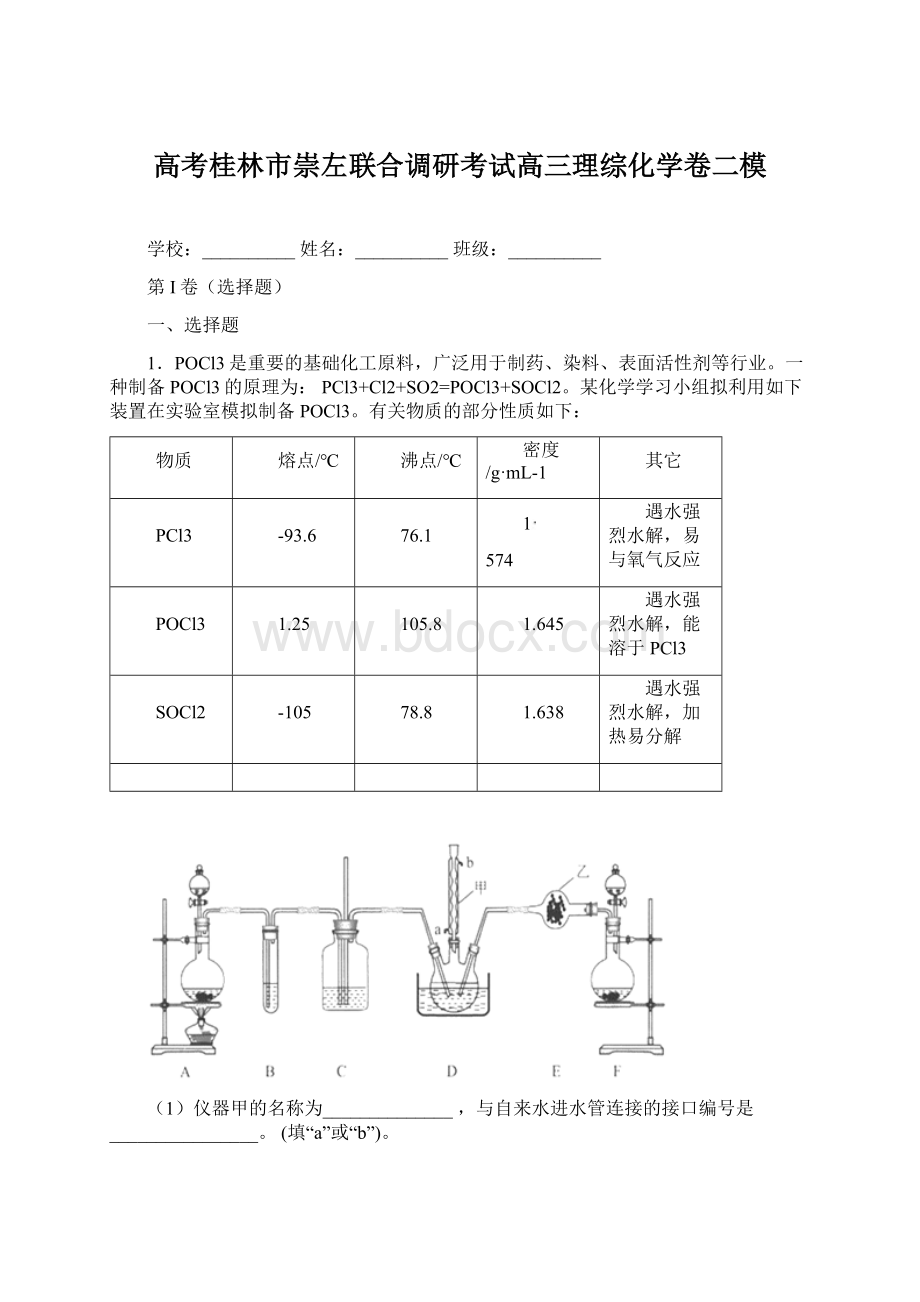
(2)装置C的作用是___________________,乙中试剂的名称为____________________。
(3)该装置有一处缺陷,解决的方法是在现有装置中再添加一个装置,该装置中应装入的试剂为_________(写名称)。
若无该装置,则可能会有什么后果?
请用化学方程式进行说明__________________________。
(4)D中反应温度控制在60-65℃,其原因是_______________。
(5)测定POCl3含量。
①准确称取30.70g
POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00
mL3.200
mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+为指示剂,用0.2000
mol/L
KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00
mLKSCN溶液。
①滴定终点的现象为____________________,用硝基苯覆盖沉淀的目的是__________________。
②反应中POCl3的百分含量为__________________。
2.制备N2H4·
H2O(水合肼)和无水Na2SO3主要实验流程如下:
已知:
①氯气与烧碱溶液的反应是放热反应;
②N2H4·
H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·
H2O(沸点约118℃)的装置如图。
NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。
①使用冷凝管的目的是_________________。
②滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③写出流程中生成水合肼反应的化学方程式________________________________。
⑸步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。
实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
3.下列叙述中正确的是
A.由金属元素和非金属元素形成的化合物一定是离子化合物
B.完全由非金属元素形成的化合物一定是共价化合物
C.离子化合物中只含有离子键
D.共价化合物中只含有共价键
4.有Ⅰ~Ⅳ四个体积均为0.5L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)
2Cl2(g)+2H2O(g);
ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。
下列说法正确的是( )
容器
起始时
t/℃
n(HCl)/mol
Z
Ⅰ
300
0.25
a
Ⅱ
b
Ⅲ
4
A.ΔH<
0,a<
4<
B.300℃该反应的平衡常数的值为64
C.容器Ⅲ某时刻处在R点,则R点的v正>
v逆,压强:
p(R)>
p(Q)
D.若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·
L-1
第Ⅱ卷(非选择题 共80分)
5.(12分)使用磷肥副产物氟硅酸钠(Na2SiF6)为原料合成冰晶石(Na3AlF6)成为一条合理利用资源、提高经济效益的新方法。
工艺流程如下图所示:
(1)传统合成冰晶石的方法是萤石(CaF2)法:
使用萤石、石英和纯碱在高温下煅烧生成NaF,在NaF溶液中加入Al2(SO4)3溶液制得。
在加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,
否则可能产生副产物________(填物质的化学式),但酸度不宜过强的原因是________。
(2)氨解时白炭黑产率和冰晶石纯度与pH的关系如图,氨解时需要控制溶液的pH=________;
能提高氨解速率的措施有________(填字母)。
A.快速搅拌 B.加热混合液至100℃
C.减小氨水浓度
(3)工艺流程中氨解反应的化学方程式为__________________;
冰晶石合成反应的离子方程式为______________________。
(4)为了提高原料利用率,减少环境污染,可采取的措施是________。
6.香豆素3羧酸是日用化学工业中重要香料之一,它可以通过水杨醛经多步反应合成:
A.一定条件下,水杨醛可与甲醛发生缩聚反应
B.可用酸性高锰酸钾溶液检验中间体A中是否混有水杨醛
C.中间体A、香豆素-3-羧酸互为同系物
D.1mol香豆素-3-羧酸最多能与1molH2发生加成反应
7.阿司匹林的有效成分是乙酰水杨酸(COOHOCOCH3),可以用水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为原料合成。
下列说法正确的是
A.可用酸性KMnO4溶液鉴别水杨酸和乙酰水杨酸
B.已知HCHO为平面形分子,则乙酸酐中最多8个原子共平面
C.1mol乙酰水杨酸最多消耗2molNaOH
D.服用阿司匹林时若出现水杨酸反应,应立即停药并静脉注射Na2CO3溶液
8.下列有关化学用语表示正确的是
A.中子数力79、质子数为55的铯(Cs)原子
Cs
B.氮气分子的电子式:
C.HOCH2COOH缩聚物的结构简式:
D.氯离子的结构示意图:
9.化学与生产、生活密切相关,下列说法错误的是()
A.食品包装袋中充入氮气可防止食物氧化变质
B.瓷器烧制前后颜色不同的现象称为“窑变”,“窑变”属于物理变化
C.酸性重铬酸钾溶液可用于测试司机是否饮酒
D.从健康角度考虑臭氧比氯气更适合作为自来水消毒剂
【答案】B
【解析】
【详解】A、由于氮气的化学性质不活泼,可将氮气充入食品包装袋中防止食品变质,选项A正确;
B、“窑变”是因为高温下某些金属元素的价态发生变化从而导致颜色变化,“窑变”属于化学变化,选项B错误;
C、酸性重铬酸钾溶液可氧化乙醇,溶液颜色变绿色,故酸性重铬酸钾溶液可用于测试司机是否饮酒,选项C正确;
D、从健康角度考虑臭氧比氯气更适合作为自来水消毒剂,不产生氯残留,选项D正确。
答案选B。
10.自然界中铝元素主要存在于铝土矿(主要成分为Al2O3、FeO、Fe2O3、SiO2)中,铝的单质及其化合物在生产、生活、科研等领域应用广泛。
工业上用铝土矿制备铝的某种化合物的工艺流程如下:
下列说法错误的是
A.在实验室实施操作Ⅰ需要的玻璃仪器是漏斗、烧杯、玻璃棒
B.为使铝元素全部转化为Al(OH)3,每一步操作的试剂均需过量
C.将试剂X与操作Ⅱ的试剂过量盐酸互换,也可制得Al(OH)3
D.固体A的主要成分是FeO和Fe2O3
12.下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是
选项
X
Y
箭头上为反应条件或试剂
A
Fe
FeCl2
FeCl3
①通入少量Cl2
B
Na2CO3
NaCl
NaHCO3
②先通CO2,再通过量NH3
C
MgO
MgCl2
Mg(OH)2
③加热
D
NaAlO2
Al(OH)3
Al2O3
④加水
13.下列说法不正确的是
A.恒温恒压容器中反应A(s)+2B(g)
3C(g)达平衡后,再加入A,气体B的浓度保持不变
B.恒温恒容容器中反应2SO2(g)+O2(g)
2SO3(g)达平衡后再通入N2,SO3的体积分数增大
C.恒温下,向密闭容器中加入NH2COONH4固体,反应NH2COONH4(s)
2NH3(g)+CO2(g)
达平衡后,缩小容器的容积,再达平衡时,
的体积分数不变
D.恒温恒容容器中,N2(g)+3H2(g)
2NH3(g)达平衡后,改变条件使平衡正向移动,再
达平衡时NH3的体积分数不一定增大
14.下列说法不正确的是
实验
现象
结论
A.
向含有酚酞的Na2CO3溶液中加入少量BaCl2固体
产生白色沉淀,溶液红色变浅
证明Na2CO3溶液存在水解平衡
B.
某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有Fe2+
C.
测定等浓度的Na2CO3和Na2SO3溶液的pH
Na2CO3溶液的pH较大
非金属性是S>
D.
向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)﹤Ksp(AgCl)
11.NA为阿伏加德罗常数的值,下列说法正确的是(
)
A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B.标准状况下,22.4L氖气含有的电子数为10NA
C.常温下,
的醋酸溶液中含有的
数为
D.120gNaHSO4分子中阳离子和阴离子的总数为3NA
二、填空题
12.高锰酸钾是中学常用化学试剂,工业上常以软锰矿(主要成分是MnO2)为原料进行制备,主要工艺流程如下图:
3K2MnO4+2H3PO4═2KMnO4+MnO2↓+2K2HPO4+2H2O
KMnO4
K2HPO4
K2SO4
CH3COOK
KCl
K2CO3
293K溶解度/g
6.4
150
11.1
217
34
111
(1)原料高温煅烧时选用铁坩埚和铁棒,理由是__________。
(2)①中每生成1molK2MnO4时电子转移2mol,写出化学反应方程式_________。
(3)从反应机理和产物分离角度考虑,③可用磷酸,也可用下列________试剂。
A.醋酸B.盐酸C.硫酸D.CO2
(4)下列描述不正确的是_________。
A.操作⑤中蒸发至大量晶体析出再冷却晶体,趁热过滤
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸
C.可用无水乙醇洗涤产品提高纯度
D.KMnO4晶体的烘干温度过高会降低产率
(5)粗产品的洗涤步骤可能需要用到以下操作:
a.加入洗涤剂至浸没固体;
b.洗涤剂缓慢通过;
c.洗涤剂快速通过;
d.关小水龙头;
e.开大水龙头;
f.重复2~3次。
请选出正确的操作并排序________。
(操作可重复使用)
(6)高锰酸钾产品的纯度测定:
准确称取0.7900g产品,配成250mL溶液,量取25.00mL于锥形瓶中,用0.1000mol•L﹣1(NH4)2Fe(SO4)2标准溶液进行滴定,滴定终点的现象__________。
滴定前和滴定后的液面见下图。
计算出高锰酸钾的纯度为_______。
参考答案
三、单选题
13.如图所示,a、b为直流电源的两极,E是用NaCl溶液和品红试液的混合液湿润的滤纸,通电后发现乙周围滤纸褪色,则下列判断正确的是:
A.甲处产生的气体是氧化产物B.a是负极,b是正极
C.甲处pH下降D.乙处的电极可以是铁棒
【参考答案】***试卷处理标记,请不要删除
1.C
解析:
(1).球形冷凝管
(2).a(3).干燥Cl2,同时作安全瓶,防止堵塞(4).五氧化二磷(或硅胶)(5).碱石灰(6).POCl3+3H2O=H3PO4+3HCl,SOCl2+H2O=SO2+2HCl(7).一是温度过高,PCl3会大量挥发,从而导致产量降低;
二是温度过低,反应速率会变慢(8).当最后一滴标准KSCN
溶液滴入时,溶液变为红色,且半分钟不褪去(9).使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl
反应(10).50%
分析:
本题以POCl3的制备为载体,考查Cl2、SO2的实验室制备、实验条件的控制、返滴定法测定POCl3的含量。
由于PCl3、POCl3、SOCl2遇水强烈水解,所以用干燥的Cl2、SO2与PCl3反应制备POCl3,则装置A、B、C、D、E、F的主要作用依次是:
制备Cl2、除Cl2中的HCl(g)、干燥Cl2、制备POCl3、干燥SO2、制备SO2;
为防止POCl3、SOCl2水解和吸收尾气,D装置后连接盛碱石灰的干燥管。
返滴定法测定POCl3含量的原理:
POCl3+3H2O=H3PO4+3HCl、AgNO3+HCl=AgCl↓+HNO3,用KSCN滴定过量的AgNO3,发生的反应为KSCN+AgNO3=AgSCN↓+KNO3,由消耗的KSCN计算过量的AgNO3,加入的总AgNO3减去过量的AgNO3得到与Cl-反应的AgNO3,根据Ag++Cl-=AgCl↓和Cl守恒计算POCl3的含量。
详解:
(1)根据仪器甲
构造特点,仪器甲的名称为球形冷凝管。
为了更充分的冷凝蒸气,冷凝管中的水应下进上出,与自来水进水管连接的接口的编号为a。
(2)由于PCl3、POCl3、SOCl2遇水强烈水解,所以制备POCl3的Cl2和SO2都必须是干燥的。
根据装置图和制备POCl3的原理,装置A用于制备Cl2,装置B用于除去Cl2中HCl(g),装置C用于干燥Cl2,装置F用于制备SO2,装置E用于干燥SO2,装置D制备POCl3;
装置C的作用是干燥Cl2,装置C中有长直玻璃管,装置C的作用还有作安全瓶,防止堵塞。
乙中试剂用于干燥SO2,SO2属于酸性氧化物,乙中试剂为五氧化二磷(或硅胶)。
(3)由于SO2、Cl2有毒,污染大气,最后要有尾气吸收装置;
POCl3、SOCl2遇水强烈水解,在制备POCl3的装置后要连接干燥装置(防外界空气中H2O(g)进入装置D中),该装置缺陷的解决方法是在装置D的球形冷凝管后连接一个既能吸收SO2、Cl2又能吸收H2O(g)的装置,该装置中应装入的试剂是碱石灰。
若没有该装置,POCl3、SOCl2发生强烈水解,反应的化学方程式为POCl3+3H2O=H3PO4+3HCl、SOCl2+H2O=SO2+2HCl。
(4)D中反应温度控制在60~65℃,其原因是:
温度太低,反应速率太慢;
温度太高,PCl3会大量挥发(PCl3的沸点为76.1℃),从而导致产量降低。
(5)①以Fe3+为指示剂,当KSCN将过量的Ag+完全沉淀时,再滴入一滴KSCN溶液与Fe3+作用,溶液变红色,滴定终点的现象为:
当最后一滴标准KSCN
溶液滴入时,溶液变为红色,且半分钟不褪去。
硝基苯是难溶于水且密度大于水的液体,用硝基苯覆盖沉淀的目的是:
使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl
反应。
②n(AgNO3)过量=n(KSCN)=0.2000mol/L
0.01L=0.002mol,沉淀10.00mL溶液中Cl-消耗的AgNO3物质的量为3.200mol/L
0.01L-0.002mol=0.03mol,根据Ag++Cl-=AgCl↓和Cl守恒,样品中n(POCl3)=
=0.1mol,m(POCl3)=0.1mol
153.5g/mol=15.35g,POCl3的百分含量为
100%=50%。
2.C
(1).尿素
(2).8Cl2+16OH-=5ClO-+ClO3-+10Cl-+8H2O(3).冰水浴冷却(4).通过冷凝回流,减少水合肼的挥发,提高水合肼的产率(5).NaClO碱性溶液(6).打开滴液漏斗的活塞,旋转旋塞使漏斗内的液体缓缓流下(7).NaClO+CO(NH2)2+2NaOH=NaCl+N2H4·
H2O+Na2CO3(8).4(9).10
【分析】
由实验流程可知,氯气和氢氧化钠溶液的反应生成NaClO,为避免生成NaClO3,应控制温度在40℃以下,生成的NaClO与尿素反应生成N2H4•H2O和Na2CO3,可用蒸馏的方法分离出N2H4•H2O,副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3,结合对应物质的性质以及题给信息分析解答。
【详解】⑴根据流程图,本流程所用的主要有机原料为尿素,故答案为:
尿素;
(2)若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质
量之比为5∶1,同时还生成NaCl,根据得失电子守恒,ClO-∶ClO3-∶Cl-物质的量之比为5∶1∶10,反应的离子方程式为8Cl2+16OH-=5ClO-+ClO3-+10Cl-+8H2O,故答案为:
8Cl2+16OH-=5ClO-+ClO3-+10Cl-+8H2O;
⑶氯气与烧碱溶液的反应是放热反应,实验中,为使步骤Ⅰ中反应温度不高于40℃,除减缓Cl2的通入速率外,避免反应过于剧烈,放出大量的热而导致温度升高,还可以用冰水浴冷却,故答案为:
冰水浴冷却;
(4)①为避免N2H4•H2O的挥发,使用冷凝管,起到冷凝回流,减少水合肼的挥发,提高水合肼的产率,故答案为:
通过冷凝回流,减少水合肼的挥发,提高水合肼的产率;
②为了避免N2H4•H2O与NaClO剧烈反应生成N2,实验中通过滴液漏斗滴加的溶液是NaClO碱性溶液;
将滴液漏斗内的液体放入三颈烧瓶内的操作是打开滴液漏斗的活塞,旋转旋塞使漏斗内的液体缓缓流下,故答案为:
NaClO碱性溶液;
打开滴液漏斗的活塞,旋转旋塞使漏斗内的液体缓缓流下;
③根据流程图,NaClO和CO(NH2)2在NaOH溶液中反应生成水合肼和碳酸钠,反应的化学方程式为NaClO+CO(NH2)2+2NaOH=NaCl+N2H4·
H2O+Na2CO3,故答案为:
NaClO+CO(NH2)2+2NaOH=NaCl+N2H4·
H2O+Na2CO3;
(5)用Na2CO3制备无水Na2SO3,在Na2CO3溶液中通入过量的二氧化硫生成NaHSO3,然后在NaHSO3溶液中加入NaOH溶液可生成Na2SO3。
①由图像可知,溶液pH约为4时,可完全反应生成NaHSO3,此时可停止通入二氧化硫,故答案为:
4;
②由图像可知pH约为10时,可完全反应生成Na2SO3,故答案为:
10。
3.D
A、金属元素和非金属元素形成的化合物不一定是离子化合物,可能是共价化合物,如氯化铝,选项A错误;
B、完全由非金属之间形成的化合物不一定是共价化合物,可能是离子化合物,如铵盐,选项B错误;
C、离子化合物也可能含有共价键,如NaOH,选项C错误;
D、共价化合物中只含有共价键,选项D正确。
答案选D。
4.A
AC
5.A
(12分,每空2分)
(1)Al(OH)3 H+和F-结合生成弱酸HF,使F-浓度减低不易生成Na3AlF6
(2)8.5 A
(3)Na2SiF6+4NH3·
H2O===2NaF+4NH4F+SiO2+2H2O
3Na++4NH
+6F-+AlO
+2H2O===Na3AlF6↓+4NH3·
H2O
(4)过滤2的滤液氨水可循环利用
6.A
7.A
A.水杨酸分子中的酚羟基易被氧化,能使酸性高锰酸钾溶液褪色,而乙酰水杨酸不易被氧化,故A正确;
B.HCHO为平面形分子且单键可以旋转,因此碳氧双键周围的原子都可处于同一平面,甲基上的碳原子为饱和碳原子,每个甲基上有2个氢原子不能共平面,所以乙酸酐中最多有9个原子共平面,故B错误;
C.乙酰水杨酸中的羧基和酚酯基都能与NaOH反应,因每1mol酚酯基可消耗2molNaOH,故最多可消耗3molNaOH,故C错误;
D.阿司匹林为感冒用药,服用过量会造成水杨酸中毒,出现水杨酸反应应静脉注射NaHCO3溶液而不是Na2CO3溶液,Na2CO3溶液碱性太强,故D错误;
故选A。
8.D
【详解】A项、中子数为79、质子数为55的铯(Cs)原子的质量数为134,该原子正确的表示方法为13455Cs,故A错误;
B项、氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为
,故B错误;
C项、HOCH2COOH分子中含有羟基和羧基,HOCH2COOH能够发生缩聚反应生成
,故C错误;
D项、氯原子的质子数为17,最外层电子数为7,易得到1个电子形成氯离子,氯离子的离子结构示意图为
,故D正确。
故选D。
【点睛】本题考查化学用语,涉及离子结构示意图、电子式、结构简式的判断,注意掌握常见的化学用语的概念及表示方法,注意化学用语规范表达是解答关键。
9.无
10.无
11.A
【详解】A.氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸,所以无法计算转移的电子数,故A错误;
B.标准状况下,22.4L氖气
1mol,一个Ne原子含有10个电子,即1mol氖气含有10NA个电子,故B正确;
C.醋酸溶液的体积未知,则无法计算H+数目,故C错误;
D.120gNaHSO4为1mol,1molNaHSO4分子中含有1molNa+和1molHSO4-,则120gNaHSO4分子中阳离子和阴离子的总数为2NA,故D错误;
故选B。
12.【KS5U答案】高温下瓷坩埚和玻璃棒会与KOH等反应,与铁不反应6KOH+KClO3+3MnO23K2MnO4+KCl+3H2OADABCdabef滴入最
【KS5U答案】高温下瓷坩埚和玻璃棒会与KOH等反应,与铁不反应6KOH+KClO3+3MnO2
3K2MnO4+KCl+3H2OADABCdabef滴入最后一滴标准液,溶液紫