北京市2017-2018高三期末考试分类汇编氧化还原反应.docx
《北京市2017-2018高三期末考试分类汇编氧化还原反应.docx》由会员分享,可在线阅读,更多相关《北京市2017-2018高三期末考试分类汇编氧化还原反应.docx(8页珍藏版)》请在冰豆网上搜索。
氧化还原反应
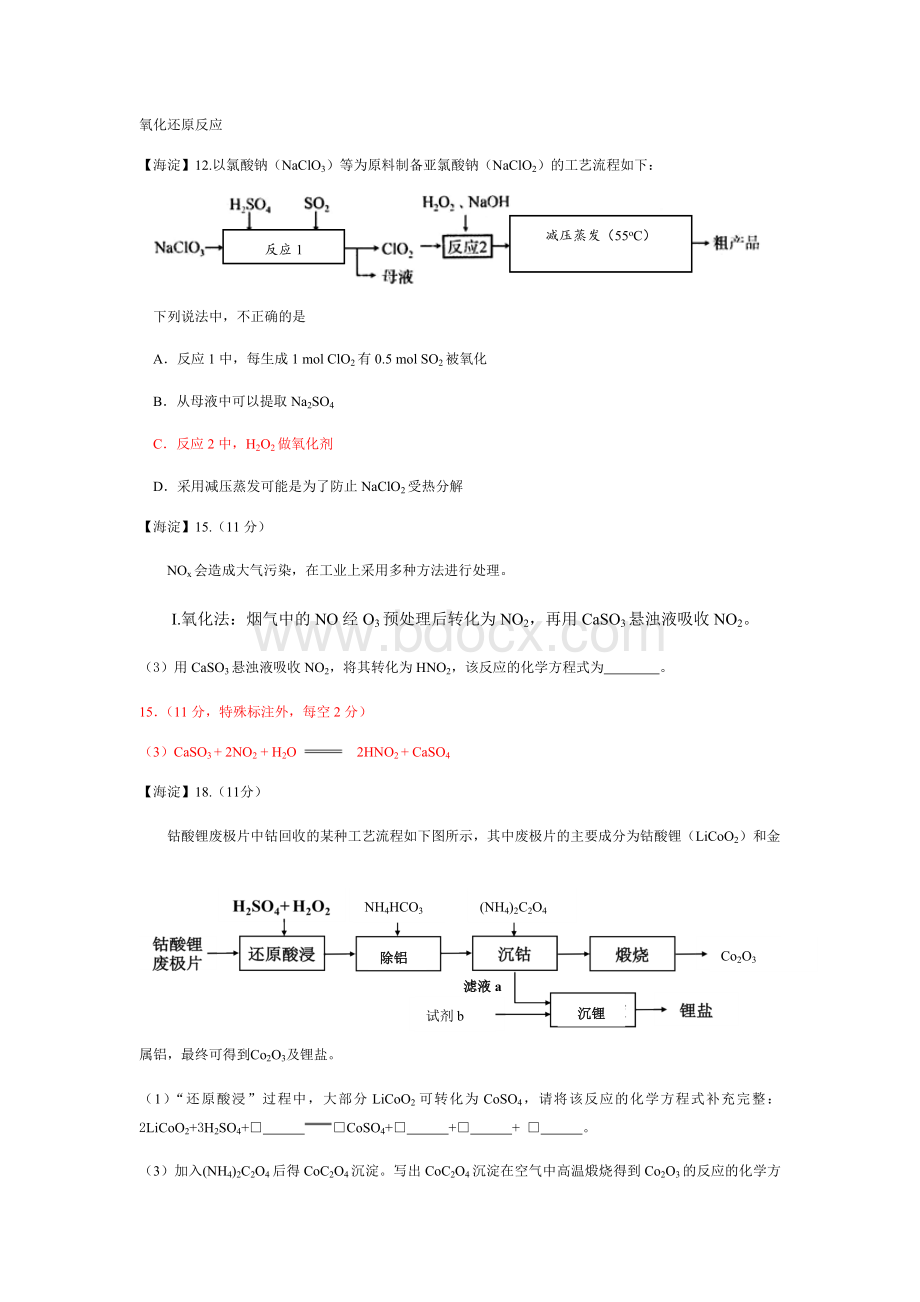
【海淀】12.以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下:
减压蒸发(55oC)
冷却结晶
反应1
下列说法中,不正确的是
A.反应1中,每生成1molClO2有0.5molSO2被氧化
B.从母液中可以提取Na2SO4
C.反应2中,H2O2做氧化剂
D.采用减压蒸发可能是为了防止NaClO2受热分解
【海淀】15.(11分)
NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:
烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为。
15.(11分,特殊标注外,每空2分)
(3)CaSO3+2NO2+H2O2HNO2+CaSO4
【海淀】18.(11分)
NH4HCO3
(NH4)2C2O4
沉锂
滤液a
试剂b
Co2O3
除铝
钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。
(1)“还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:
2LiCoO2+3H2SO4+□□CoSO4+□+□+□。
(3)加入(NH4)2C2O4后得CoC2O4沉淀。
写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:
。
18.(11分,特殊标注外,每空2分)
(1)2LiCoO2+3H2SO4+H2O22CoSO4+Li2SO4+O2↑+4H2O
(3)4CoC2O4+3O22Co2O3+8CO2
【西城】18.(6分)某同学取海带灰加蒸馏水煮沸2~3min,冷却,过滤,获得含I−的溶液,并设计以下实验方案,从中提取I2。
已知:
3I2+6NaOH==5NaI+NaIO3+3H2O
(1)试剂a的作用是________。
(2)试剂b应选择________(填序号)。
A.CCl4B.苯C.酒精D.植物油
(3)操作1的名称是________。
(4)反应3的离子方程式是________。
【西城】20.(12分)氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。
某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。
由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。
Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a[主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。
Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
Ⅴ.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O4·2H2O沉淀。
分离出沉淀,将其在400℃~600℃煅烧,即得到Co2O3。
请回答:
(1)Ⅰ中,稀硫酸溶解CoCO3的化学方程式是________,加入Na2SO3溶液的主要作用是________。
(3)Ⅱ中,浸出液中的金属离子与NaClO3反应的离子方程式:
ClO3−++==Cl−++
【西城】21.(10分)某小组同学进行实验研究FeCl3溶液和Na2S溶液的反应。
【实验一】
已知:
FeS、Fe2S3均为黑色固体,均能溶于盐酸。
H2S气体有臭鸡蛋气味。
同学们对黑色沉淀的成分提出两种假设:
ⅰ.Fe3+与S2−反应直接生成沉淀Fe2S3。
ⅱ.Fe3+被S2−还原,生成沉淀FeS和S。
甲同学进行如下实验:
操作
现象
取少量FeS固体,加入稀盐酸
固体溶解,有臭鸡蛋气味气体生成
取少量Fe2S3固体,加入稀盐酸
固体溶解,出现淡黄色浑浊,有臭鸡蛋气味气体生成
根据上述实验现象和资料,甲得出结论:
黑色沉淀是Fe2S3。
(1)0.1mol·L−1Na2S溶液的pH为12.5。
用离子方程式表示其显碱性的原因:
_______。
(2)乙认为甲的结论不严谨,理由是________。
(3)进一步研究证实,黑色沉淀的主要成分是Fe2S3。
Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的可能原因是________。
【实验二】
步骤
操作
现象
I
开始时,局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失,同时溶液中产生淡黄色浑浊和臭鸡蛋气味的气体
II
继续滴加Na2S溶液
一段时间后,产生大量的黑色沉淀,振荡,沉淀不消失
(4)进一步实验证实,步骤I中局部产生少量的黑色沉淀是Fe2S3,黑色沉淀溶解的主要原因不是Fe2S3与溶液中Fe3+发生氧化还原反应。
步骤I中黑色沉淀溶解的反应的离子方程式是________。
(5)根据以上研究,FeCl3溶液和Na2S溶液反应的产物与________相关。
【东城】19.(14分)某小组研究Na2S溶液与KMnO4溶液反应,探究过程如下。
实验序号
Ⅰ
Ⅱ
实验过程
滴加10滴(约0.3mL)
0.1mol/LNa2S溶液
5mL0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
滴加10滴(约0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
5mL0.1mol/LNa2S溶液
实验现象
紫色变浅(pH<1),生成棕褐色沉淀(MnO2)
溶液呈淡黄色(pH≈8),生成浅粉色沉淀(MnS)
资料:
ⅰ.在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有________性。
(2)甲同学预测实验I中S2–被氧化成。
①根据实验现象,乙同学认为甲的预测不合理,理由是________。
②乙同学取实验I中少量溶液进行实验,检测到有,得出S2–被氧化成的结论,丙同学否定了该结论,理由是________。
③同学们经讨论后,设计了如下实验,证实该条件下的确可以将S2–氧化成。
0.1mol/LNa2S溶液
碳棒
碳棒
a.右侧烧杯中的溶液是________。
b.连通后电流计指针偏转,一段时间后,________(填操作和现象)。
(3)实验I的现象与资料i存在差异,其原因是新生成的产物(Mn2+)与过量的反应物()发生反应,该反应的离子方程式是________。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是______。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与________因素有关。
19.(14分)
(1)还原
(2)①溶液呈紫色,说明酸性KMnO4溶液过量,能被其继续氧化
②因KMnO4溶液是用H2SO4酸化的,故溶液中出不一定是氧化新生成的
③a.0.01mol/LKMnO4溶液(H2SO4酸化至pH=0)
b.取左侧烧杯中的溶液,用盐酸酸化后,滴加BaCl2溶液,观察到有白色沉淀生成
(3)2Mn+3Mn2+-+2H2O=5MnO2↓+4H+
(4)将实验I中生成的MnO2分离洗涤后,加入0.1mol/LNa2S溶液,观察到有浅粉色沉淀,且溶液呈黄色,证明新生成的MnO2与过量的S2-反应,故没得到MnO2沉淀
(5)浓度、用量、溶液中的酸碱性
【朝阳】17.(12分)印刷铜制电路板的腐蚀液选取和回收再利用一直是研究的热点。
(1)FeCl3溶液一直作为传统的腐蚀液。
(2)研究发现,CuCl2溶液添加盐酸或氨水配制成酸性腐蚀液或碱性腐蚀液,其效果优于FeCl3溶液。
腐蚀液的主要成分及腐蚀原理如下:
腐蚀液类型
主要成分
腐蚀原理
酸性腐蚀液
Cu2+、H+、Cl-
Cu+Cu2++2Cl-2CuCl,
CuCl+2Cl-CuCl32-
碱性腐蚀液
Cu(NH3)42+、NH4+、
NH3、Cl-
Cu(NH3)42++Cu===2Cu(NH3)2+
③通入适量的氧气可使碱性腐蚀液再生。
将该过程的离子方程式补充完整:
1
Cu(NH3)2++NH3+NH4++O2===+
(3)H2O2也常用来腐蚀金属铜,使用时加入盐酸或氨水将其配制成酸性或碱性腐蚀液。
回收其废液的工艺如下:
①酸性条件下H2O2腐蚀金属铜的离子方程式为。
17.(12分)
(2)
③4,4,4,4Cu(NH3)42+,2H2O
(3)①Cu+H2O2+2H+===Cu2++2H2O
【丰台】3.下列变化中,发生氧化还原反应的是
A.用晶体Si制作半导体B.煅烧石灰石制备生石灰
C.用Na2O2做呼吸面具供氧剂D.用可溶性铝盐处理水中悬浮物
【丰台】14.处理超标电镀废水,使其NaCN含量低于0.5mg/L,即可达到排放标准,反应分两步进行。
第一步NaCN与NaClO反应,生成NaOCN和NaCl。
第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。
已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。
下列说法正确的是
A.处理NaCN超标电镀废水的过程中无元素化合价的改变
B.第一步反应溶液应调节为酸性,可避免生成有毒物质HCN
C.第二步发生的反应为2OCN-+3ClO-2CO2↑+CO32−+3Cl-+N2↑
D.处理100m3含NaCN10.3mg/L的废水实际至少需要50molNaClO
【丰台】16.(16分)工业上用蚀刻液浸泡铜板可制备印刷电路板,产生的蚀刻废液需要回收利用。
(1)应用传统蚀刻液(HCl-FeCl3)
③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。
发生的主要化学反应有:
Fe+2Fe3+3Fe2+、Fe+Cu2+Fe2++Cu,还有、。
(用离子方程式表示)。
酸性蚀刻废液
试剂A/NaOH溶液
NaHCO3溶液
微米级Cu2O
Cu2(OH)2CO3
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如