生物制药组实训实习报告及心得体会Word下载.docx
《生物制药组实训实习报告及心得体会Word下载.docx》由会员分享,可在线阅读,更多相关《生物制药组实训实习报告及心得体会Word下载.docx(10页珍藏版)》请在冰豆网上搜索。
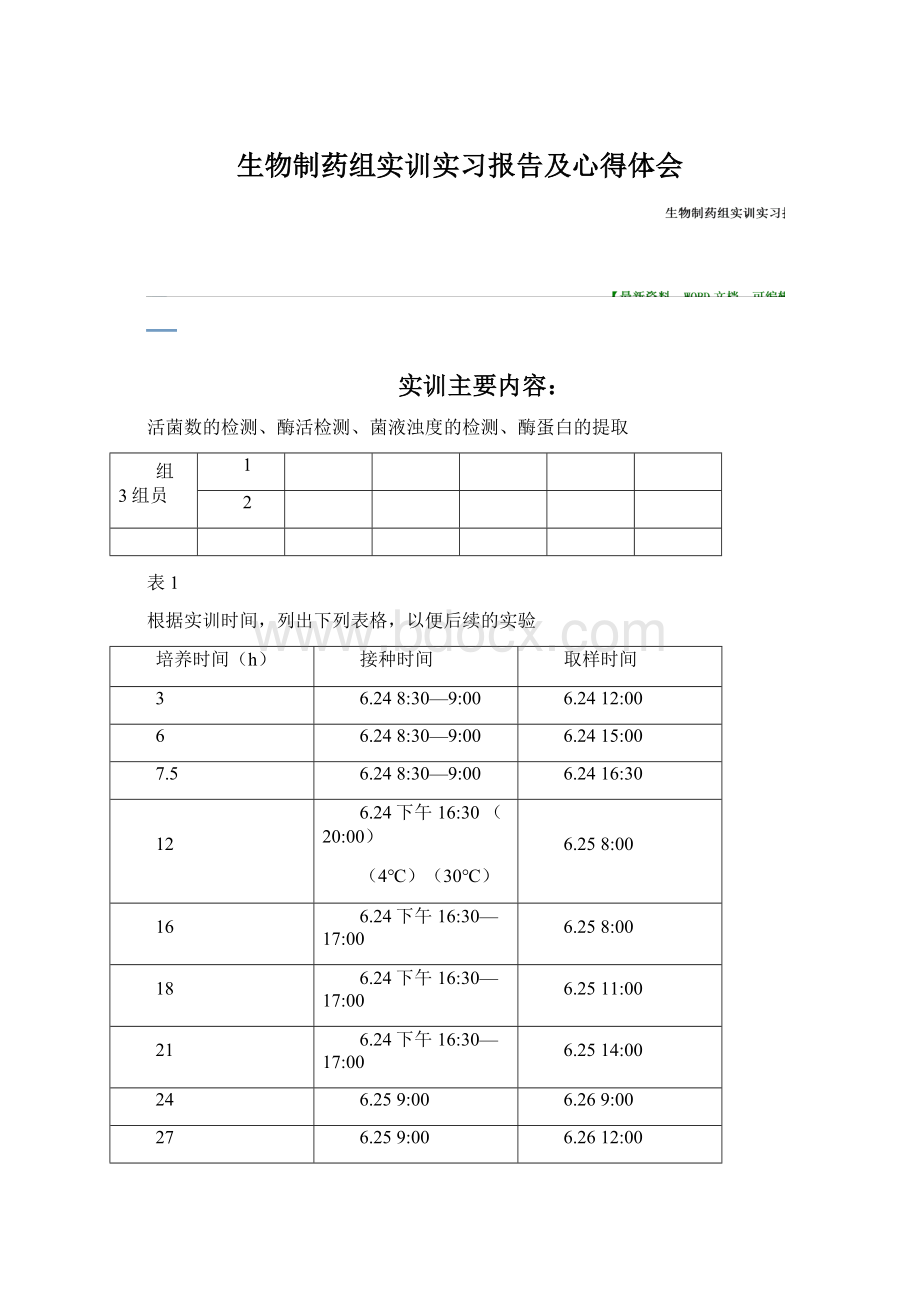
24
6.259:
6.269:
27
6.2612:
6.2615:
表格1
注:
红色标记为未检测项目。
试剂的配制、培养基的配制
试剂的配制
所配的试剂名称
所需试剂的质量或体积
0.2M醋酸钠母液200ml
3.28g
0.2M醋酸母液200ml
2.299ml
2mol/L氢氧化钠溶液500ml
40g
1%磷酸二氢钾母液250ml
2.5g
1%七水硫酸亚铁母液250ml
1%硫酸铵母液250ml
0.5%氯化钙母液250ml
1.25g
0.5%七水硫酸镁母液250ml
表格2
由于这些母液上个班配的还没用完,所以也就没再配。
培养基的配制
组3发酵培养基的配制(V总)150ml
试剂
所需(ml)/(g)
所得终浓度
1%磷酸二氢钾
15ml
0.1%磷酸二氢钾
1%七水硫酸亚铁
1.5ml
0.01%七水硫酸亚铁
0.5%氯化钙
7.5ml
0.025%氯化钙
0.5%七水硫酸镁
0.05%七水硫酸镁
1%硫酸铵
0.1%硫酸铵
可溶性淀粉
2.26g
1.5%
蛋白胨
1.52g
1%
氯化钠
0.79g
0.5%
牛肉膏
0.73g
最终培养基pH值为5.0
表格3
营养琼脂培养基的配制
所需质量
营养琼脂培养基
16g
称取营养琼脂培养基16.08g,加水定容至500ml,煮沸溶解
表格4
醋酸钠-醋酸缓冲液pH
pH
0.2M醋酸钠
0.2M醋酸
4.0
1.8ml
8.2ml
5.0
7.0ml
3.0ml
6.0
9.4ml
0.6ml
表格5
1%可溶性淀粉溶液
称取1.24g可溶性淀粉,用约15ml冷的蒸馏水充分溶解混匀,取约70ml沸腾的蒸馏水,将已经混匀的淀粉悬浮液倒入沸水中,边倒边用玻璃棒搅拌,使淀粉溶解。
冷却后,用冷的蒸馏水定容到100ml,备用。
实验前的准备
灭菌
将配好的发酵培养基分装于15个规格为100ml锥形瓶,9ml/瓶
250ml锥形瓶+150ml蒸馏水5瓶
将配好的营养琼脂培养基分装于规格为250ml锥形瓶,2瓶
置于高压蒸汽灭菌锅121℃,20min灭菌
图三1
图三2
23号菌种的培养
取23号菌种在超净工作台内进行接种,100ul/瓶,共3瓶,供后续实验菌种的来源。
置于摇床中培养30℃,100rmp/min。
图三3
图三4
固体平板培养基的制备
取灭好菌的营养琼脂培养基,在超净工作台里倒入平板中,大约15ml/个。
供后续检测活菌数使用。
图三5
图三6
注意事项:
在配制营养琼脂培养基时,要先加少量水进行溶解搅拌,再加热水进行充分溶解,最后煮沸使琼脂全部溶解,否则琼脂没有溶解就分装,灭菌后就出现上图现象,有的培养基太硬,有的太软。
实验内容及操作
接种培养
根据表2时间表进行接种培养,100ul/瓶,置于摇床30℃,100rmp/min培养。
图四1
活菌数检测
根据表2时间表进行操作,取菌液100ul+900ul无菌水于EP管中进行连续梯度稀释,然后取100ul在平板培养基上进行涂布。
放于培养箱中培养,得下表数据。
活菌数随培养时间变化表
时间(hr)
稀释倍数
菌数
平均值
108
1×
107
9×
106
9
2×
7
8.5×
1.8×
53
127
5.2×
1010
230
109
133
33
2.0×
73
6.3×
210
23
1.615×
未检测
表四1
图四2
图四3
图四4
图四5(为6h失败平板)
注意事项:
菌液稀释倍数要合理,在进行用涂布棒涂布的时候,涂布棒在酒精灯上灼烧后一定要冷却,否则会烫死菌种。
涂布要均匀,多来回涂几次,否则就成上图6h失败平板
酶活检测
计算公式:
酶活力(U)={[(A-空白)-(B-空白)-(对照-空白)]×
V标/t反应}×
D(倍数值)×
103
根据表2时间表进行对应的时间段酶活的检测,,按照下表进行操作
步骤
空白
对照
A
B
发酵液上清
0ml
100ul
H2O
醋酸钠-醋酸缓冲液
400ul
4
1ml
5
1%可溶性淀粉溶液
室温放置反应5min
5min
立即加2MNaOH
2ml
8
DNS溶液
100℃加热显色
6-8min
10
冰水冷却
3min
11
补水定容
4.5ml
540nm检测
表四2
根据上表进行操作得到以下数据
酶活力随培养时间变化
A值(平均值)
B值
酶活力
0.335
0.108
0.107
0.229
10.5
0.649
0.374
0.233
150
0.962
0.630
0.235
204
0.892
0.573
0.214
212
0.832
0.549
0.106
0.207
182
0.809
0.498
18.9
0.660
0.362
17.6
0.606
0.305
0.268
13.9
表四3
图四6
图四7
图四8
图四9
在使用仪器时,样品室使用完都要清洗,样品室的石英窗应保持清洁,样品室石英窗不应有污染。
菌液浊度检测
按照培养时间的不同对菌液稀释10倍操作是取0.5ml菌液+4.5ml水,共3只,所测结果取平均值。
对菌液稀释50倍操作是取1ml菌液+4ml水,再从中取出0.5ml+4.5ml水,即得稀释50倍,共3只,所测结果取平均值。
下表为所得数据
培养时间(hr)
菌液稀释倍数
吸光度值
菌液浊度
0.093
0.93
0.407
4.07
0.657
6.57
50
0.27
13.5
0.38
19
20.35
0.43
21.5
0.513
25.65
表四4
图四10
酶蛋白的提取
取培养菌液于离心管中,进行5000rmp,10min离心。
取上清,加入50ml冰的无水乙醇,放入4℃冰箱1h。
5000rmp,20min离心。
弃上清,加入1ml蒸馏水,混匀溶解。
改变醋酸钠-醋酸缓冲液pH进行酶活力检测,得以下数据
蛋白提取酶活力表
pH值
pH4.0
0.284
1.227
0.991
59
pH5.0
0.267
1.315
0.940
214
pH6.0
0.264
1.383
0.939
286
表四5
图四11
加入的无水乙醇一定是要冰的,不然容易使酶失活。
细菌的染色和镜检
1.滴加少量种子液于干净载玻片上,用镊子置于酒精灯上端干燥。
2.待到种子液干燥后,滴加结晶紫染液于细菌涂抹处,使其布满菌膜,染色1min,用蒸馏水洗去多余染液,甩干载玻片上的积水。
3.滴加碘液覆盖菌膜,维持1min,用蒸馏水洗去,将载玻片上的积水甩干。
4.加95%酒精加于载玻片上脱色,左右摇动使其脱色均匀,脱色时间约为30s,脱色后立即用蒸馏水冲洗干净。
5.滴加稀释复红染液于菌膜上,覆盖住菌膜,染色1min。
用蒸馏水冲洗去染液,甩去载玻片上积水。
6.待到载玻片上积水干燥后置于显微镜下观察细菌形态、颜色。
图四12
数据分析
活菌数随培养时间的变化
图五1
酶活力随培养时间的变化
图五2
分析:
在前7.5h,酶活力一直在增大,在7.5h时达到最大酶活力。
之后就开始成快速下滑阶段,在7.5h到12h之间变化不算太大,这之间应该有段时间是处于稳定期。
菌液浊度随培养时间的变化
图五3
从上表可以看出,菌液浊度随培养时间的变化在21h的时候浊度是最大的,说明此时菌数已经达到了最大极限。
之后在24h是下降趋势,可能是菌体开始死亡自溶
pH对提取的酶蛋白的变化
图五4
根据上表的折线图,酶蛋白酶活力随pH值得变大而增大,在pH4.0时酶活力最小,在pH6.0时最大,在pH4.0到pH5.0时酶活力增大的趋势比较明显,在pH5.0到pH6.0时酶活力增大不是很明显,说明这阶段pH值对酶活力影响不是很大。
实验总结
通过这次实训,我们对发酵流程有了一定的了解,由于时间的原因,我们的主要工程也放在了种子培养和摇瓶发酵上,在实训中我们分工合作,对于我们个人的动手能力也有了一定的帮助。
在实训过程中,失败在所难免,但在失败中我们学会了分析总结,分析出问题的所在,找出解决问题的办法,然后在重新进行这一步的实验。
这次实训和我们平时的实验完全不同,在平时的实验中,都是老师说一步的做一步,完全跟着老师的安排走,没有思考过每一步的原因及注意事项;
而这次的实训是完全靠自己动手,从溶液的配置开始,每一步都是我们自己独立思考,独自完成,即使有不懂的问题也是通过同学之间的讨论,查资料,最后在请教老师并与其探讨,从而寻找答案。
在本次实训中我们不仅增强了自身的动手能力,还了解到了发酵工程在平时生活中的应用,并认识到了发酵技术在生物制药技术上所扮演的角色,对于我们生物专业的学生的重要性,并清楚的意思到只要我们将会从事生物相关的工作,这些就将是我们工作的一部分,我们必须熟练的掌握它。