银川市度九年级化学第七单元第四节难度偏大尖子生题A卷Word下载.docx
《银川市度九年级化学第七单元第四节难度偏大尖子生题A卷Word下载.docx》由会员分享,可在线阅读,更多相关《银川市度九年级化学第七单元第四节难度偏大尖子生题A卷Word下载.docx(14页珍藏版)》请在冰豆网上搜索。
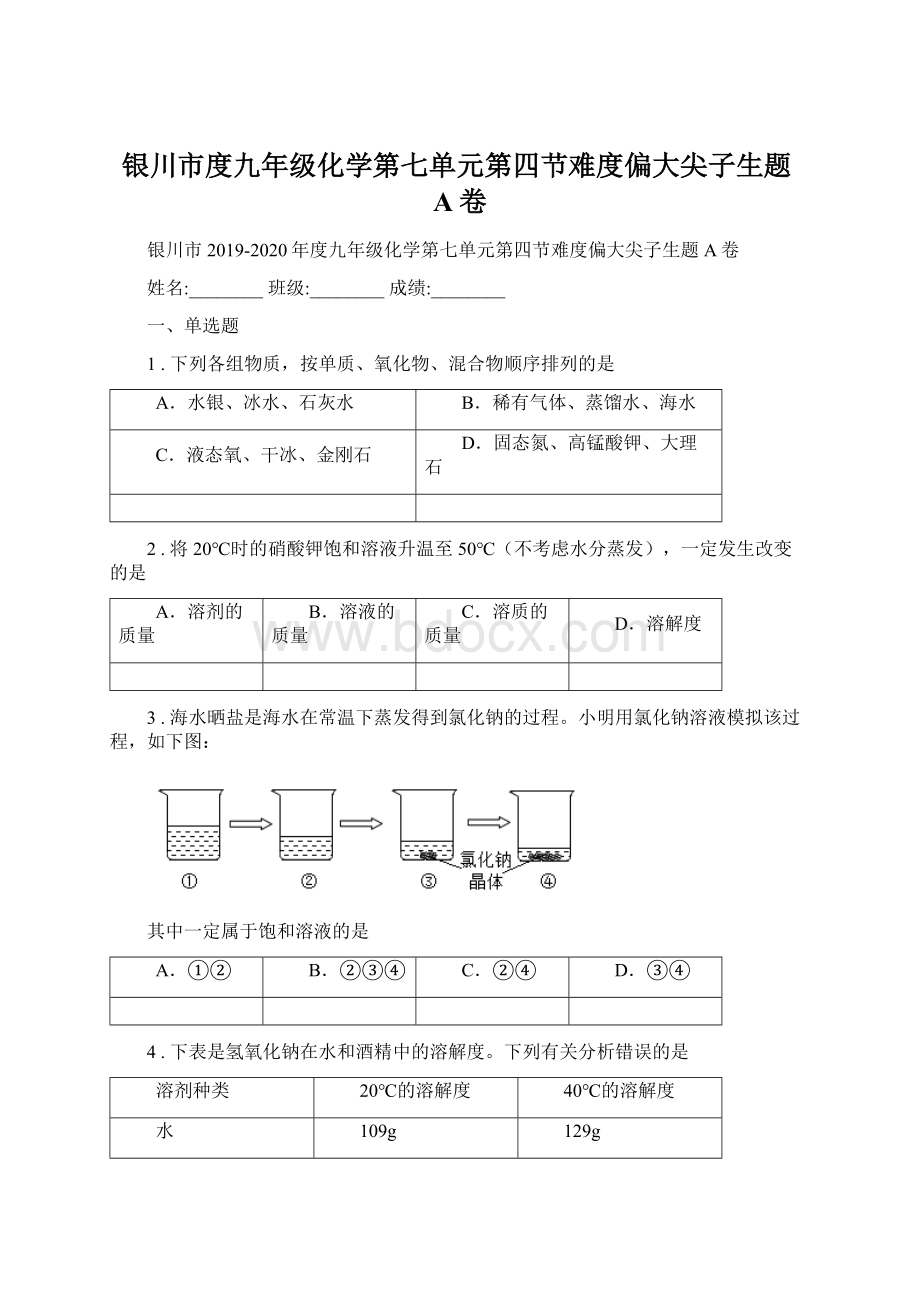
40g
A.温度和溶剂种类对氢氧化钠的溶解度都有影响
B.氢氧化钠的水溶液和氢氧化钠的酒精溶液都具有均一性和稳定性
C.40℃,40g氢氧化钠溶解在100g酒精中得到饱和溶液
D.将等质量40℃的饱和氢氧化钠的水溶液和饱和氢氧化钠的酒精溶液降温至20℃析出的晶体前者比后者多
5.夏天,小亮从冰箱储藏室(4℃)中拿出一杯内有少量蔗糖晶体的溶液M,放在室内一段时间后,发现晶体消失了,得到溶液N,下列小亮的认识正确的是()
A.4℃时,M溶液一定是饱和溶液
B.室温下,N溶液一定是饱和溶液
C.M溶液的质量大于N溶液的质量
D.M溶液的浓度大于N溶液的浓度
6.甲、乙两种固体物质的溶解度曲线如图所示。
下列有关叙述中错误的是()
A.t1℃时,甲物质的溶解度与乙物质的溶解度相等
B.升高温度可将乙物质的饱和溶液变为不饱和溶液
C.t2℃时,将130g甲的饱和溶液稀释成10%的溶液,需加入水70g
D.当甲物质中含少量乙物质时,可用降温结晶的方法提纯甲物质
7.下列关于溶液的说法,正确的是()
A.均一、稳定的液体都是溶液
B.溶液都是无色透明的
C.饱和溶液不能再溶解任何物质
D.浓溶液不一定是饱和溶液
8.硝酸铵(NH4NO3)可用于制作烟火和炸药等,其溶解度如下表。
下列说法正确的是
温度/℃
5
10
15
20
25
30
溶解度/g
122
130
140
160
190
220
250
A.硝酸铵的溶解度随温度的升高而减小
B.20℃时,50g水中最多能溶解190g硝酸铵
C.将硝酸铵饱和溶液从0℃升温至20℃时,仍为饱和溶液
D.25℃时,硝酸铵饱和溶液中溶质和溶剂的质量比为11∶5
9.下列对部分化学知识的归纳完全正确的一组是
A.化学与生活
B.化学与环境
①生活中常用加热煮沸的方法软化硬水
②用燃烧的方法区分羊毛和涤纶
③利用洗洁精的乳化作用去除油污
①焚烧植物秸秆不会造成空气污染
②PM2.5是造成雾霾天气的原因之一
③含磷洗涤剂的使用会导致水污染
C.化学与安全
D.化学与健康
①炒菜油锅着火可以用锅盖盖灭
②在室内放一盆水,可防止煤气中毒
③夜间发现液化气泄漏开灯寻找泄漏源
①人体缺铁会引起贫血
②用甲醛的水溶液浸泡海产品保鲜
③食用蔬菜和水果来补充维生素
A.A
B.B
C.C
D.D
10.下列现象不属于乳化现象在生活中的应用的是()
A.用洗洁精洗去碗盆上沾染的油污
B.用洗衣粉清洗就餐时不小心沾染的油污
C.用酒精洗去衣服上沾染的圆珠笔油
D.各种日常洗涤剂、化妆品的配制
11.某同学对下表中的溶解度数据分析后,得出的结论错误的是()
40
60
氢氧化钙的溶解度/g
0.18
0.16
0.14
0.11
硝酸钾的溶解度/g
13.3
31.6
61.9
110
氯化钠的溶解度/g
35.7
36
36.6
37.2
A.升温可将20℃时不饱和的Ca(OH)2溶液变为饱和溶液
B.60℃,饱和KNO3溶液的质量分数约为52.4%
C.温度变化对NaCl的溶解度影响较小
D.NaCl的溶解度大于KNO3的溶解度
12.化学实验中常常出现“1+l=2”或“l+l≠2”的有趣现象。
下列符合“l+l=2”的事实是
A.常温下,1L水与1L酒精混合后的体积等于2L
B.室温下,1g镁与1g稀硫酸充分反应后所得的溶液质量为2g
C.室温下,1g硫粉在lg氧气中完全燃烧后生成2g二氧化硫
D.20℃,lg氯化钠饱和溶液中加入1g氯化钠固体能得到2g氯化钠溶液
13.甲是60℃的蔗糖溶液,按如图所示进行操作。
下列分析不正确的是
A.丙溶液的溶质质量分数大于丁
B.乙溶液的溶质质量分数大于甲
C.蔗糖的溶解度随温度升高而增大
D.丁溶液一定是室温时蔗糖的饱和溶液
14.下列图像关系合理的是()
A.
向pH=9的NaOH溶液中不断加水
B.
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
C.
在饱和的KNO3溶液中加入KNO3晶体
D.
电解水生成氢气和氧气的质量
15.20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。
记录数据如下表:
实验小组
第一组
第二组
第三组
第四组
水的质量/g
50
所取NaCl的质量/g
剩余NaCl的质量/g
2
7
12
下列说法错误的是
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9:
D.相同温度下,NaCl在水里的溶解度与水的质量无关
16.含有碳酸钠的湖泊在冬季结冰时,湖底常有碳酸钠晶体析出,这是因为()
A.碳酸钠难溶于水
B.碳酸钠的溶解度随温度升高而增大
C.碳酸钠的溶解度随温度升高而减少
D.温度变化对碳酸钠的溶解度影响不大
17.关于溶液的说法正确的是
A.溶液都是无色透明的混合物
B.溶液中的溶质可以是气态、液态、固态
C.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液
D.均一稳定的液体就是溶液
18.t℃时,向硝酸钾饱和溶液中加入一定量的水后,下列有关叙述正确的是()
A.仍为饱和溶液
B.溶质的质量变小
C.溶质的溶解度不变
D.溶液的质量不变
19.下列有关饱和溶液与不饱和溶液的叙述中,正确的是()
A.在一定量的溶剂里,不能再溶解溶质的溶液为该溶质的饱和溶液
B.某物质的饱和溶液一定是浓溶液
C.饱和溶液和不饱和溶液之间可以互相转化
D.任何饱和溶液升温后都会变成不饱和溶液
20.20℃时,某物质溶解于水的实验数据如下表。
则下列叙述正确的是()
A.②中所得溶液是饱和溶液
B.20℃时10g水最多能溶解4g该物质
C.③④溶液的溶质质量分数相等
D.①所得溶液的溶质质量分数为20%
二、填空题
21.图为a、b、c三种物质的溶解度曲线,据图回答:
(1)t2℃时a的溶解度是_____,该温度下a物质的饱和溶液中溶质的质量分数是_____。
(2)P点的含义是_____
(3)t2℃时将a物质40g加入到50g水中充分搅拌,形成溶液的质量是_____g.
(4)t2℃时,a物质饱和溶液中,溶质、溶剂、溶液的质量之比为_____(填最简比).
(5)当温度发生变化时,a、b两物质溶解度变化最明显的是_____物质,该物质宜采用_____结晶的方法从其溶液中分离。
若b中含有少量a,要提纯b,应用_____法。
(6)某温度下c物质的不饱和溶液转变为饱和溶液,可采用的方法是_____、_____、_____。
(7)t2℃时,a、b、c三种物质的饱和溶液各100g,分别降温到t1℃时,析出晶体最多的是_____,没有晶体析出的是_____。
22.甲、乙、丙三种固体(均不含结晶水)的溶解度曲线如图所示,请回答下列问题:
(1)t2℃时,甲、乙、丙三种物质溶解度大小关系是____
(2)t3℃时,将20g物质丙加入50g水中充分溶解,所得溶液的质量为_____g.
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是_____
(4)下列说法正确的是_____
A
甲中混有少量乙时,可用降温结晶的方法提纯甲;
B
t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等;
C
将t3℃时的甲、丙的饱和溶液降低温度至t2℃,溶质的质量分数相等;
D
t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>
甲>
丙。
23.化学与生活息息相关,请你从所学化学知识回答下列生活中常见的问题。
(1)自来水作为生活用水,加入肥皂水后产生的泡沫较多,此井水是_______填“硬水或“软水”);
(2)在农村烧锅做饭时引燃枯枝后,如果迅速往“灶”里塞满枯枝,结果反而燃烧不旺并产生很多浓烟,说明物质充分燃烧需要的条件是__________________;
(3)碘酒是家庭常备药,碘酒中的溶剂是_____________;
(4)使用手机通话时,锂电池此时的能量转化是_____________________。
24.如图是A、B、C三种物质的溶解度曲线图,请看图回答问题:
(1)20℃时,A、B、C三种物质的溶解度由小到大的顺序是_________;
(2)50℃时,将30gA物质放入50g水中,充分溶解,所得溶液为_________(填“饱和”或“不饱和”)溶液,此时溶液中溶质质量分数为_________;
(精确到0.1%)
(3)使一定量接近饱和的C物质溶液变成饱和溶液,采用的一种方法是_________.
25.向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。
(1)烧杯中的溶液一定属于饱和溶液的是
(填序号);
(2)请写出图二中A点的表示意义
;
图二能表示NaNO3溶解度曲线的是
(填“甲”或“乙”);
(3)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的
(填序号,可多选)。
A.甲、乙都是饱和溶液
B.溶剂质量:
甲﹤乙
C.溶质质量分数:
乙
(4)欲除去混在甲中的少量乙物质可采用的方法是
(填“降温结晶”或“蒸发结晶”);
26.
(1)如图所示,氯化铵和硝酸钾溶解度曲线.
①60℃时,硝酸钾的溶解度_____氯化铵的溶解度(填“>”、“<”、或“=”)。
②____________℃时,氯化铵饱和溶液与硝酸钾饱和溶液的溶质质量分数相等。
③60℃时,100g水中加入120g硝酸钾,充分搅拌,得到的硝酸钾溶液的质量为_____________g。
(2)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量.测定结果记录如下表。
溶液的温度/℃
75
65
35
析出固体M的质量/g
2.0
4.5
8.4
若不考虑水蒸发对实验的影响,请回答下列问题。
①65℃时,该溶液是否为饱和溶液?
_____________(填“是”、“否”或“无法判断”);
②将40℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的有_____)。
a.升温;
b.降温;
c.加溶质M;
d.加水;
e.加另一种固体N;
f.恒温蒸发水;
g.与40℃时M的饱和溶液混合。
27.(3分)粗盐中除NaCl外还含有MgSO4以及泥沙等杂质。
工业上初步提纯粗盐的实验流程如下:
(1)“滤渣”是粗盐中含有的
。
(2)实验过程中四次用到玻璃棒,分别是:
第一次:
溶解时搅拌;
第二次:
第三次:
蒸发时搅拌;
第四次:
将精盐从蒸发皿转移出来。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参考溶解度曲线图分析其原因为
28.“吃加碘盐能防核辐射”没有科学根据。
食盐加碘是用来增加人体对碘的摄入量,防止缺碘引起的疾病。
右图为某加碘盐的部分标签,根据所学知识回答下列问题:
(1)成年人缺碘会引起
(2)碘酸钾的化学式为KIO3,其中碘元素的化合价为
(3)从“储存方法”和“食用方法”推测,并参照下列溶解度,要从碘酸钾溶液中得到碘酸钾晶体,你建议的方法是
,
(4)根据标签信息计算,加碘盐中碘酸钾的含量最多为
mg/kg(保留到小数点后一位)。
(5)工业上生产碘酸钾的过程中,有一步反应时KH(IO3)2与KOH反应得到碘酸钾,该反应的化学方程式为
29.溶液在生命活动和生产、生活中都起到十分重要的作用。
(1)将少量下面的调味品加入水中,不能形成溶液的是____。
A食盐
B蔗糖
C味精
D芝麻油
(2)碘酒中的溶质为____,溶剂为____。
(写出物质化学式)
(3)在一定温度下,向质量均为50g的4份水中分别加入一定量的KNO3固体,搅拌至充分溶解,(如有不溶的KNO3固体用过滤的方法除去),得到溶液。
加入KNO3固体的质量与所得溶液的质量如下表:
实验编号
a
b
c
d
加入KNO3固体的质量
45
55
所得溶液的质量
95
100
105
①实验a、b、c、d中,有未被溶解的KNO3固体析出的实验是____(填写实验编号)。
②该温度下KNO3的溶解度是____g。
③实验a、b、c、d所得溶液中质量分数大小关系为:
____。
④取实验b所得溶液,若使其质量分数变为20%,在不改变温度的情况下,应加入水的质量为____g。
(4)在硝酸亚铁和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,有气泡产生,则滤出的固体可能有____(填名称),滤液中可能含有的溶质____(填化学式)。
三、计算题
30.已知20°
C时Ca(OH)2的溶解度为0.165g,现有20°
C时含有7.4g溶质的饱和澄清石灰水。
请计算:
(1)上述澄清石灰水的质量为____________g(精确到1g)。
(2)向上述澄清石灰水中通入CO2,沉淀的质量达到最大值时,通入CO2的质量为多少?
____(写出计算过程)
(3)已知:
,Ca(HCO3)2易溶于水。
请在图中画出通入CO2过程中沉淀质量的变化曲线_____。
(4)另取一定量的饱和澄清石灰水,通入一段时间的CO2,反应物与生成物的质量如下表
物质
Ca(OH)2
CO2
CaCO3
X
H2O
质量/g
14.8
13.2
1.8
则a=______________;
反应的化学方程式为______________________________。