版高考化学二轮训练题 专题限时集训16 实验方案的设计与评价 Word版含答案文档格式.docx
《版高考化学二轮训练题 专题限时集训16 实验方案的设计与评价 Word版含答案文档格式.docx》由会员分享,可在线阅读,更多相关《版高考化学二轮训练题 专题限时集训16 实验方案的设计与评价 Word版含答案文档格式.docx(10页珍藏版)》请在冰豆网上搜索。
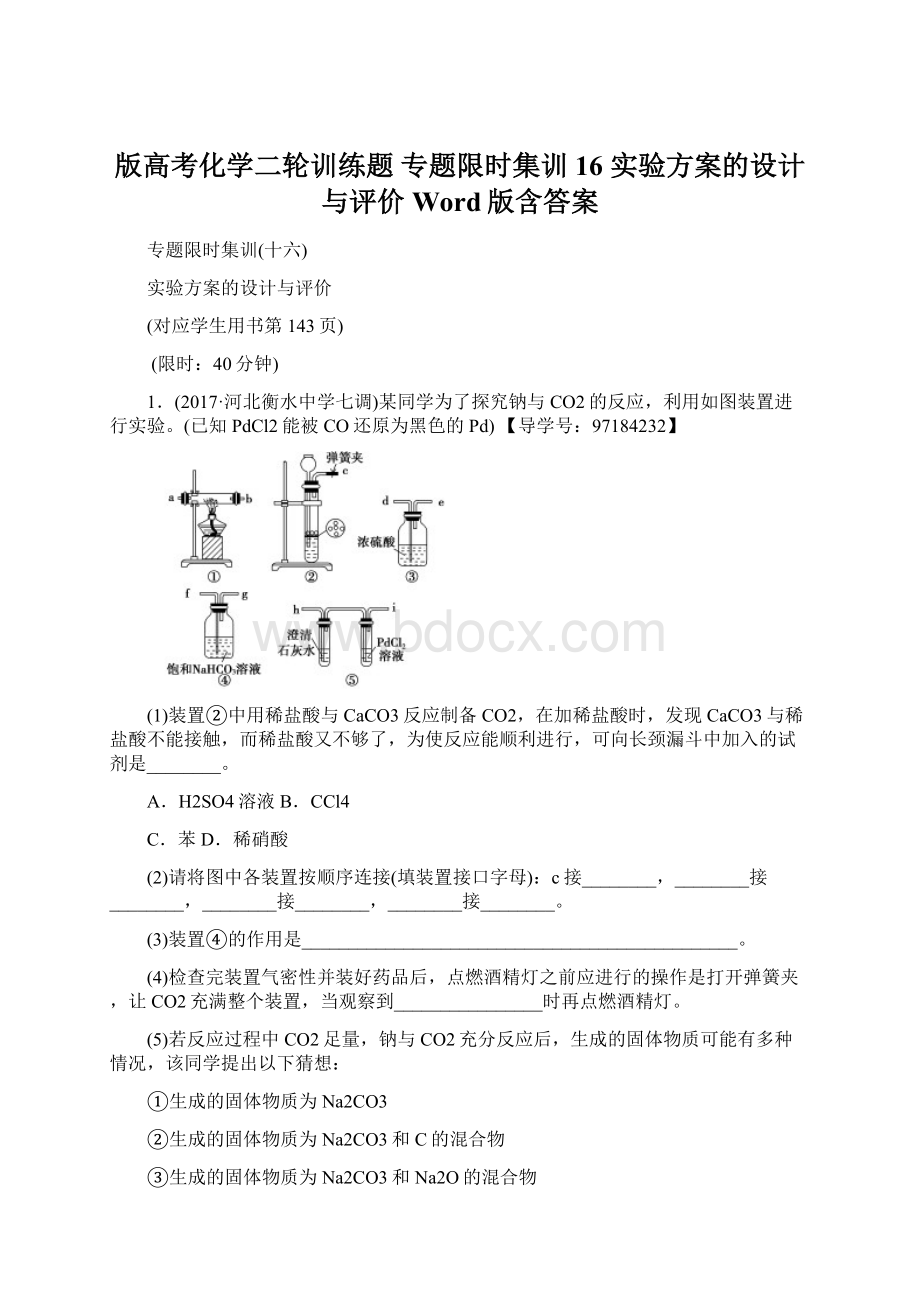
_______________________________________________________________。
Ⅱ.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入足量的稀盐酸中产生224mL(标准状况)CO2气体,溶液中残留固体的质量为_____。
(6)设计实验方案证明装置①中加入的金属钠部分被氧化________________
________________________________________________________________。
【解析】
(1)加入的液体若不与CaCO3反应时,其密度应比稀盐酸大,CCl4符合;
也可以加入与CaCO3反应生成CO2的液体,如稀硝酸。
(2)装置②制取的CO2中含有HCl和水蒸气,可以用④装置除去HCl,装置③干燥气体,装置①中CO2与Na反应,装置⑤可以检验CO2与Na反应的产物,故c接f,g接d,e接a(或b),b(或a)接h。
(3)装置④的作用是吸收HCl气体。
(4)当装置⑤中澄清石灰水变浑浊时,说明整个装置充满CO2。
(5)Ⅰ.根据题中信息可知,装置①中固体为Na2CO3,⑤中PbCl2溶液中生成黑色沉淀,说明装置①中生成CO气体,可以写出2Na+2CO2
Na2CO3+CO。
Ⅱ.装置①中固体与足量稀盐酸反应有残留固体,则该固体只能是碳,说明Na与CO2反应生成Na2CO3和C。
装置①中n(Na)=
=0.02mol,装置①中固体与足量稀盐酸反应生成n(CO2)=
=0.01mol,则反应生成Na2CO3为n(Na2CO3)=0.01mol,说明Na完全转化为Na2CO3,可以写出反应方程式为4Na+3CO2
2Na2CO3+C,则生成的C为0.005mol,其质量为0.06g。
(6)准确称取0.46g金属钠样品,并投入足量水中,测得生成气体的体积小于224mL(标准状况下测量),则可以说明装置①中的金属钠被部分氧化。
【答案】
(1)BD
(2)f g d e a(或b) b(或a) h
(3)吸收HCl气体
(4)装置⑤中澄清石灰水开始变浑浊
(5)Ⅰ.2Na+2CO2
Na2CO3+CO
Ⅱ.0.06g
(6)准确称取0.46g金属钠样品,并投入足量水中,测得收集到的气体体积小于224mL(标准状况下测量)(或其他合理答案)
2.(2017·
江西百校联盟五月质检)某研究性学习小组用下列装置(铁架台等夹持仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
【导学号:
97184233】
(1)用2%的CuSO4溶液和10%的NaOH溶液配制Cu(OH)2悬浊液的注意事项是________________________________________________________________
(2)为快速得到乙醇气体,可采用的方法是__________________________。
若实验时小试管中的溶液刚开始发生倒吸,可采取的措施是________(填字母)。
a.取下小试管
b.移去酒精灯
c.将导管从橡胶管中取下
d.以上都可以
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体M,充分反应后停止加热。
取下小试管加热,有砖红色固体生成。
为了检验固体M的组成,进行下列实验。
①固体M能被磁铁吸引;
加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成。
②经检验溶液中有Fe3+和Fe2+,检验Fe3+的试剂是________;
证明溶液含有Fe2+的试剂是________。
能得出的结论是________(填字母)。
a.固体M中一定有+3价和+2价铁,不能确定是否有0价铁
b.固体M中一定有+3价和0价铁,无+2价铁
c.固体M中一定有+3价铁,0价和+2价铁至少有一种
d.固体M中一定有+3价、+2价和0价铁
(4)若固体M的成分可表示为FexOy,用CO还原法定量测定其化学组成。
称取mg固体M样品进行定量测定,实验装置和步骤如下:
①组装仪器;
②点燃酒精灯;
③加入试剂;
④打开分液漏斗活塞;
⑤检查气密性;
⑥停止加热;
⑦关闭分液漏斗活塞;
⑧……
正确的操作顺序是________(填字母)。
a.①⑤④③②⑥⑦⑧B.①⑤③④②⑥⑦⑧
c.①③⑤④②⑦⑥⑧D.①③⑤②④⑥⑦⑧
【解析】
(1)配制Cu(OH)2悬浊液时,NaOH溶液应稍过量。
(2)升高温度可以加速乙醇的挥发。
若小试管中的溶液刚开始发生倒吸,可将导管从橡胶管中取下,选c。
(3)乙醇与Fe2O3反应的过程中可能会生成Fe或Fe3O4,由②知溶液中有Fe3+、Fe2+,故固体M中一定有+3价和+2价铁,不能确定是否有0价铁,选a。
(4)检查气密性属于实验的准备阶段,应在加药品前进行,为防止Fe再次被氧化,撤去酒精灯后,应继续通入CO,冷却后再停止通气。
【答案】
(1)NaOH溶液稍过量
(2)在烧杯中加入热水(或对烧杯加热) c
(3)②KSCN溶液 酸性高锰酸钾溶液或K3[Fe(CN)6]溶液 a
(4)b
3.(2017·
辽宁鞍山一中一模)某高校老师要求学生配制0.1mol/L的KMnO4溶液100mL。
完成下列实验。
[实验一] 研究温度对反应速率的影响,学生取两支试管,均加入4mL0.1mol/L的酸性KMnO4溶液和10mL0.1mol/LH2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
要用________来酸化KMnO4溶液,褪色所需时间tA________tB(填“>
”“=”或“<
”)。
写出此反应的离子方程式:
___________________________________。
[实验二] 测定某乙二酸溶液的浓度,具体操作为:
(1)滴定:
准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将KMnO4溶液装入________(填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。
将锥形瓶摇动一段时间后,紫红色慢慢消失;
继续滴加时,紫红色就很快褪去了。
请解释原因:
___________________________________________________。
待到___________________________________________________________,
证明达到滴定终点。
(2)计算:
重复上述操作2次,记录实验数据如下。
序号
滴定前读数/mL
滴定后读数/mL
1
0.00
20.10
2
1.00
20.90
3
22.10
则此乙二酸溶液的浓度为________。
(3)误差分析:
下列操作会导致测定的乙二酸溶液浓度偏大的是________(填序号)。
A.配制KMnO4溶液定容时,仰视观察刻度线
B.未用待测液乙二酸润洗滴定管
C.滴定前锥形瓶有少量水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.滴定时振荡锥形瓶有溶液飞溅出去
F.观察读数时,滴定前仰视,滴定后俯视
【解析】 [实验一]酸化KMnO4溶液一般选用稀硫酸。
温度越高,反应速率越快,溶液褪色所需时间越短,所以tA<
tB,反应的离子方程式为2MnO
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。
[实验二]
(1)酸性KMnO4溶液具有强氧化性,会腐蚀橡胶,应该选用酸式滴定管盛放。
继续滴加时,紫红色就很快褪去了,可能是反应中生成的Mn2+具有催化作用,所以随后褪色会加快;
当滴入最后一滴KMnO4溶液,锥形瓶内的颜色恰好变成浅红色,且半分钟内不变化,证明达到滴定终点。
(2)三次滴定的数据中第3组偏差较大,舍去,消耗KMnO4溶液的平均体积为
=20.00mL,根据离子方程式2MnO
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,乙二酸溶液的浓度为
=0.2mol/L。
(3)A项,配制KMnO4溶液定容时,仰视观察刻度线,导致溶液体积偏大,浓度偏小,滴定时消耗KMnO4溶液体积偏大,根据c(待测)=
,测得的乙二酸溶液浓度偏大,符合;
B项,未用待测液乙二酸润洗滴定管,造成乙二酸浓度偏小,不符合;
C项,滴定前锥形瓶有少量水,对实验结果无影响,不符合;
D项,滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,导致消耗KMnO4溶液体积偏大,根据c(待测)=
E项,滴定时振荡锥形瓶有溶液飞溅出去,导致消耗KMnO4溶液体积偏小,根据c(待测)=
,测得的乙二酸溶液浓度偏小,不符合;
F项,观察读数时,滴定前仰视,滴定后俯视,导致读取的消耗KMnO4溶液体积偏小,根据c(待测)=
,测得的乙二酸溶液浓度偏小,不符合。
【答案】 [实验一]硫酸 <
2MnO
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
[实验二]
(1)酸式 反应中生成的Mn2+具有催化作用,所以随后褪色会加快 滴入最后一滴KMnO4溶液,锥形瓶内的颜色恰好变成浅红色,且半分钟内不变化
(2)0.2mol/L (3)AD
4.(2017·
江西九校联考)2017年1月9日,中国中医科学院青蒿素专家屠呦呦研究员获得2016年度国家科学技术奖最高奖。
青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。
已知:
乙醚沸点为35℃。
从青蒿中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。
乙醚浸取法的主要工艺为:
请回答下列问题:
【导学号:
97184234】
(1)操作Ⅱ的名称是________________________________________________。
(2)操作Ⅲ的主要过程可能是________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
①装置D的作用是______________________________________________,
装置E中吸收的物质是________,装置F中盛放的物质是________。
②实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_________________________________________________________________
③用合理改进后的装置进行实验,称得:
装置
实验前/g
实验后/g
E
22.6
42.4
F
80.2
146.2
则测得青蒿素的实验式是__________________________________________。
(4)某学生对青蒿素的性质进行探究。
将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与________(填字母)具有相同的性质。
A.乙醇B.乙酸
C.乙酸乙酯D.葡萄糖
【解析】
(2)青蒿素在水中几乎不溶,A项错误;
获得的精品应是固体,C项错误。
(3)青蒿素分子式的测定原理为,燃烧一定质量的青蒿素样品,使其完全转化为CO2和H2O,然后测量CO2和H2O的质量,据此求出样品中C、H、O三种元素的质量,进而可确定青蒿素的实验式(最简式),若已知青蒿素的相对分子质量,则可确定其分子式。
②测定的含氧量偏低是由于外界空气中的CO2和水蒸气进入装置F中引起测定的含碳量偏高而造成的,因此改进方法是在装置F后再连接一个防止空气中CO2和水蒸气进入F的装置(如盛有碱石灰的干燥管)。
③由实验数据可知,m(H2O)=42.4g-22.6g=19.8g,m(CO2)=146.2g-80.2g=66g,则n(H2O)=1.1mol,n(CO2)=1.5mol,n(H)=2.2mol,n(C)=1.5mol,m(H)=2.2g,m(C)=18.0g,m(O)=m(样品)-m(C)-m(H)=28.2g-18.0g-2.2g=8.0g,n(O)=0.5mol,所以n(C)∶n(H)∶n(O)=1.5∶2.2∶0.5=15∶22∶5,即青蒿素的实验式是C15H22O5。
【答案】
(1)蒸馏
(2)B
(3)①将可能生成的CO氧化为CO2 H2O(水蒸气) 碱石灰 ②在装置F后连接一个防止空气中的CO2和水蒸气进入F的装置 ③C15H22O5
(4)C
5.某校化学课外学习小组在实验探究中发现将镁粉投入氯化铵溶液中,两者立即发生反应,产生大量气泡。
经检验该过程产生两种气体,其中一种气体有刺激性气味。
97184235】
(1)请你根据所学的知识分析生成的气体可能为______和________(填化学式)。
(2)①请你设计简单的实验方案检验上述实验中有刺激性气味的气体:
_________________________________________________________________
②实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是___________________________________________
③实验中0.2mol·
L-1氯化铵溶液的pH为5.90,请用离子方程式解释原因:
(3)该小组同学对实验中产生这两种气体的原因进行了假设,请你完成下面的假设。
假设一:
_______________________________________________________。
假设二:
是氯化铵溶液中的铵根离子造成的。
实验探究选用了三种溶液:
氯化铵溶液、盐酸溶液、醋酸铵溶液。
这三种溶液分别和镁粉进行反应,实验过程、现象和实验图像记录在下面的表格中。
实验过程
实验现象
实验图像
实验一:
镁与0.2mol·
L-1氯化铵溶液反应
反应明显,有气泡产生
实验二:
镁与一定浓度的盐酸反应
反应不明显,几乎没有气泡产生
—
实验三:
L-1醋酸铵溶液反应
实验结果分析:
①上述探究实验二选用的盐酸为________(填字母)。
a.1mol·
L-1B.pH=1.0
c.0.2mol·
L-1D.pH=5.90
②通过上述探究实验对比,你能从中得出什么合理性的结论?
【解析】
(1)将金属镁粉投入氯化铵溶液中,根据元素守恒和题给信息,可以推测生成的气体为氢气和氨气。
(2)①有刺激性气味的气体是氨气,检验氨气可用两种方法:
一是将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝则有氨气生成,否则没有氨气生成;
二是用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气。
②根据影响水电离的因素分析,气温低于常温时,水的电离程度低于常温下水的电离程度,Kw小于1×
10-14,故纯水的pH会比7略大。
③0.2mol·
L-1氯化铵溶液水解显弱酸性。
(3)对于金属镁粉可以和氯化铵溶液反应产生这两种气体,猜测应与溶液中的氢离子、铵根离子有关,设计实验时,应分别选择和0.2mol·
L-1氯化铵溶液具有相同浓度氢离子的盐酸和具有相同浓度铵根离子的醋酸铵溶液进行对比探究,最后得出结论:
实验现象主要和溶液中的铵根离子有关系。
【答案】
(1)H2 NH3
(2)①将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝,则有氨气生成,否则没有氨气生成(或者用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气,答案合理即可) ②因为气温低于25℃时,Kw小于1.0×
10-14,纯水的pH略大于7 ③NH
+H2O
NH3·
H2O+H+ (3)是氯化铵溶液中的氢离子造成的 ①d ②pH相同的盐酸与镁粉几乎不反应,说明不是氢离子的作用;
而同浓度且呈中性的醋酸铵与镁粉反应,说明主要是铵根离子的作用(其他合理答案也可)