完整版高考总复习等效平衡Word文件下载.docx
《完整版高考总复习等效平衡Word文件下载.docx》由会员分享,可在线阅读,更多相关《完整版高考总复习等效平衡Word文件下载.docx(15页珍藏版)》请在冰豆网上搜索。
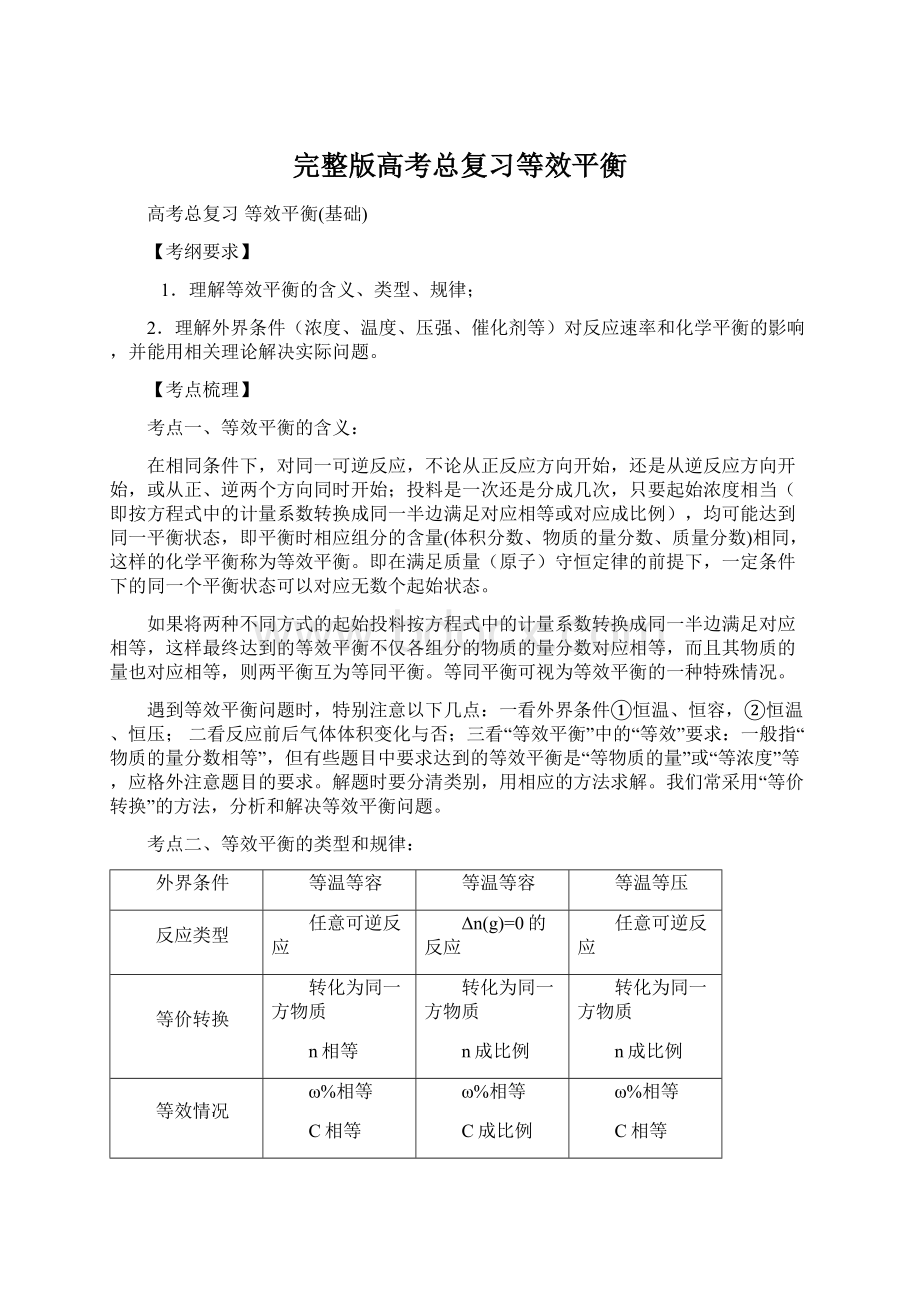
n表示各物质的物质的量、ω%表示质量分数、C表示物质的量浓度、Δn(g)=0表示反应前后气体的总物质的量不变
要点诠释:
等效平衡的解题方法与技巧是:
明确等效平衡的种类:
一是恒温恒容下的等效平衡,它再细分成二种情况,①是反应前后气体的体积不相等的的反应,只要按照化学计量数换算到一边即“一边倒”,与原平衡的初始量相同,则建立的平衡与原平衡视为等效;
②是反应前后气体的体积相等,只要按照化学计量数换算到一边即“一边倒”,与原平衡物质的初始量的比值相同,则建立的平衡与原平衡视为等效。
二是恒容恒压(容器的体积可变)条件下,只要按照化学计量数换算到一边即“一边倒”,与原平衡的初始量的比值相同,则建立的平衡与原平衡视为等效。
考点三、实例分析:
等效平衡的分类和规律
1、对反应前后气体体积不等的反应:
(g)+3
(g)
2
转换
条件
浓度
含量
物质的量
质量分数
对应相等
定T定V
相等
定T定P
对应
成比例
不相等
2、对反应前后气体体积相等的反应:
H2(g)+I2(g)
2HI(g)
【典型例题】
类型一:
恒温恒容下,对于反应前后气体体积发生变化的反应来说(即△V≠0的体系):
等价转化后,对应各物质起始投料的物质的量与原平衡起始态相同,则两平衡等效。
例1、在一定温度下,把2molSO2和1molO2通入一定容积的密闭容器中,发生如下反应,
,当此反应进行到一定程度时反应混合物就处于化学平衡状态。
现在该容器中维持温度不变,令a、b、c分别代表初始时加入的
的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。
请填空:
(1)若a=0,b=0,则c=___________。
(2)若a=0.5,则b=___________,c=___________。
【答案】
(1)故c=2。
(2)b=0.25,c=1.5。
【解析】该反应是一个化学反应前后气体分子数减小的可逆反应,在定温、定容下建立的同一化学平衡状态。
(1)若a=0,b=0,这说明反应是从逆反应开始,通过化学方程式
可以看出,反应从2molSO3开始,通过反应的化学计量数之比换算成
和
的物质的量(即等价转换),恰好跟反应从2molSO2和1molO2的混合物开始是等效的,故c=2。
(2)由于a=0.5<
2,这表示反应从正、逆反应同时开始,通过化学方程式
可以看出,要使0.5molSO2反应需要同时加入0.25molO2才能进行,通过反应的化学计量数之比换算成SO3的物质的量(即等价转换)与0.5molSO3是等效的,这时若再加入1.5molSO3就与起始时加入2molSO3是等效的,通过等价转换可知也与起始时加入2molSO2和1molO2是等效的。
故b=0.25,c=1.5。
【总结升华】这是一个“等效平衡”题。
首先判断等效平衡的类型为等温等容下的等效平衡,平衡等效的条件是“反应物的投料相当”。
投料相当如何体现在具体的物质当中呢?
我们可以采用“一边倒”的极限法。
凡能与起始时反应物2molSO2和1molO2相同的,都可保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。
举一反三:
【变式1】在1L密闭容器中通入2molNH3,在一定温度下发生下列反应:
2NH3
N2+3H2,达到平衡时容器内N2的百分含量为a%,若维持容器的体积和温度不变,分别通入下列几组物质,达平衡时,容器内N2的百分含量也为a%的是
A.3molH2和1molN2B.2molNH3和1molN2
C.2molN2和3molH2D.0.1molNH3,0.95molN2和2.85molH2
【答案】A、D。
【解析】根据方程式2NH3
N2+3H2,采用“一边倒”的极限法分析:
A.将3molH2和1molN2完全转化为NH3,生成NH32mol与起始时反应物2molNH3相同;
B.2molNH3和1molN2,比起始时2molNH3多了1molN2;
C.将3molH2和2molN2转化为NH3时生成NH32mol,同时余1molN2,比起始时2molNH3多了1molN2;
D.将0.95molN2和2.85molH2完全转化为NH3时生成NH31.9mol,再加上加入的0.1molNH3,共为2molNH3,与起始时2molNH3相同。
故本题正确答案为A、D。
【变式2】在一固定容积的密闭容器中,加入mmolA和nmolB,发生下列反应:
mA(g)+nB(g)
pC(g),平衡时C的浓度为wmol/L。
若维持容器体积和温度不变,起始时放入amolA、bmolB、cmolC,要使平衡后C的浓度仍为wmol/L,则a、b、c必须满足的关系是
【答案】BC
【解析】本题要达等效平衡,需满足:
根据方程式系数将起始量采用一边倒法归到同一半边后(左边或右边),对应各物质起始投料的物质的量与原平衡起始态相同。
类型二:
恒温恒容下,对于反应前后气体体积没有变化的反应来说(即△V=0的体系):
等价转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。
例2、在一个固定容积的密闭容器中,保持一定的温度进行以下反应:
已知加入1molH2和2molBr2时,达到平衡后生成amolHBr(见下表已知项),在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①~③的状态,填写下表中的空白。
【解析】在定温、定容下,
建立起化学平衡状态,从化学方程式可以看出,这是一个化学反应前后气体分子数相等的可逆反应。
根据“等价转换”法,通过反应的化学计量数之比换算成同一边物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
①因为标准项中n(
起始):
n(
n(HBr平衡)=1:
2:
a,将n(H2起始)=2mol,n(Br2起始)=4mol,代入上式得n(HBr平衡)=2a。
②参照标准项可知,n(HBr平衡)=0.5amol,需要n(H2起始)=0.5mol,n(Br2起始)=1mol,n(HBr起始)=0mol。
而现在的起始状态,已有1molHBr,通过等价转换以后,就相当于起始时有0.5molH2和0.5molBr2的混合物,为使n(H2起始):
n(Br2起始)=1:
2,则需要再加入0.5molBr2就可以达到了。
故起始时H2和Br2的物质的量应为0mol和0.5mol。
③设起始时HBr的物质的量为xmol,转换成H2和Br2后,则H2和Br2的总量分别为(
)mol和(
)mol,根据
,解得
。
设平衡时HBr的物质的量为ymol,则有
【变式1】
(2015人大附中)已知H2(g)+I2(g)
2HI(g)△H<
0。
有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡。
欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是:
A.甲、乙提高相同温度B.甲中加入0.1molHe,乙不改变
C.甲降低温度,乙不变D.甲增加0.1molH2,乙增加0.1molI2
【答案】C
【解析】甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡后,二者的平衡状态是相同的。
欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,须使甲中的平衡向右移动。
A中再次平衡后,二者浓度仍相等;
B中恒容加入He,平衡不移动;
C中降低温度,平衡向右移动,可使甲中HI的平衡浓度大于乙中HI的平衡浓度;
D中,甲增加0.1molH2,乙增加0.1molI2,二者效果相同。
【变式2】在一定温度下,一定体积的密闭容器中有如下平衡:
H2(g)+I2(g)
2HI(g),已知H2和I2的起始浓度均为0.10mol/L,达平衡时HI的浓度为0.16mol/L,若H2和I2的起始浓度均变为0.20mol/L,则平衡时H2的浓度(mol/L)是()
A.0.16B.0.08C.0.04D.0.02
类型三:
恒温恒压下,对于任意有气体参加的可逆反应,气体体系等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。
例3、恒温、恒压下,在一个容积可变的容器中发生如下反应:
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的量为________mol。
(2)若开始时放入3molA和3molB,达到平衡后,生成C的物质的量为_________mol。
(3)若开始时放入xmolA、2molB和1molC,达到平衡后,A和C的物质的量分别为ymol和3amol,则x=________,y=________。
平衡时,B的物质的量__(填编号)。
(甲)大于2mol
(乙)等于2mol
(丙)小于2mol
(丁)可能大于、等于或小于2mol
(4)若在(3)的平衡混合物中再加入3molC,待再次达到平衡后,C的物质的量分数是___________。
【解析】
(1)此时剩余A的物质的量为(1-a)mol。
(2)C的物质的量为3amol。
(3)由于达到平衡时C的物质的量为3amol,故此平衡状态与
(2)完全相同。
若把C的物质的量完全转化为A和B,A、B的物质的量应与
(2)完全相等。
起始(mol):
x
2
1
将C转化为A、B(mol):
x+1
2+1
0
平衡时(mol):
y
3-3a
3a
据题意有:
;
,解得y=3-3a。
通过上述可知,平衡时B的物质的量为(3-3a)mol,由于该反应起始时投放的物质为A、B、C均有,即从中间状态开始达到平衡,故平衡可能向左、向右或不移动,也即3a可能大于、小于或等于1(不移动时,
),故(3)中B的物质的量应为(丁)。
(4)在(3)的平衡中,再加入3molC,所达到的平衡状态与
(1)、
(2)、(3)皆为等效状态,通过
(1)可求出C的物质的量分数为
,也就是在(3)的平衡状态时C的物质的量分数。
【变式1】在一定条件下,将2.0molSO2和1.0molO2通入下列容器中:
活塞与大气相通,维持容器内温度不变,平衡时SO2的质量分数为w。
则该容器内充入下列物质,相同条件下达到平衡时,SO2的质量分数也为w的是
①4.0molSO2和2.0molO2
②2.0molSO2、1.0molO2和3.0molSO3
③3.5molSO3
④2.2molSO2和1.8molO2
⑤4.5molSO2、4.5molO2和1.2molSO3
A.①②B.①②③C.①②③④D.①②③④⑤
【答案】B
【解析】题设条件为恒温恒压,凡通入SO2和O2物质的量比与题干相同者都符合题意,不论SO3通入多少,都符合题意。
【变式2】在一定条件下,向一带活塞的密闭容器内充入2molSO2和1molO2,发生下列反应:
2SO2(g)+O2(g)
2SO3(g),达到平衡后改变下列条件,SO3气体平衡浓度不改变的是()
A.保持温度和容器体积不变,充入1molSO3B.保持温度和容器压强不变,充入1molSO3C.保持温度和容器压强不变,充入1molO2D.保持温度和容器压强不变,充入1molAr
类型四:
不等效平衡
例4.将2molPCl3和1molCl2充入一容积不变的密闭容器中,在一定条件下反应:
PCl3(g)+Cl2(g)
PCl5(g)达平衡时,PCl5为0.4mol。
那么,在同体积容器中充入1molPCl3和0.5molCl2,在相同温度下,达平衡时PCl5的物质的量是()
A.0.2molB.小于0.2mol
C.大于0.2mol而小于0.4molD.0.4mol
【解析】可以这样考虑:
当拿走一半反应物时,若按原来的比例可得PCl50.2mol,但由于容积不变,所以降低了容器中的压强,平衡向左移动,所以选B
【总结升华】恒温恒容下,对于反应前后气体体积发生变化的反应来说(即△V≠0的体系):
等价转化后,对应各物质起始投料的物质的量与原平衡起始态成比例,相当于改变压强,则两平衡不等效。
【变式1】一真空密闭容器中盛有1molPCl5,加热到20℃时发生如下反应:
PCl5(g)
PCl3(g)+Cl2(g)反应达到平衡时,PCl5所占体积分数为M%,若在同一温度和同一容器中最初投入的是2molPCl5,反应达到平衡时PCl5所占的体积分数为N%,则M和N的正确关系是()
A.M>
NB.M<
NC.M=ND.无法比较
【变式2】
(2016北师大二附中)在恒温时,一固定容积的容器内发生如下反应:
2NO2(g)
N2O4(g),达到平衡时,再向容器内通入一定量的NO2(g)或N2O4(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数()。
A.均增大B.均减小C.前者增大,后者减小D.前者减小,后者增大
【解析】若在定压状态下,再向容器内通入一定量的NO2(g)或N2O4(g),总体积均势必增大,重新达到平衡后,与第一次平衡时相比,NO2(g)的体积分数均不变;
在此基础上,将体积缩小为原体积大小,平衡均势必右移,NO2(g)的体积分数势必均减小。
【巩固练习】
选择题(每题有1-2个选项符合题意)
1.在1L密闭容器中加入2molA和1molB,在一定温度下发生下列反应:
2A(g)+B(g)
3C(g)+D(g),达到平衡时容器内D的百分含量为a%。
若保持容器体积和温度不变,分别通入下列几组物质达到平衡时容器内D的百分含量也为a%的是
A.3molC和1molDB.2molA、1molB和3molC
C.4molC和1molDD.1.9molA、0.95molB、0.15molC和0.05molD
2.在一个容积固定的密闭容器中充入,建立如下平衡:
H2(g)+I2(g)
2HI(g),测得HI的转化率为a%。
其他条件不变,在上述平衡体系中再充入1molHI,待平衡建立时HI的转化率为b%,则a与b的关系为:
A.a>bB.a<bC.a=bD.无法确定
3.(2016浙江一轮复习)某温度下的2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
下列说法正确的是( )。
X
Y
W
n(起始状态)/mol
2
1
n(平衡状态)/mol
0.5
1.5
A.该温度下,此反应的平衡常数表达式是K=
B.升高温度,若W的体积分数减小,则此反应ΔH>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,再向容器中通入3molW,达到平衡时,n(X)=2mol
4、恒温恒压条件下,可逆反应2SO2+O2
2SO3在密闭容器中进行,起始时充入1molSO3,达到平衡时,SO2的百分含量为ω%,若再充入1molSO3,再次达到新的平衡时,SO2的的百分含量为:
A.大于ω%B.小于ω%C.等于ω%D.无法确定
5.在一恒温恒容密闭容器中,A、B气体可建立如下平衡:
2A(g)+2B(g)
C(g)+3D(g)现分别从两条途径建立平衡:
I.A、B的起始量均为2mol;
II.C、D的起始量分别为2mol和6mol。
下列叙述不正确的是:
A.I、II两途径最终达到平衡时,体系内混合气体的体积分数相同
B.I、II两途径最终达到平衡时,体系内混合气体的体积分数不同
C.达到平衡时,途径I的和途径II体系内混合气体平均相对分子质量相同
D.达到平衡时,途径I的气体密度为途径II密度的1/2
6、一定温度下,将amolPCl5通往一容积不变的密闭容器中达如下平衡:
PCl3(g)+Cl2(g),此时平衡混合气体的压强为P1,再向容器中通入amolPCl5,恒温下再度达到平衡后压强变为P2,则P1与P2的关系是
A.2P1=P2B.2P1>P2C.2P1<P2D.P1=2P2
7.(2015天津一中)在温度、容积相同的3个密闭容器,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)
2NH3(g)ΔH=―92.4kJ·
mol―1]:
容器
甲
乙
丙
反应物投入量
1molN2、3molH2
2molNH3
4molNH3
NH3的浓度(mol·
L-1)
c1
c2
c3
反应的能量变化
放出akJ
吸收bkJ
吸收ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
3
下列说法正确的是()
A.2c1>c3B.a+b=92.4C.2p2<p1D.
1+
3<1
8、(2016江苏高考)一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)
CH3OH(g)达到平衡。
下列说法正确的是()。
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
9.体积完全相同的两个容器A和B,已知A装有SO2和O2各1g,B装有SO2和O2各2g,在相同温度下反应达到平衡时A中SO2的转化率为a%,B中SO2的转化率为b%,则A、B两容器中SO2转化率的关系正确的是()
A.a%>
b%B.a%=b%
C.a%<
b%D.2a%=b%
【答案与解析】
一、选择题
1.【答案】AD
【解析】此题属等效平衡中的第一种情况,T、V一定且m+n≠p+q,用“极限转换法”作出判断,将各选项中的物质的量换算成从正反应开始时A和B的物质的量。
2A(g)+B(g)3C(g)+D(g)
A.
起始/mol
转换后/mol
B.
C.
4
D.
1.9
0.95
0.15
0.05
2、【答案】C
【解析】本反应体积前后不变,压强增大,平衡不移,HI的转化率不变。
3、【答案】D
【解析】根据提供数据,平衡建立过程中X、Y减少的物质的量分别为1mol、0.5mol,W增加的物质的量为1.5mol,故该反应的化学方程式为2X(g)+Y(g)
3W(g),化学平衡常数表达式为K=
,A错误;
升高温度,若W的体积分数减小,说明平衡向逆反应方向移动,则逆反应为吸热反应,正反应为放热反应,ΔH<0,B错误;
增大压强,正、逆反应速率均增大,但反应前后气体分子数不变,平衡不移动,C错误;
该温度下,再向容器中通入3molW,等效于起始时充入4molX、2molY,所达平衡与原平衡等效,X的百分含量不变,因此,达平衡时n(X)=2mol,D正确。
4、【答案】C
【解析】恒温恒压条件下,若再充入1molSO3,平衡时SO3转化率不变,故SO2的的百分含量不变。
5、【答案】B
【解析】该反应是反应前后体积相等的反应,I、II两途径起始量折成同一半边对应成比例,两途径分别达到平衡时,体系内混合气体的百分组成相同。
6、【答案】B
题意的变化过程如下图所示:
Ⅱ是Ⅰ的等效平衡,由Ⅱ变为Ⅲ时,体积缩小一倍,可转化为压强增大一倍来考虑平衡移动。
但由于增大压强,对此可逆反应来说,平衡向逆反应方向进行,因而增大的压强就会小于原压强的2倍。
7、【答案】BD
【解析】A项,甲乙是等同平衡,c1=c2,运用叠加原理比较乙、丙可得c3>