核医学PETCT显像剂Word格式.docx
《核医学PETCT显像剂Word格式.docx》由会员分享,可在线阅读,更多相关《核医学PETCT显像剂Word格式.docx(29页珍藏版)》请在冰豆网上搜索。
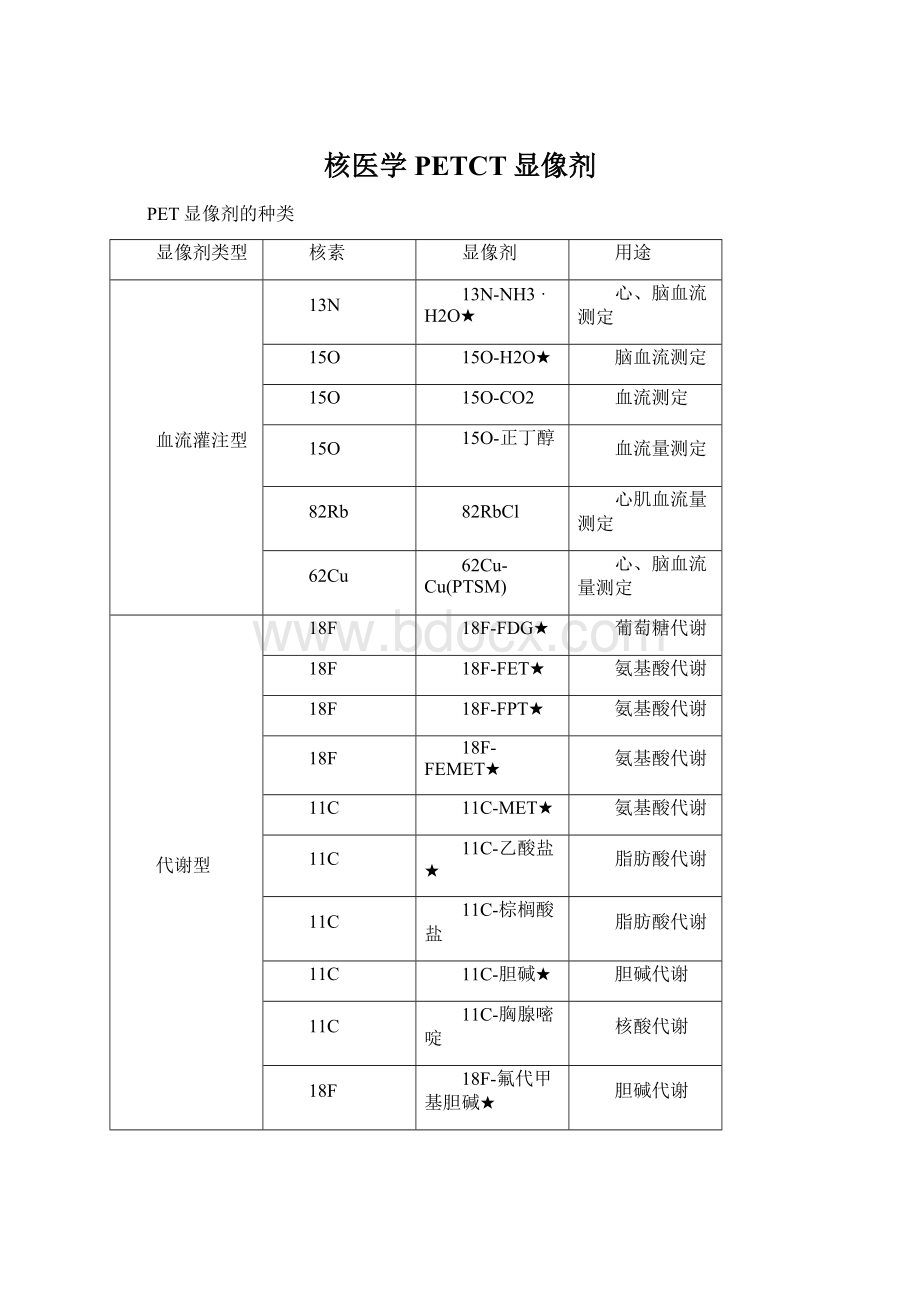
18F-FEMET★
11C
11C-MET★
11C-乙酸盐★
脂肪酸代谢
11C-棕榈酸盐
11C-胆碱★
胆碱代谢
11C-胸腺嘧啶
核酸代谢
18F-氟代甲基胆碱★
18F-氟代乙基胆碱★
18F-FLT★
细胞增殖
18F-FMISO★
乏氧显像
18F-FETNIM
18F-NaF★
骨血流与骨盐代谢
15O-O2★
氧代谢
结合型
11C-β-CIT
多巴胺转运蛋白显像
11C-SCH2339
多巴胺D1受体显像
11C-Raclopride
多巴胺D2受体显像
11C-MSP
11C-McN5652
5-羟色胺转运蛋白显像
11C-WAY100635
5-羟色胺受体显像
11C-Flumazenil
苯并二氮卓受体显像
11C-Deprenyl
单胺氧化酶B活性显像
S-[11C]CGP12177
肾上腺素能受体显像
11C-东莨菪碱
乙酰胆碱能受体显像
11C-MQNB
11C-烟碱
11C-Carfentanil
阿片受体显像
11C-Diprenorphine
18F-DOPA★
多巴胺能神经递质显像
18F-β-FP-CIT★
18F-β-FM-CIT
18F-FMSP
18F-FESP★
18F-Setoperone
18F-Flumazenil
18F-FES★
雌激素受体显像
18F-Carazolol
18F-RGD多肽
血管生成显像
18F-AnnexinV
肿瘤细胞凋亡显像
18F-Cyclofoxy
18F-Haloperidol
σ受体显像
18F-Octreotide
生长抑素受体显像
18F-FHBG
基因表达显像
18F-FHPG
18F-寡核苷酸
反义显像
正电子显像剂的一般性质量要求
正电子显像剂有其本身的特殊性,即必须在严格的时间限制内完成生产与就地就近使用,而且在生产与应用之间没有足够时间进行目前认可的所有质量控制(QC)试验,不仅细菌学、内毒素检查就是如此,某些化学质量检查也就是如此。
正电子显像剂有两个特点,其一就是因所用放射性核素的半衰期短,生产这些化合物时必须涉及高水平的放射性,以便最后能得到临床研究需要的有用数量,生产工序必须遥控。
其二,所研究的化合物极其微量,生产的绝大多数正电子显像剂不加载体,通常相当于近纳摩尔量级。
这在测定生理机能时具有不产生药效效应的优点。
因此,使用于质量控制的分析方法必须具有更低的探测下限。
在正电子显像剂这种特殊情况下,最终产品的质量控制受到时间的限制,对质量保证来讲,过程控制成为主要因素。
因此应建立单独而又严格的生产控制测量方法与程序。
例如在生产过程中,采用放射性高效液相色谱(HPLC)与放射性气相色谱(GC)等方法,无疑可以保证产品质量。
在线(Online)生产控制更有效的方法就是连续监测合成中放射性的变化,这有可能在很早阶段就发现生产过程中的大多数问题。
生产工艺研究结束时以及随后工艺与物料来源的任何明显变化,都应通过对几批放射性显像剂的必要质量指标进行验证以进行全面的质量控制。
成分与原材料的质量管理就是正电子显像剂质量保证的重要的过程控制。
这些原材料包括生产器具以及药物制品等所有成分。
每批原材料的一致性与质量必须得到保证并有证明文件。
经过“入口控制”后,该批产品必须作出标记并登记批号,且应备有关生产控制方式的证明文件,并制订试验记录与分析方法细则说明。
凡药典收载的成分,有详细的说明书就足够了。
如果试验方法药典未载明,则必须对其确认并被证实符合质量要求。
如果药典未载明而通常用作PET显像剂合成前体的原材料,必须以专题报告形式作出说明,包括名称、鉴定方法、纯度试验说明、稳定性与物理、化学性质。
在18F-FDG生产中,比较重要的原材料包括靶材料的纯度与丰度、三氟甘露糖的纯度、乙腈的纯度与含水量的高低以及其它化学试剂的质量,同时也包括靶室的清洁程度、反应器皿的清洁程度以及分离纯化材料的质量等,只有这些材料均合乎要求,才能生产出符号要求的18F-FDG。
任何满足短寿命放射性药物质量要求的体系,均取决于经过良好培训、具有经验的高素质人员,这就要求有一支在药物实践方面有经验的放射性药物化学专家或有经验的放射性药物专家,并要在短寿命放射性药物的专业化生产与分析方面进行培训。
18F-FDG国家暂行标准
•本品为无载体的氟[18F]脱氧氧葡萄糖的无菌、无热原、等渗水溶液。
含18F的放射性浓度,按其标签上记载的时间,为标示量的90、0-110%。
•性状:
本品为无色澄明测试液体
•鉴别:
(1)取本品适量,用合适的仪器测量本品的半衰期(中国药典2000版二部附录XIII,半衰期测定法),其半衰期为105-115分钟之间。
•
(2)取本品适量,照g谱仪法(中国药典2000牘二部附录XIII,g谱仪法)测量,其主要光子的能量应为0、511Kev与可能有的合成峰1、022KeV、
•(3)取本品适量,照放射化学纯度项下的方法测量,在Rf值约为0、45处有放射性主峰。
•检查:
pH值:
应为4、5-7、5(中国药典2000牘二部附录XIII,pH值测量法)
•含氨基聚醚2.2.2(K2、2、2)量
对照溶液的配制
精密称取氨基聚醚(2、2、2)0、025g于50ml烧杯,加热的二次蒸馏水溶解,次却后定量转移到250ml量瓶里,加水至刻度,摇匀即得含氨基聚醚(2、2、2)量为100、0mg的对照溶液、
•工作曲线的绘制:
精密量取对照溶液0、00,0.05.0、10,0、20,0、40ml,分别置于5ml容量瓶中,依次加入pH值为6、4的柠檬酸一氢钠缓冲溶液1、0ml(称取5、25g柠檬酸与2、0氢氧化钠于烧杯,用50ml水溶解,以0、1mol/L的NaOH溶液与pH计调节pH值为6、4,再稀释到250ml,摇匀,即可),含Pb2+500mg/ml的硝酸铅溶液(称取79、93mgPb(NO3)2于烧杯中,加水溶解,转移到100ml容量瓶中,用水定容,摇匀,即可)1、0ml,加水到刻度,摇匀、照紫外分光光度法(中国药典2000年版二部附录IVA),在254nm波长处分别测定吸光度,绘制工作曲线,工作曲线相关系数不小于0、99、
•测量法:
精密量取供试品溶液0、5ml于5ml量瓶中,以下操作步骤同工作曲线的绘制、测定供试品的吸光度,根据工作曲线求出氨基聚醚(2、22)量、本品每ml含氨基聚醚(2.2.2)量不超过25mg、
•细菌内毒素:
取本品适量,至少稀释6倍后,依中国药典2000年版二部附录XIE检查,本品每1ml含细菌内毒素量应小于15EU、
•无菌:
取本品适量,依中国药典2000年版二部附录XIH,无菌应符合规定、
•其它:
应符合注射剂项下有关规定(中国药典2000年版二部附录IB)
•放射化学纯度
取本品适量,以硅胶为固定相,以乙腈:
水(85:
5V/V)为展开剂,按放射化学纯度测量第一法(中国药典2000年版二部附录藏XIII)测量,含氟[18F]脱氧氧葡萄糖放射化学纯度应不低于90%、
•放射性浓度
取本品适量,按中国药典2000年版二部附录XIII,放射性浓度测量法第一法,按标签上记载的时间,放射性浓度应不低370MBq/ml、
•类别
放射性诊断用药
•规格
0、37-7、4GBq
•贮藏
本品密封于30ml或10ml无菌瓶中,置于铅容器内、
•有效期
从标定时间开始计算为6小时、
18F-FDG的质量指标
18F-FDG就是载于美国药典的第一个PET放射性药物,这里按照美国药典(1995年)制订的关于18F-FDG的质量要求,对18F-FDG的质量指标进行简要介绍。
①
放射性核纯度
核杂质来源:
对于不同的18F生产方法,可能产生不同的杂质同位素。
以20Ne(d,α)18F反应生产的18F-F2的质量较高,可能的杂质同位素就是寿命很短的钠与氖,在加工过程中会逐渐衰变,并在合成期间消失。
以18O-H2O为靶材料,通过18O(p,n)18F反应生产18F-F-,其放射性核纯度需要严格的控制,因18F-F-的质量不仅决定最终产品的核纯度,而且还影响亲核取代的反应性。
随着18O-H2O的丰度下降,通过16O(p,α)13N反应生成13N的量增加。
另外,来自靶窗箔膜与因箔膜材料改变产生的阳离子型放射性核素杂质也就是较有影响的因素。
因此,建议用阴离子交换柱来固定吸附18F-F-。
核纯度的测定:
有两种方法可以进行核纯度的鉴定。
其一就是利用锗半导体多道γ谱仪测量法进行测定,其γ谱出现一个0、511MeV的主光电峰。
在检测中,可能出现一个1、022MeV的总峰,这取决于源的几何条件与探测器效率。
其二就是半衰期测定法,即取一定剂量的18F-FDG溶液,测定其放射性活度,并记录测量时间,然后以一定的时间间隔进行连续测定5个半衰期内18F-FDG溶液的放射性活度,以时间为横坐标,放射性活度的对数为纵坐标作图,得到斜率k<
0的直线,由此直线上的任何两点可计算得半衰期,并求得在t=0时的总放射性活度,与原始总放射性活度相比,从而求得18F的核纯度。
18F的核纯度大于99、8%。
②
化学纯度
除了合成前体三氟甘露糖(Mannosetriflate)与3.4.6-三乙酰-D-葡萄糖醛(TAG)的纯度影响最终18F-FDG的化学纯度外,合成方法与反应条件也显著影响18F-FDG的化学纯度。
因此在市场购买前体时,尽量选用色谱级试剂。
在氨基聚醚Kryptofix2.2.2(Kry2、2、2)催化法中,必须在最终产品中控制有机溶剂与Kry2、2、2的含量。
利用AG50树脂可以除去Kry2、2、2。
元素分析、质谱与色谱已用于测定极微水平的Kry2、2、2。
硅胶板-TLC法就是目前分析Kry2、2、2最实用的方法,最低检出限量为0、025mg/ml,展开剂为甲醇-30%氨水(9:
1V/V)或0、1%三乙胺甲醇溶液,用碘显色,并与50μg/mL标准Kry2、2、2的层析斑点比较,要求2-18F-FDG注射液所呈现斑点的大小及明暗度不能超过标准溶液。
在亲核或亲电取代法中会产生2-18F-FDG的差向异构体2-[18F]氟-2-脱氧-D-甘露糖(18F-FDM)(图)。
特别以亲电取代法产生2-18F-FDG时,所选择的底物、亲电氟化试剂、反应溶剂对2-18F-FDG与2-18F-FDM的构成比例有很大的影响。
表列举了以TAG为底物进行2-18F-FDG生产时亲电氟化试剂与反应溶剂对2-18F-FDG与2-18F-FDM的构成比例的影响。
表亲电氟化试剂与反应溶剂对2-18F-FDG与2-18F-FDM的构成比例的影响
亲电氟化试剂
反应溶剂
2-18F-FDG:
2-18F-FDM
18F-F2
CH3COOH
65:
35
CH3CN
18F-CH3COOF
27:
75
30:
70
18F-XeF2
C6H6/BF3
50:
50
Et2/BF3
100:
C6H14/CCl3F
70:
30
C6H6/CCl3F
95:
5
利用纯的2-18F-FDG与2-18F-FDM进行PET脑显像,发现局部大脑的代谢率无差异,但就是进行2-18F-FDG与2-18F-FDM比例的测定仍然就是有必要的,并尽量使2-18F-FDM的比例低于5%。
HPLC法就是进行2-18F-FDG化学纯度分析的最好方法,以85%乙腈水溶液为流动相,流速为1ml/min,层析柱为反相氨基柱,以视差检测器进行检测,要求化学纯度大于95%。
③
放射化学纯度
除含有2-18F-FDG外,可以通过放射分析方法来鉴定未反应的[18F]氟化物、部分乙酰化的[18F]氟-脱氧葡萄糖衍生物或[18F]氟标记化合物。
要求2-18F-FDG的放射化学纯度大于95%。
放射性-HPLC法:
该法就是快速而准确的方法,容易对放射性杂质进行有效的分离并进行定量测定。
测定时同样以85%乙腈水溶液为流动相,流速为1ml/min,层析柱为反相氨基柱,用放射性探测器进行检测,要求放射化学纯度大于95%。
但使用反相氨基柱,由于拖尾效应,2-18F-FDG与[18F]氟化物的分离不理想。
因此,在乙腈水溶液洗脱的反相氨基柱法中,为了起排代作用,在洗脱液中加入一定量的NaF,才能有效地将[18F]氟化物分离并从该柱上洗脱下来。
另外,也可用DionexPA100阴离子交换柱,用0、1mol/LNaOH作为洗脱剂,该法能使[18F]氟化物、葡萄糖、2-18F-FDG以及部分水解的糖实现分离。
TLC法:
取适量注射液与标准2-19F-FDG溶液分别点于硅胶薄层层析板上,用95%乙腈水溶液为展开剂进行展开,直到溶剂移到层析板长度的约3/4处,取出并干燥,然后用适当的放射性测定法测定放射性分布。
或在已展开的层析板上喷2NH2SO4溶液并在110℃下显色10min,以确定FDG的Rf值。
其2-18F-FDG的Rf值应与标准2-19F-FDG的Rf值一致,约为0、4。
④
比活度
比活度(Specificactivity)可以通过合成时引入合成系统的氟化物的量来确定。
用不加载体的18F-F-的亲核取代法进行18F-FDG合成时,比活度能达到270Ci/μmol。
在亲电取代合成的情况下,靶气体中的载体氟将会限制比活度,而此时比活度就是靶气体中氟的浓度、靶体积与靶气体压力的函数。
载体量依靶设计参数而定,通常可能在0、01~0、02mmol之间变化,在这样的条件下,可能得到的比活度在20~400GBq/mmol(0、54~8Ci/mmol)之间变化,这时18F-FDG所含葡萄糖量在100~300μmol范围。
虽然18F-FDG-PET显像对其比活度的要求并不严格,但在质量报告中应列出比活度值,也可用放射性浓度(MBq/ml)代替。
⑤
物理与生物学指标
对于正电子显像剂的细菌学、内毒素、pH值、等渗性与稳定性等物理与生物学指标也有严格控制的质量参数。
这些质量参数的保证主要在于按适当的生产工艺流程操作,并保证产品符合药典的要求。
一般性状:
本品应为无色或淡黄色澄明溶液。
细菌学检查:
由于大多数正电子放射性药物半衰期短,许多药物对热不稳定,因此,灭菌过程就是通过0、22μm无菌过滤器来实现的,并收集在无菌的带盖玻璃小瓶中。
生产系统在生产用于人体的放射性药物前,其灭菌的有效性必须通过合格职业人员采用合格流程独立的予以证实,并且必须至少有三次证明就是生产无菌无热原产品的。
依其放射与生产特性,本品可在无菌检查完成之前放行使用。
在常规的18F-FDG生产中,应每月进行一次细菌学抽样检查。
送检时取双份1ml常规生产的18F-FDG注射液,分别用2管营养肉汤增菌培养液培养72h,观察结果应无细菌生长。
细菌内毒素检查:
细菌内毒素不能通过加热与过滤除去,因此,在生产流程中所应用的水溶液、试剂与实验器材等均要求无热原。
在18F-FDG生产过程中,酸水解过程就是除去热原的一个有效的过程,因为在pH<
1时,在80℃以上加热10min,即可相当有效地破坏热原。
热原试验按中华人民共与国药典2000年版进行。
取装有0、1ml鲎试剂溶液的试管4支,其中2支各加入0、1ml18F-FDG注射液作为试验管,1支加入0、1ml内毒素工作标准液作为阳性对照管,另一支加入0、1ml细菌内毒素检查用水作为阴性对照管,混匀后在37℃水浴中保温60min。
观察结果应为鲎实验阴性,定量测定其内毒素含量每mL不得超过175EU/V(EU为内毒素单位,V为在有效期限时总剂量的最大体积)。
18F-FDG注射液的pH随生产工艺流程的不同可能有较大的差异。
同样,即使就是相同工艺流程,批与批之间可能也有较大的变化。
pH测定通常用pH计或pH试纸法测定。
由于pH测定方便快速,因此应按常规进行。
要求18F-FDG注射液的pH必须在4、5~8、0之间。
18F-FDG注射液经研究证实,在300mCi以上的溶液中,18F-FDG在几小时内对氧化与辐射分解就是稳定的。
PET显像剂的生产18F-FDG的合成
18F-FDG
作用机理
2-18F-2-脱氧-D-葡萄糖(18FFDG)就是最常用的代谢显像剂,其代谢途径与天然葡萄相似。
通过载体-传递转运系统运输到组织细胞内,在己糖激酶作用下催化磷酸化,变成6-磷酸-18F-脱氧葡萄糖(18F-FDG-PO4),但它不象6-磷酸-葡萄糖能继续代谢,而较长时间滞留在组织细胞内,在葡萄糖代谢平衡时,滞留量大体上与组织葡萄糖消耗量一致,因此,18F-FDG能反映体内葡萄糖代谢状态。
放化合成
核反应
(1)20Ne(d,a)18F
(2)18O(p,n)18F
制备方法
(1)亲电加成反应;
(2)亲核取代反应包括固相亲核氟化反应与液相亲核氟化反应。
水解分为盐酸水解与氢氧化钠水解。
1)亲核取代法的合成流程(Kry2.2.2催化法)
氨基聚醚2.2.2(Kry2、2、2)催化法就是目前首选并广泛使用的方法,其流程如下:
He加压将含有18F-F-的靶水从靶室内传出,使其通过预先活化的Sep-pakQMA柱而捕获18F-F-;
用含3、0mgK2CO3与10、0mgKry2.2.2的洗脱液1、0ml洗脱18F-F-到反应瓶中;
将反应瓶在115℃的油浴中加热蒸干,然后,加入乙腈再蒸干;
将20~30mg三氟甘露糖(Mannosetriflate)溶解于1ml乙腈,并加入到反应瓶中;
将反应瓶置于110℃的油浴中5min,使其进行亲核氟代反应,生成四乙酰基-2-18F-2-脱氧葡萄糖(1.3.4、6-tetra-O-acetyl-2-deoxy-2-[18F]fluoro-D-glucose);
⑥
吹入N2,吹干反应瓶中的乙腈;
⑦
在反应瓶中加入1mol/LHCl溶液2ml,在115℃的油浴中加热,水解去掉乙酰保护基(AcO-);
⑧
向反应瓶中加入碱性磷酸盐缓冲液终止水解反应,并使溶液pH为中性;
⑨
加压将反应瓶中所有溶液通过C18反相柱,Al2O3柱及0、2μm微孔滤膜而收集产品瓶中,得到可供注射的18F-FDG溶液。
2)亲电取代法的合成流程
亲电氟化试剂较多,现简单介绍以18F-CH3COOF为亲电氟化试剂合成18F-FDG的方法。
将含有18F-F2的靶气体从靶室内传出,进入装有0、010ml液氨与12~15ml冰乙酸的玻璃起泡器中,得到18F-CH3COOF,并用KI-Na2S2O3滴定法测定18F-CH3COOF的化学产量;
在18F-CH3COOF溶液中加入含25~30mg3.4.6-三乙酰-D-葡萄糖醛(TAG)的冰乙酸溶液1ml,然后加热蒸干;
加入2mol/LHCl3ml,120℃加热10~15min;
加入10mg活性炭,并加热蒸干;
加入3ml乙腈水溶液(0、3%H2O),混合后,使该混合物通过硅胶柱(0、75×
10cm),然后用相同的乙腈水溶液淋洗,弃去前面收集的6、5ml洗提液,收集以后的洗提液15ml;
将15ml洗提产物溶液蒸干,加入1ml无热源H2O,再次蒸干;
加入无菌无热源生理盐水,溶解后,用0、2μm微孔滤膜过滤除菌并收集于产品瓶中,得到可供注射的18F-FDG溶液。
以上两类方法的生产流程均可在计算机的控制下在自动化合成装置中完成,如西门子公司生产的CTICPCU自动合成装置与GE公司的FDGMicroLab、TRACERLabFXFN系列自动合成装置就是利用亲核取代法进行18F-FDG合成的自动化装置;
美国BrookhavenNationalLaboratory研制的SUO自动合成装置就是利用亲电取代法进行18F-FDG合成的自动化装置。
PET显像剂的质量要求13N-氨水的质量要求
13N-氨水(13N-NH3·
H2O)的制备与质量要求
自1971年由Welch利用12C(d,n)13N核反应生产出13N以来,已有许多文献报道了13N-NH3·
H2O的产生,并已成功的用于临床PET研究。
13N-NH3·
H2O已广泛应用于临床PET显像,无创地评价心肌与大脑等组织的血流灌注,在静息与负荷状态下利用13N-NH3·
H2OPET心肌血流灌注显像早期诊断冠心病,并结合18F-FDGPET心肌代谢显像作为缺血心肌存活评价的“金标准”。
H2O作为PET放射性药物已被美国药典收录,我国药典尚未收录。
(1)
H2O的制备
H2O的合成方法有两种,即还原法与就地在线法。
可根据回旋加速器的装备与设置来选择生产方法。
还原法
还原法就是最常用的方法,利用16O(p,α)13N反应,用还原剂还原经质子照射16O-H2O产生的13N-NO2-、13N-NO3-,加热并用He将产生的13N-NH3传送到吸收液中,使其捕集到生理盐水或微酸性的生理盐水中。
根据所使用的还原剂不同,而分为戴氏合金(Devarda’sAlloy)还原法与钛还原法。
戴氏合金(Devarda’sAlloy)还原法:
戴氏合金就是一种粉末状的铜锌铝合金,三种金属成分所占的比例各为50%,5%与45%。
合成时将含有13N-NO2-、13N-NO3-的靶水用He加压传送到装有戴氏合金与NaOH(2:
1W/W)的密闭容器中,13N-NO2-、13N-NO3-一经还原成13N-NH3,便由He气流将气态的13N-NH3带入生理盐水溶液中。
经过滤除菌后,即可得到高比活度的13N-NH3·
H