广东省地方标准Word文档格式.docx
《广东省地方标准Word文档格式.docx》由会员分享,可在线阅读,更多相关《广东省地方标准Word文档格式.docx(29页珍藏版)》请在冰豆网上搜索。
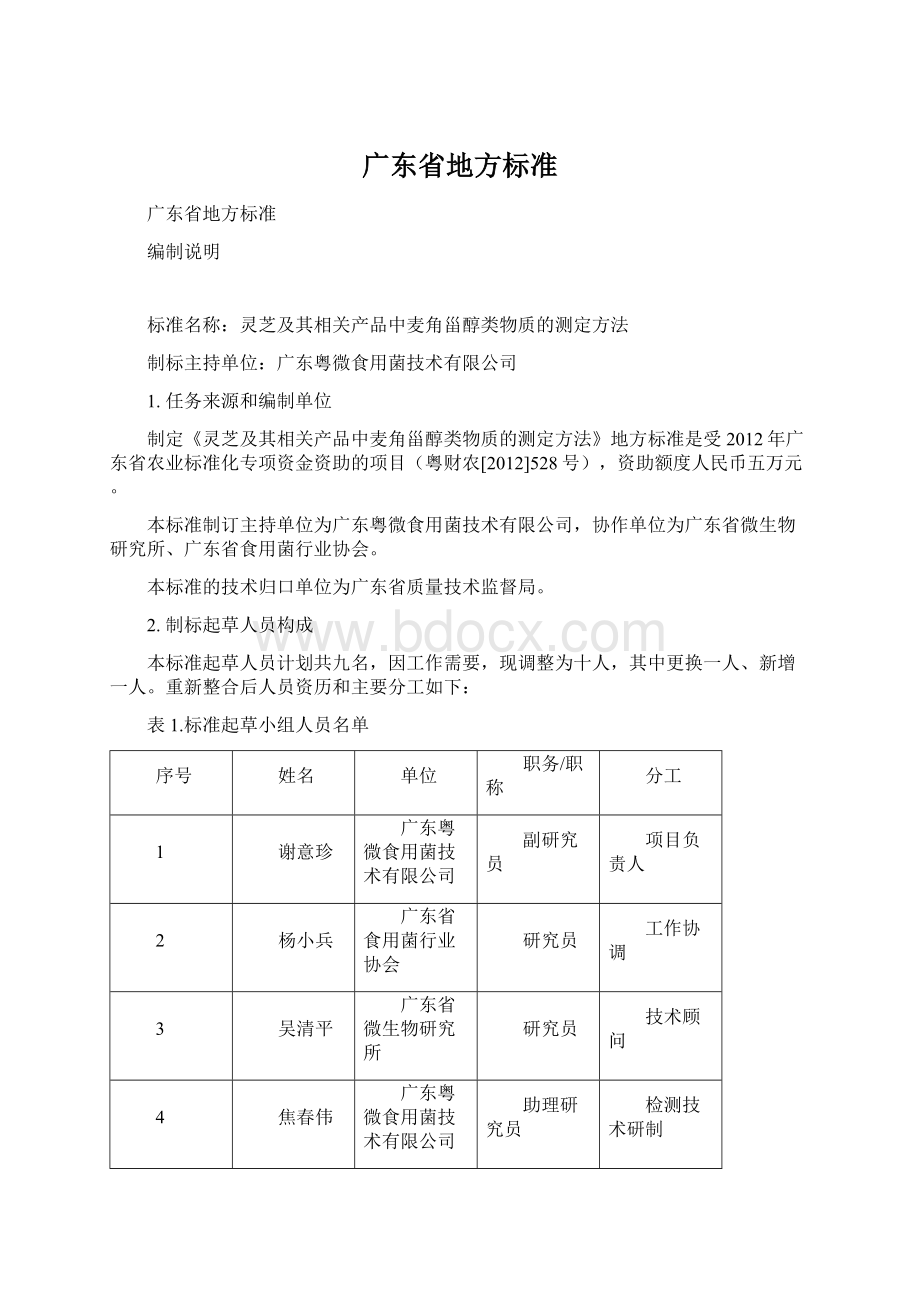
技术顾问
4
焦春伟
助理研究员
检测技术研制
5
李崇
高级工程师
6
李洁仪
7
李向敏
8
简伟明
工程师
9
张一帆
资料审查整理
10
罗翠婷
实验员
检测技术调整
3.制标项目背景
灵芝产品对消费者影响甚大。
据中国食用菌协会统计,2009年全国灵芝产量11.4万吨,而广东省产量为3.1万吨,仅次于山东省3.7万吨,居全国第二位。
广东省灵芝产业发展迅速,种植规模逐年扩大,成为增加农民收入,发展农村经济的重要支柱产业之一,如梅州地区的灵芝栽培业。
不少灵芝从业者为了开辟初级产品销路、增加产品附加值而发展起灵芝及其孢子粉的精深加工,各式破壁孢子粉、孢子油被开发并投放市场,其经济效益明显,又刺激更多资源投入到灵芝种植与加工业。
随着生活水平提高,越来越多消费者喜爱购买灵芝及其相关产品,或保健养生、或调整亚健康状态,而由其肿瘤病患者,乐于购买这些产品作辅助治疗。
若不经各类检验,灵芝子实体、孢子粉及其加工品无法从外表判断其质优劣,若不法业者在孢子粉搀入异物或者过期乃至变质孢子粉、操作违反卫生规定、或在孢子油中混维生素E以次充好,轻则给消费者造成经济损失,重则加重了原有的病情而危及人生安全。
产量虽大而监管依据未健全。
就现行国标和行标层面而言,林业标准“木灵芝干品质量”(LY/T1826-2009)中虽有对木灵芝的外观、卫生等方面作出规定,而对其功效成分却未有规定,加之其适用对象是“木段栽培的灵芝”,而目前不少灵芝是利用木屑代料栽培,这易被不法商利用为灰色地带。
灵芝孢子粉和孢子油产品问世已十年有余,而其质量标准也是几乎真空:
农业标准“破壁灵芝孢子粉破壁率的测定”(NYT1677-2008)以未破壁孢子为依据决定破壁率,未有对已破壁物体是否来源于灵芝孢子的判断依据,同样易为监管带来难度。
“灵芝孢子粉采收及加工技术规范”(20071088-T-469)和“灵芝”(20071310-T-469)尚在起草阶段。
即目前尚未有完整的、权威的产品标准作为灵芝、灵芝孢子粉及其加工产品的监管依据。
行业内公认的传统功校验证指标尚显粗放。
灵芝及其产品中粗多糖与总三萜,是目前获得业内公认的的功效评价指标。
但由于多糖类或三萜类物质结构复杂多样,其实质是两大类复合物,研究证明,只有具备一定分子量或在主链上有特殊支链的多糖分子,才具有较强抗肿瘤等活性;
对于三萜类物质中,碳环上不同的取代基团,也直接影响其消炎等功效。
某些情况下,此两类物质的检验并不适合作为产品优劣的依据,例如,未经淀粉-碘反应检验的孢子粉就进行粗多糖含量测定;
多种植物油中对总三萜的检测也有响应,传统分光光度法不能区分出灵芝孢子油中是否搀和植物油。
防范外省灵芝产品恶意竞争流入,保护本地龙头企业发展。
跨省贸易过程中,在未有高一级的标准前提下,输入地的标准应作为一个重要的参考指标。
目前各省食用菌相关的地方标准数量不一:
福建、浙江、山东、四川等食用菌生产大省都有几十项的食用菌标准,而广东目前仅有6项,灵芝相关的标准只有一个菌种标准,未有产品类或者检测方法类标准,不足以抵御外省产品恶意低价打入。
甾醇可作为评价灵芝及其产品质量的有力指标。
甾醇类物质是一类具有多个环状结构的化合物,具有调节新陈代谢、调节激素水平、预防心血管疾病等功能。
文献显示,在灵芝中麦角甾醇含量丰富,在灵芝加工产品中可能得到更高的富集。
并且其生物活性和含量足以使其作为评价灵芝及其产品质量的又一有力指标。
目前灵芝中粗多糖和总三萜的一般检测仅是使用分光光度法,在特异性方面稍存局限。
高效液相色谱(HPLC)是现代检测分析中先进的手段,可以精确对被测物进行定性和定量。
目前,不少国家标准或行业标准已应用高效液相色谱技术作为食品中农残、代谢物、功能活性物质的测定方法。
国内也有文献报道应用高效液相色谱法对灵芝中甾醇类物质进行分析检测。
4.制标原则
符合广东省农业标准化“十二五”发展规划中“提高农产品市场竞争力和农产品质量安全质量安全水平”以及“促进农产品质量提高”等指导思想。
有助于食品安全委员会办公室《关于进一步加强保健食品质量安全监管工作的通知》在灵芝产品中的有效实施。
具备适用性,可操作性。
所描述的检测技术能准确为受检样品相关指标的定性和定量;
能在广东省内大多数检测机构、实验室的设备条件下完成。
协调统一性,不与国家或行业中现行食用菌相关标准冲突;
能完善和补充“广东省食用菌标准化体系表”,并不与其中内容冲突。
5.针对对象、范围
本标准适用于检测灵芝(赤芝)子实体、菌丝体(含提取物)、孢子粉(不适用于未破壁孢子粉),以及孢子油中麦角甾醇含量。
检测对象为游离态麦角甾醇。
麦角甾醇被认为是真菌中的标志性化合物[1]。
麦角甾醇是主要存在于真菌中的,且其数量在细胞内占绝对优势的甾醇物质[2]。
对维持细胞膜系统流动性、渗透性有重要作用[3]。
麦角甾醇含量与真菌生长生物量呈正相关,可作为细胞内含物类指标测定真菌的生长情况的方法[4]。
抑制麦角甾醇的合成是杀真菌剂的主要作用机制[5,6]。
麦角甾醇在灵芝等真菌中有游离态和酯化两种能相互转化的存在形式。
游离麦角甾醇作为细胞膜的组成成分,剩余的游离麦角甾醇被转化为麦角甾醇酯,并储存在细胞液的脂粒中。
当细胞膜的生长受到激活或麦角甾醇合成受到抑制时,麦角甾醇酯水解为游离麦角甾醇供细胞膜合成之用[7,8]。
现已证实,食用菌受不同环境和内部因素的影响,不同时期麦角甾醇及其酯的相对含量存在较大差异。
在储存过程中,游离麦角甾醇的量显著减少,但酯化麦角甾醇的量在相当长时期内保持稳定,甚至有所增加。
这是由于游离麦角甾醇在真菌死亡后会逐渐减少、分解或酯化。
故用游离麦角甾醇而不是总麦角甾醇作为真菌生物量的标志化合物的方法更准确、更科学[9,10,11]。
灵芝中以麦角甾醇为骨架的化合物被视为麦角甾醇类化合物。
过氧麦角甾醇是其中一种研究较多,生理功效较显著(见附表1)的麦角甾醇类物质。
但出于以下理由而未被纳入本标准中:
1)过氧麦角甾醇可由麦角甾醇氧化而得。
研究至今未有明确量化,真菌中的有多少比例的过氧麦角甾醇是天然生成而非是由人为的提取、纯化过程被氧化而得[12,13,14];
2)目前文献中过氧麦角甾醇的检测手段主要使用薄层析色谱[15]和本标准申请时计划技术路线图不符。
考虑到HPLC应用更为广泛,因此不加入过氧麦角甾醇作为考察对象。
但在本说明中我们仍提供过氧麦角甾醇的HPLC结果(见图9)。
3)过氧麦角甾醇分子结果中没有共轭双键,只存在简单双键,大大降低了其对紫外光的吸收波长。
文献指出,过氧麦角甾醇在220nm以上波长无吸收峰[16]。
本说明中的实验也证实了这个现象。
一般分光光度仪,波长使用范围由205~220nm开始,所以过氧麦角甾醇的HPLC图谱只在吸收曲线的短波端呈现较强的末端吸收(见图8)。
由于仪器机械性能以及溶剂不完全透光,末端范围内所得结果误差较大,可靠性差。
对于其他以麦角甾醇为骨架的化合物,亦不作为本标准研究目标,其理由为:
1)分子结构中共轭双键的有无,影响检测的准确性;
2)在原材料中单位含量的大小,影响提取与检测的准确性;
3)活性或功效的不完全明确,不能代表原材料的生长状况优劣,不能作为加工产品的功效指标。
鉴于更符合标准的书写规范、以及准确体现标准适用范围和所用技术,本指标小组在此提出本标准名称修正建议,建议修改为“灵芝及其相关产品中麦角甾醇的测定高效液相色谱法”。
该部分参考文献:
[1]张燕.赤芝中麦角甾醇酯的色谱分离和检测方法研究[D].广州:
中山大学.2009:
5.
[2]SebastienDupont,GuillaumeLemetais,ThierryFerreira,PhilippeCayot,PatrickGervaisandLaurentBeney.ErgosterolBiosynthesis:
AFungalPathwayForLifeOnLand[J].Evolution.2012,66(9):
2961–2968.
[3]DavidMoore.FungalMorphogenesis[M].UK:
CambridgeUniversityPress.P117.
[4]MichaelO.GarrawayandRobertC.Evans.FungalNutrition[M].USA:
AWiley-IntersciencePublication.P232.
[5]MarthaBarajas-Aceves,MainulHassan,RaunelTinoco,RafaelVazquez-Duhalt.Effectofpollutantsontheergosterolcontentasindicatoroffungalbiomass[J].JournalofMicrobiologicalMethods.2002,50:
227–236.
[6]KeithBarrett-BeeandGrahamDixon.Ergosterolbiosynthesisinhibition:
atargetforantifungalagents[J].ActaBiochimicaPolonidq.1995,42(4):
465-480.
[7]ErwinZinser,FritzPaltauf,andGuntherDaum.Sterolcompositionofyeastorganellemembranesandsubcellulardistributionofenzymesinvolvedinsterolmetabolism[J].JournalofBacteriology.1993,175(10):
2853-2858.
[8]ReginaLeb,er,ErwinZinser,ClaudiaHrastnik,FritzPaltauf,GiintherDaum.Exportofsterylestersfromlipidparticlesandreleaseoffreesterolsintheyeast,Saccharomycescerevisiae[J].BiochimicaetBiophysicaActa.1995,1234:
119-126.
[9]Jian-PingYuan,Hui-CongKuang,Jiang-HaiWang&
XinLiu.Evaluationofergosterolanditsestersinthepileus,gill,andstipetissuesofagaricfungiandtheirrelativechangesinthecomminutedfungaltissues[J].ApplMicrobiolBiotechnol.2008,80:
459–465.
[10]Jian-PingYuan,Jiang-HaiWang,XinLiu,Hui-CongKuang,Shu-YanZhao.SimultaneousdeterminationoffreeergosterolandergosterylestersinCordycepssinensisbyHPLC[J].FoodChemistry.2007,105:
1755–1759.
[11]Jian-PingYuan,Jiang-HaiWang,XinLiu,Hui-CongKuang,andXiao-NiHuang.DeterminationofErgosterolinGanodermaSporeLipidfromtheGerminatingSporesofGanodermalucidumbyHigh-PerformanceLiquidChromatography[J].J.Agric.FoodChem.2006,54:
6172-6176.
[12]MICHAELL.BATESandWILLIAMW.REID.Dualityofpathwaysintheoxidationofergosteroltoitsperoxideinvivo[J].J.Chem.Soc.,Chem.Commun.,1976,44-45.
[13]Adam,Hk.,Campbell,Im.,Mccorkin.Nj..Ergosterolperoxide-afungalartifact[J].NATURE.1967,216(5113):
397.
[14]Arditti,J.,Ernst,R.,Fisch,Mh..ErgosterolperoxidefromRhizoctoniarepens-composition,conformation,andorigin[J].JournalofTheChemicalSociety-ChemicalCommunications.1972,22:
1217.
[15]WojciechKrzyczkowski,ElizaMalinowska,PiotrSuchocki,JerzyKleps,MarianOlejnik,FranciszekHerold.Isolationandquantitativedeterminationofergosterolperoxideinvariousediblemushroomspecies[J].FoodChemistry.2009,113:
351–355.
[16]LindsayC.BrownandJeffJ.Jacobs.Isolationofergosterolperoxidefromalternaria-dianthicola[J].Aust.J.Chem.,1975,28:
2317-2318.
6.制标工作总体过程
2012年6月标准制定项目申报;
2012年12月标准立项;
制表单位成立标准制定小组、讨论标准制定事宜;
2013年1~9月项目相关文献检索;
2013年9月项目资金全数到位;
2013年9月~发布征求意见稿:
标准草稿确定、编制说明编写。
其中2014年4月,本单位制标小组向主管部门提出标准名称修正申请,主管部门回复需交由征求意见阶段和审评送审稿阶段裁定。
7.编制依据
标准文本按“GBT1.1-2009标准化工作导则第1部分:
标准的结构和编写”进行编写。
标准内容组成参照《标准研制与审查》(中国标准出版社,2013年第一版)指导编写。
8.技术要素确定
8.1术语和定义
本标准中术语和定义主要由两部分组成,一部分引用自其他国标,如本标准中出现的“子实体”、“菌丝体”等术语,为直接引用GB/T12728食用菌术语,又如“色谱柱”、“流动相”等术语,为直接引用GB/T9008液相色谱法术语柱色谱法和平面色谱法。
另一部分为特别注释,仅适用于本标准,以使该类术语定义和本标准主题和目的更匹配。
8.2原理
本标准所用检测技术为高效液相技术。
其原理可分为三层次,第一层次为分离原理,即利用适当液体作为载体,在压力存在情况下,带动待测物质通过与载体想匹配的固体介质通道,待测物各组成成分在介质中因自身不同的物理特性而产生不同的迁移速度,从而达到分离效果。
第二层次为鉴定原理,在同一分离条件下,标准物与待测物中的同一种物质,其分离效果相同,从而目标物质能被定性。
第三层次为检测原理,含有共轭双键、苯环或苯环类似物等结构的物质,对特定波长的紫外光具有吸收能力,吸收强度与该物质的单位含量在一定浓度范围内成正比,从而目标物质能被定量。
在本标准中,为避免累赘描述,因此将原理改为“方法提要”。
此做法也被其他相关标准使用过。
如GB/T23788-2009保健食品中大豆异黄酮的测定方法高效液相色谱法、SN/T0647-2013出口坚果及坚果制品中抑制丹残留量的测定高效液相色谱法。
8.3试剂和材料
所列试剂是完成本标准所必须的试剂,其浓度设定为经验数据以及来自文献(见表)。
8.4仪器和设备
所列仪器是完成本标准操作所必须的。
8.5试样的制备和保存
对于孢子油意外的固体试样,其制备方法经单因素实验及正交试验验证而得。
单因素实验先定下色谱条件:
检测波长282nm;
Agilentprep-C18色谱柱(250mm×
4.6mm,5μm);
流动相为甲醇;
流速1.0mL/min;
柱温28℃;
进样量20μL。
8.5.1提取方法的选择
取干燥灵芝子实体1g,用95%乙醇浸泡过夜,滤出上清液;
残渣中加95%乙醇后超声30min或85℃回流1h,过滤合并滤液,浓缩,定容至10mL,过0.45μm滤膜,进样分析。
实验结果表明,采用回流提取方法测得的麦角甾醇含量高于超声提取方法,故本实验采用回流提取。
表2.提起方法试验结果
提取方式
子实体麦角甾醇含量(mg/g)
回流提取
2.16
超声提取
1.91
8.5.2提取溶剂的选择
取干燥灵芝子实体1g,分别用甲醇、95%乙醇、石油醚等不同溶剂,以上述回流方式处理,结果表明采用甲醇为提取溶剂的麦角甾醇提取量最高,乙醇提取略次之,考虑到用乙醇的毒性及成本均低于甲醇,故选择乙醇为提取溶剂。
表3.不同溶剂回流提取试验结果
提取溶剂
甲醇
2.19
95%乙醇
石油醚
1.42
8.5.3正交实验比较回流所用的料液比、提取次数及提取时间的组合选择
选取料液比、提取次数及提取时间作为考察因素,分别记为因素A、因素B和因素C,作三因素三水平正交试验。
残渣中加95%乙醇后按正交设计的方法在85℃进行回流,过滤合并滤液,浓缩,定容至10mL,过0.45μm滤膜,进样分析。
表4.L9正交实验因素与水平设计
水平
因素
A(g:
mL)
B(次)
C(h)
1:
20
30
50
表5.正交实验结果
试验号
水平选择
麦角甾醇含量(mg/g)
A
B
C
D(空白列)
1.98
2.08
2.10
2.00
2.15
2.20
2.23
均值1
2.053
2.047
2.113
2.120
均值2
2.103
2.143
2.133
均值3
2.197
2.163
2.137
2.100
极差
0.144
0.116
0.034
0.033
表6.正交实验结果的方差分析表
偏差平放和
自由度
F比
F临界值
是否具显著性
料液比
0.032
16.000
19.000
否
次数
0.023
11.500
回流时间
0.002
1.000
误差
0.000
使用软件“正交设计助手”对正交数据进行方差分析,结果表明各因素对综合评分的影响都无显著性意义。
极差分析表明,因素A(料液比)为主要影响因素,其次是提取次数因素,各因素作用主次顺序为A>
B>
C,通过综合考虑确定,最佳方法为A3B3C1,即料液比为1:
50,提取3次,每次回流1小时。
8.5.4试样保存
由于麦角甾醇已被氧化,因此试样需现配现用,不作保存后检测。
8.6色谱条件
参考文献所得,见附表2。
8.7结果表述
测定结果需要从标准曲线计算出。
标准曲线的制作:
分别精密吸取麦角甾醇贮备液溶液10,8,4,2,1mL,置于10mL容量瓶中。
用甲醇稀释至10mL,摇匀,制得系列浓度的对照品溶液(200μg/mL、160μg/mL、80μg/mL、40μg/mL、20μg/mL)。
过0.45μm微孔滤膜后分别吸取20μL标品溶液注入液相色谱仪,得出结果后计算流出峰的峰面积。
以峰面积为横坐标(X轴),对照品麦角甾醇的进样质量为纵坐标(Y轴),得线性回归方程。
线性回归方程为:
Y=13.32X-24.32,r=0.9997,结果表明麦角甾醇在20μg/ml~200μg/ml呈良好的线性关系,定量限设定为20μg/ml,最低检出限视所用仪器信噪比而定,一般为信噪比的2~10倍,本标准检测限位0.2μg/ml,与目前国内文献检测限相比,具有一定优势(见附表3)。
测试结果以受试物单位质量或单位体积中麦角甾醇的质量来表示。
代数式为:
。
式中:
——样品中麦角甾醇的含量,单位为毫克每克(mg/g);
液体样品则为毫克每毫升(mg/mL);
——根据标准曲线得出的麦角甾醇的浓度,单位为克每毫升(g/mL);
——样品最终定容体积,单位为毫升(mL);
——固体样品质量数值,单位为克(g);
液体样品体积数值,单位为毫升(mL);
分母中1000用作单位单位转换。
将符合重复性要求的三个独立测定值得算术平均值作为测定结果,保留小数点后两位数值。
8.8方法性能指标考察
8.8.1精密度试验:
分别精确吸取麦角甾醇对照品浴液(0.2000mg/mL)20μL6次,连续进样,分别测定其峰面积值,计算得峰面积积分值的RSD(相对标准偏差)为0.5%,表明该仪器精密度良好。
8.8.2重复性试验