高三化学复习专题九微粒间相互作用力Word文件下载.docx
《高三化学复习专题九微粒间相互作用力Word文件下载.docx》由会员分享,可在线阅读,更多相关《高三化学复习专题九微粒间相互作用力Word文件下载.docx(20页珍藏版)》请在冰豆网上搜索。
P4O10、C6H12O6均属于共价化合物
3.(09年海南化学·
19.3)下列说法中错误的是()
A.SO2、SO3都是极性分子
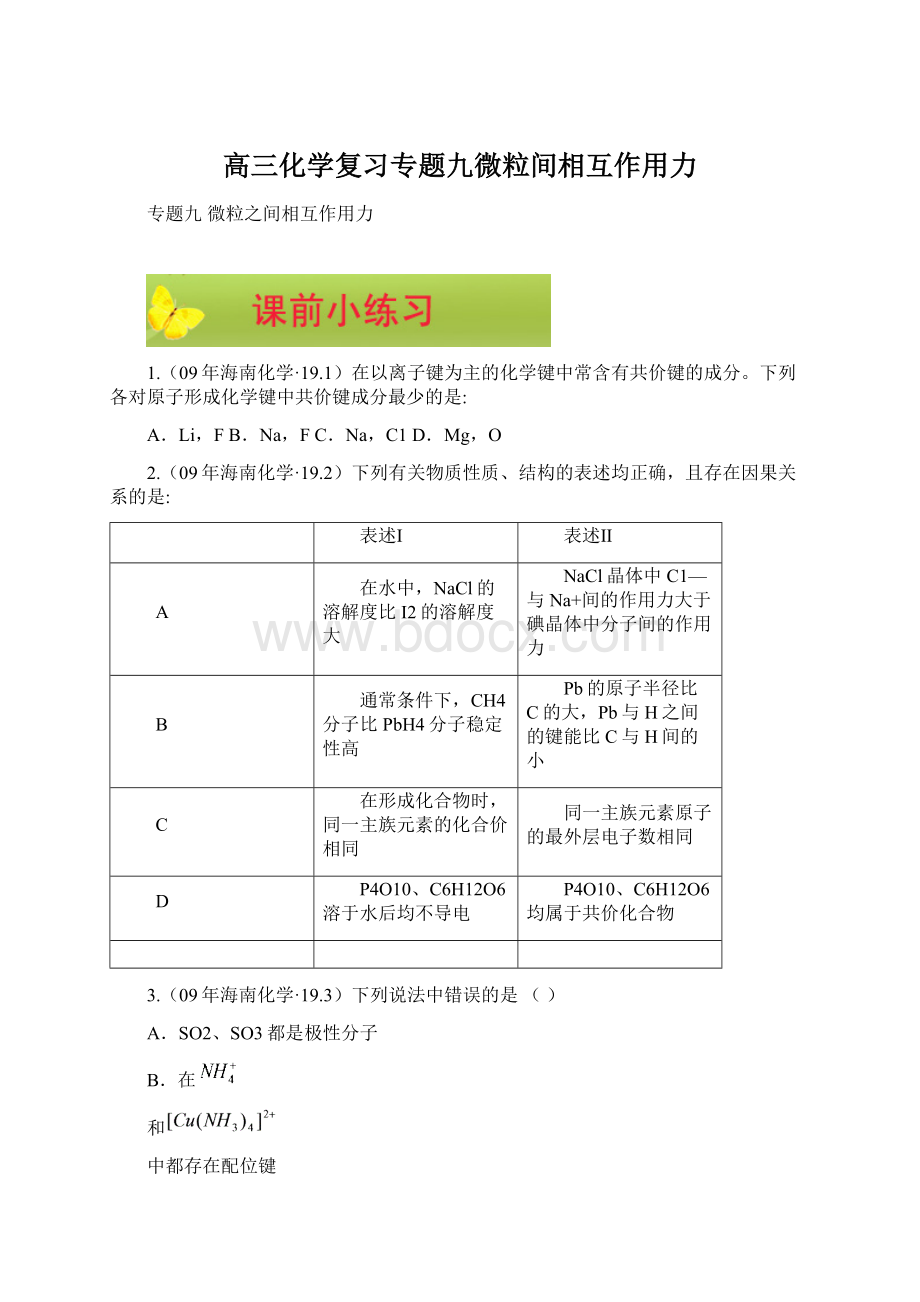
B.在
和
中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
4.(08全国Ⅰ卷)下列叙述中正确的是()
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、Hl的稳定性依次增强
D.CS2、H2O、C2H2都是直线型分子
考试说明
必修部分:
认识化学键的含义。
了解离子键、共价键的形成。
能用电子式、结构式和结构简式表示某些物质的结构。
能识别典型的离子化合物和共价化合物,能从化学键变化的角度认识化学反应的实质。
选修部分:
①理解离子键的含义,能说明离子键的形成。
②了解NaCI型和CsCI型离子晶体的结构特征,能用晶格能解释典型离子化合物的物理性质
③了解共价键的主要类型仃键和丌键,能用键能、键长、键角等数据说明简单分子的某些性质(对d键和兀键之间相对强弱的比较不作要求)
④了解极性键和非极性键,了解极性分子和非极性分子及其性质的差异。
命题趋向:
微粒间相互作用力主要包含两部分内容,一是化学键,另一是分子间作用力,命题点通常会在化学键的辨别,电子式,以及化学键与物质的性质上,分子间作用力对物质性质的影响上,题目难度一般较小,多数作为题目的一部分,很少单独命题。
高考预测:
从08、09两年高考试题看,有关微粒间作用力的考察,多数为较容易试题,不论是是选择题还是填空题,没有单独以此点为命题内容,2010年高考将仍然保持此命题特点。
知识框架
一、离子键
1.离子键:
①成键微粒:
②成键本质:
③成键条件:
注意:
含有离子键的化合物均为离子化合物(如:
大多数金属化合物、碱、盐类)
2.离子键强弱与晶格能
晶格能:
晶格能影响因素:
离子键强弱与晶格能大小关系:
3.电子式
原子电子式:
氟原子钙原子氢原子氧原子
离子电子式:
注意:
阳离子的电子式一般是离子符号本身,而阴离子的电子式要用方括号括起来。
钙离子铝离子
氯离子硫离子
铵根离子氢氧根离子过氧根离子
用电子式表示下列化合物:
(注意相同的离子不能合并)
NaCl:
MgO
CaCl2:
Na2O2
用电子式表示下列化合物的形成过程:
用电子式表示氯化钠的形成过程:
左边写原子的电子式,右边写化合物的电子式,中间用箭头连接,离子化合物还要用箭头表示出电子的转移方向,不写反应条件。
KBr:
MgCl2:
Na2S:
【例1】:
下列电子式或结构式错误的是
A.OH-的电子式
B.NH4Cl的电子式
C.Na2O的电子式:
D.Na+的电子式:
Na+
解析与评价:
本题考查物质电子式的书写,C中,钠离子不能合并写。
答案:
【变式训练1】下列用电子式表示化合物的形成过程,其中正确的是()
【例2】离子键的强弱主要决定于离子的半径和离子电荷值。
一般规律是:
离子半径越小,离子电荷值越大,则离子键越强。
K2O、MgO、CaO三种物质中离子键由强到弱的顺序是()
A.K2O、MgO、CaO
B.MgO、CaO、K2O
C.MgO、K2O、CaO
D.CaO、MgO、K2O
题干中明确指出离子键的强弱主要决定于离子的半径和离子电荷值。
离子半径:
K>
Ca>
Mg,离子所带电荷:
Ca2+=Mg2+>
K+
变式训练2、M元素的一个原子失去2个电子,该2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中,正确的是(
)
A.Z的熔点较低
B.Z可表示为M2Y
C.Z一定溶于水中
D.M形成+2价阳离子
二、共价键
1.共价键:
小结:
(1)只含有共价键的化合物属于共价化合物(即若存在离子键,就为离子化合物)
(2)共价键存在于非金属单质的双原子分子中,共价化合物和某些离子化合物
中(如NaOH、Na2O2)
2.共价键的表示方法
①电子式:
H2Cl2N2O2
CO2CH4HClH2ONH3
②结构式(用短线“-”表示一对共用电子):
H2N2HCl
H2ONH3CO2CH4Cl2
③用电子式表示下列形成过程:
H2:
HCl:
CO2:
H2O:
3.共价键的分类
●依据键的极性分类:
①非极性键:
在双原子单质分子中,同种原子形成的共价键,两原子吸引电子的能力,共用电子对任何一个原子,成键的原子都电性。
这样的共价键叫做非极性共价键,简称非极性键,可见非极性键是同种原子之间形成的共价键。
如:
H-H键,Cl-Cl键,Na2O2中的O-O键等。
②极性键:
:
在化合物分子中,不同种原子形成的共价键,由于不同种原子吸引电子的能力,共用电子对必然偏向吸引电子能力的一方,所以吸引电子能力强的一方显电性,吸引电子能力弱的一方显电性。
这样的共价键叫做极性共价键,简称极性键,可见极性键是不同种原子之间形成的共价键。
H-Cl键,NaOH中的O-H键等
●依据成键方式分类:
键:
原子轨道沿着核间连线方向以方式形成的共价键;
原子轨道沿着核间连线两侧方向以方式形成的共价键;
4.共价键参数
键长:
键角:
键能:
其中、是衡量共价稳定性的参数,通常键长越,键能越大,表明共价键越稳定;
共价键具有性,是描述分子立体结构的重要参数,分子的立体结构还与有一定的关系。
【例3】关于化学键的下列叙述中,正确的是()
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.离子化合物中只含离子键
D.共价键只能存在于化合物中
离子键只存在于离子化合物中,共价键可存在于离子化合物、共价化合物以及某些单质中
答案:
A
【变式训练3】下列化合物中既存在离子键,又存在极性键的是()
A.H2OB.NH4ClC.NaOHD.Na2O2
【例4】下列分子中所有原子都满足最外层8电子结构的是
A.光气(COCl2)B.六氟化硫C.二氟化氙D.三氟化硼
分子中的原子是否满足8电子结构,决定于中心原子的最外层电子数和形成共价键的数目
【例5】对δ键的认识不正确的是()
A.δ键不属于共价键,是另一种化学键
B.S-Sδ键与S-Pδ键的对称性相同
C.分子中含有共价键,则至少含有一个δ键
D.含有π键的化合物与只含δ键的化合物的化学性质不同
共价键包括δ键和π键,δ键不管是S-Sδ键、S-Pδ键还是P-Pδ键都是轴对称的,π键不够稳定,必须与δ键共存
【例6】下列分子中,键能最小的是
A.F2 B.Br2 C.Cl2 D.N2
N2中含有一个三键,键能较大;
F2、Br2、Cl2中只有一个单键,键能小,F2分子中电子“密度”大,F原子间斥力大,键能最小
【变式训练6】能够用键能解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
【例7】
(2008山东)氮是地球上极为丰富的元素。
的键能为942kJ·
mol-1,N-N单键的键能为247kJ·
mol-1,计算说明N2中的键比_键稳定(填“σ”或“π”)
本题主要考查物质结构的原理及其应用,较难。
根据题给数据可知,N—N单键即σ键的键能为247kJ/mol,N≡N的键能为942kJ/mol,其中包含一个σ键和两个π键,则π键的键能是(942-247)/2=347.5kJ/mol,键能越大,化学键越稳定,由数据可以判断π键比σ键稳定
π键比σ键稳定
【变式训练7】
(08四川卷)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为______________。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是________,写出该元素的任意3种含氧酸的化学式:
_______________________。
(3)D和形成的化合物,其分子的空间构型为________________。
(4)D和X形成的化合物,其化学键类型属______,其晶体类型属____________。
(5)金属镁和E的单质在高温下反应得到的产物是________,此产物与水反应生成两种碱,该反应的化学方程式是___________________________。
(6)试比较D和X的最高价氧化物熔点的高低并说明理由__________________。
四、金属键
1、概念:
金属晶体中,金属阳离子与_____________________之间较强的相互作用。
2、强弱判断
①价电子数,②原子半径规律:
______________________
五、分子间作用力和氢键
1.分子间作用力:
分子间作用力不是化学键,它比化学键要弱得多,它广泛地存在于分子与分子之间,但只有在分子与分子充分接近时,分子间才有明显的作用。
分子间作用力对物质的熔点、沸点、溶解度等都有影响
2.分子间作用力与化学键的区别
分子间作用力存在于:
分子与分子之间。
化学键存在于:
分子内相邻的原子之间。
3.分子间作用力对物质物理性质的影响
一般来说,对于和的物质,,,物质的、也越高。
例如,卤素单质,随着相对分子质量的增大,分子间作用力增大,它们的熔点,沸点也相应升高。
4.HF、H2O、NH3的沸点有反常现象,是因为它们的分子之间存在着一种比分子间作用力稍强的相互作用,这种相互作用叫。
氢键比弱,比强,所以把氢键看作是一种稍强的