高一化学必修1专题一复习资料Word文件下载.docx
《高一化学必修1专题一复习资料Word文件下载.docx》由会员分享,可在线阅读,更多相关《高一化学必修1专题一复习资料Word文件下载.docx(18页珍藏版)》请在冰豆网上搜索。
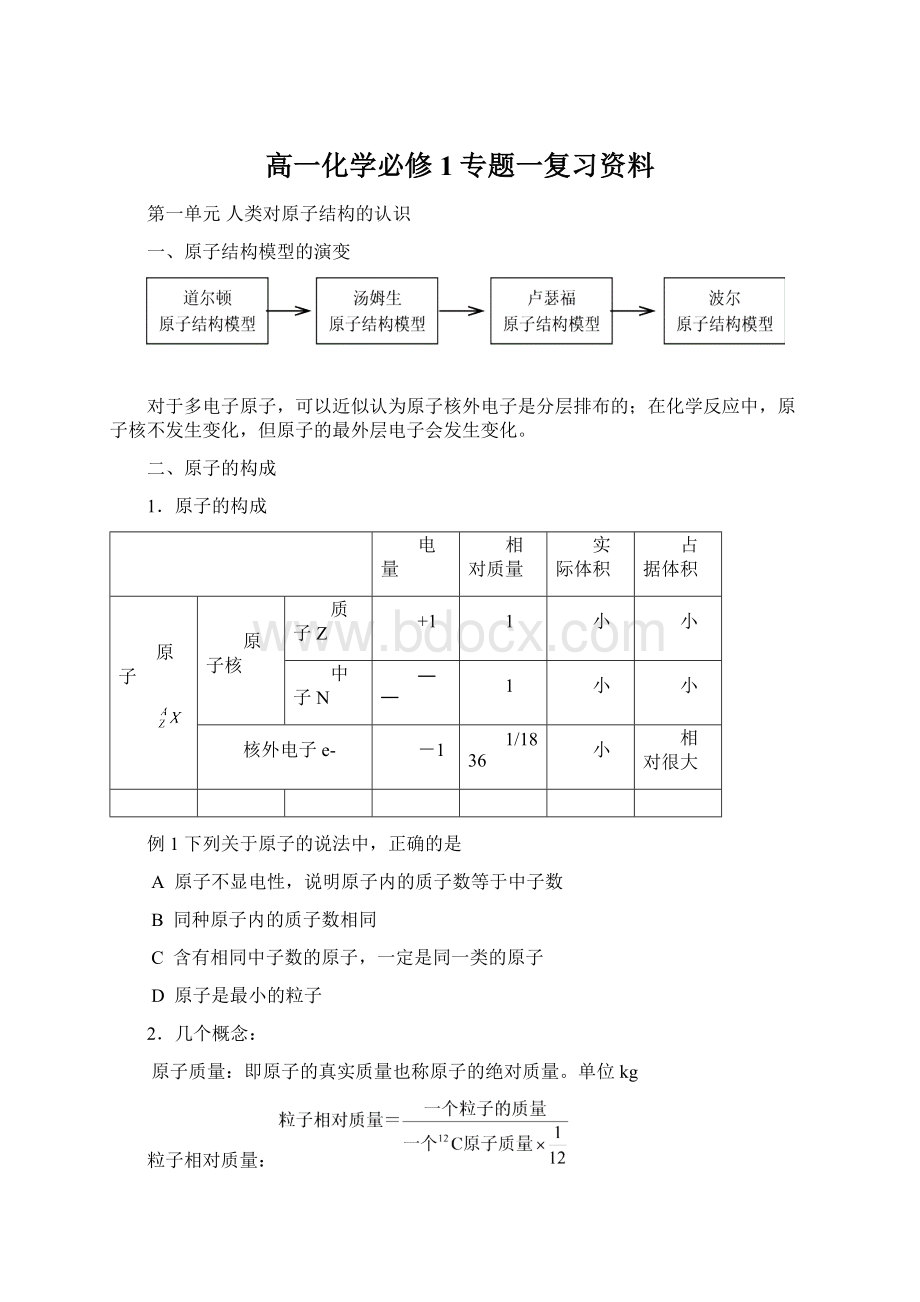
例1下列关于原子的说法中,正确的是
A原子不显电性,说明原子内的质子数等于中子数
B同种原子内的质子数相同
C含有相同中子数的原子,一定是同一类的原子
D原子是最小的粒子
2.几个概念:
原子质量:
即原子的真实质量也称原子的绝对质量。
单位kg
粒子相对质量:
注:
①单位1(一般不写出)
②粒子:
可以原子、质子、中子、电子、微观粒子
质量数:
原子中质量数与质子数得和
例2
(1)原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir〕元素的原子核外电子数恰好相等,因此称为“铱星计划”。
已知铱的一种同位素是
则其核内的中子数是
A.77 B.114 C.191 D.268
例3某元素一种同位素原子的质子数为m,中子数为n,则下述论断正确的是
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳原子质量为W克;
此原子的质量为(m+n)W克
D.核内中子的总质量小于质子的总质量
3.有关原子结构常用规律总结
⑴质量关系:
质量数(A)=质子数(Z)+中子数(N)
⑵电性关系:
原子:
核电荷数=质子数=核外电子数
阴离子:
质子数=核外电子数-电荷数
阳离子:
质子数=核外电子数+电荷数
4.核素、同位素
核素:
具有一定质子数和一定中子数的某种原子
同位素:
质子数相同而质量数(或中子数)不同原子的互称
H:
H
H(D)
H(T)氢元素有三种核素,三种核素间互称同位素。
元素的相对原子质量:
=A1×
a1%+A2×
a2%+……
A1、A2……为核素的相对原子质量
a1%、a2%……为核素的原子百分数或核素原子的物质的量分数
例4已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为
A.39∶61 B.61∶39 C.1∶1 D.39∶11
习题精练
1.元素的种类和原子的种类()
A.前者大B.后者大C.相等D.不能确定
2.用化学方法不能实现的是()
A.生成一种新分子 B.生成一种新离子
C.生成一种新原子 D.生成一种新单质
3.已知最外层电子数相等的元素原子具有相似的化学性质。
氧元素原子的核外电子分层排布示意图为
,下列原子中,与氧元素原子化学性质相似的是()
氖碳镁硫
ABCD
4.(2005年高考全国卷II)分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是()
A.12B.14C.16D.18
5.(2005年高考上海卷)据报道,科学家已成功合成了少量N4,有关N4说法正确的是()
A.N4是N2的同素异形体B.N4是N2的同种物质
C.相同质量的N4和N2所含原子个数比为1:
2D.N4的式量是56g
6.(2005年高考广东卷)Se是人体必需微量元素,下列关于
说法正确的是()
A.
互为同素异形体B.
互为同位素
C.
分别含有44和46个质子D.
都含有34个中子
7.已知自然界氧的同位素有16O,17O,18O,若氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有()
A3种B6种C9种D12种
8.在离子RO3n-中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是()
A.A–x+n+48B.A–x+n+24
C.A–x-n–24D.A+x-n–24
9.下列说法中不正确的是()
①质子数相同的粒子一定属于同种元素;
②同位素的性质几乎完全相同;
③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;
④电子数相同的粒子不一定是同一种元素;
⑤一种元素只能有一种质量数;
⑥某种元素的原子相对原子质量取整数,就是其质量数。
A.①②④⑤B.③④⑤⑥
C.②③⑤⑥D.①②⑤⑥
10.“原子结构模型”是科学家根据自己的认识,对原子结构的形象描摹,一种模型代表了人类某一阶段对原子结构的认识。
人们对原子结构的描摹,按现代向过去顺序排列为:
原子模型、汤姆生原子模型、原子模型、电子云模型、玻尔原子模型。
11.已知1个N2O3分子的质量为akg,1个N2O5分子的质量为bkg,若以1个氧原子(16O)质量的1/16作为相对原子质量的标准,则NO2的式量为_______________。
12.(2005浙江省高考理综)已知Q与R的式量之比为9:
22,在反应X+2Y=2Q+R中,当1.6gX与Y完全反应后,生成4.4gR,求参与反应的Y和生成物Q的质量之比。
第二单元丰富多彩的化学物质
金属单质
一、物质的分类
非金属单质
单质
酸
碱
盐
氧化物
氢化物
纯净物
有机化合物
化合物
无机化合物
物质
混合物
二、单质、氧化物酸、碱、盐等物质之间的相互转化关系注意:
复分解反应的条件:
有沉淀、气体、水生成。
金属与盐溶液的置换条件:
活泼性强的金属置换活泼性弱的金属。
三、有关物质的量、阿伏加德罗常数、摩尔质量、气体摩尔体积等概念
1.物质的量:
物质的量是七个基本物理量之一,其单位是摩尔(mol),符号为n,注意:
(1)物质的量度量的对象是微粒集体,微粒可以是分子、原子、离子、电子、中子、质子等。
(2)使用物质的量一般用符号标明微粒,如1molH2O,5molH+等。
摩尔作为物质的量的单位,不能用来表示宏观物体的多少,使用摩尔时必须指明微粒的种类。
2.阿伏加德罗常数:
1mol任何微粒集体中所含有的微粒数叫做阿伏加德罗常数。
用符号NA表示,通常使用近似值6.02×
1023mol-1。
3.摩尔质量:
1mol任何物质的质量,称为该物质的摩尔质量。
用符号M表示,单位为g/mol。
1mol物质的质量以克为单位,在数值上等于该物质的相对原子质量或相对分子质量。
物质的量与质量、摩尔质量的关系为:
n=m/M
4.气体摩尔体积:
单位物质的量的气体所占的体积叫做气体摩尔体积。
用符号Vm表示,常用的单位为L/mol。
标准状况下(0℃、101Kpa),1mol任何气体所占的体积都约为22.4L,即标况下的气体摩尔体积约为22.4L/mol
四、物质的聚集状态及分散系
1.物质的聚集状态:
主要有气态、液态和固态三种。
同一物质在不同温度和压力下物质的聚集状态不同。
物质的体积由三个因素决定:
微粒数目、微粒间距、微粒大小。
固体、液体的体积主要决定于微粒数目和微粒大小;
而气体的体积主要决定于微粒数目、微粒间距。
2.分散系:
一种或几种物分散到另一种物质中形成的混合物叫分散系。
被分散的物质叫分散质,分散其他物质的物质叫分散剂。
可分为:
溶液(粒子直径小于10-9m)、浊液(粒子直径大于10-7m)、胶体(粒子直径在10-9~10-7m)
3.胶体:
胶体与溶液外观上没有区别,都是均一、稳定、透明的分散系。
其特性:
具有丁达尔效应,利用此特性可鉴别溶液和胶体。
有些胶体具有吸附性,可作净水剂,除去水中不溶性杂质,使水澄清。
比如氢氧化铝胶体、氢氧化铁胶体等。
习题精练
1、下列广告用语在科学性上没有错误的是()
A、这种饮料中不含任何化学物质
B、这种蒸馏水绝对纯净,其中不含任何微粒
C、这种口服液含丰富的氮、磷、锌等微量元素
D、没有水就没有生命
2、“垃圾是放错了位置的资源”,应该分类回收。
生活中废弃的铁锅、铝制的易拉罐、铜导线等可以归为一类加以回收,它们属于()
A.氧化物B.盐C.金属或合金D.碱
3、下列物质属于纯净物的是()
A、洁净的空气B、食盐水C、浮有冰块的水D、糖水
4、经测定,一瓶气体中只含有C、H两种元素,通常情况下这瓶气体不可能是( )
A、一种化合物 B、一种单质和一种化合物的混合物
C、两种化合物 D、两种单质
5、“可燃冰”又称“天然气化合物”,它是在海底的高压、低温条件下形成的,外观像冰。
1体积“可燃冰”可储藏100~200体积的天然气。
下面关于“可燃冰”的叙述不正确的是()
A、“可燃冰”有可能成为人类未来的重要能源
B、“可燃冰”是一种比较洁净的能源
C、“可燃冰”提供了水可能变成油的例证
D、“可燃冰”的主要可燃成分是甲烷
6、下列叙述中正确的是()
A、硝酸的摩尔质量63g
B、1molCO的质量是28g
C、2g氢气所含原子数目为1mol
D、铁的摩尔质量在数值上等于铁原子的相对原子质量
7、相同质量的下列气体中,所含原子数最多的是()
A、CH4B、N2C、COD、O2
8、下列说法中错误的是()
A、物质的聚集状态不同主要是构成物质的基本粒子间的距离不同
B、不同分散系其对应分散质的微粒直径不同
C、1molO2与1molO3所含的分子数目相等
D、1mol氢气所占体积约为22.4L
9、设NA为阿伏加德罗常数,下列说法中正确的是()
A、1molNa2SO4溶于水中,所得溶液中Na+个数为NA
B、18g水含有电子数为8NA
C、标准状况下,22.4L氢气含有氢原子个数为2NA
D、11.2L氢气一定含有NA个氢原子
10、能区分胶体和溶液的方法是()
A、静置,有沉淀现象的是胶体
B、有丁达尔现象的是胶体
C、能透过滤纸的是溶液
D、用肉眼观察,均匀透明的是溶液
11、、下列关于Fe(OH)3胶体的制备,正确的操作是()
A、将FeCl3溶液滴入蒸馏水中即可
B、将FeCl3溶液滴入热水中,得到黄色液体即可
C、将FeCl3溶液滴入沸水中,得到红褐色液体即可
D、将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可
12、
(1)1.5molH2SO4的质量是_____________,其中含有__________molH,含有_______g氧元素。
(2)9.03×
1023个氨分子含___________摩尔氨分子,____________摩尔氢原子,________摩尔质子,________________个电子。
(3)__________molCO2中含有3g碳。
标况下,___________LCO2中含有0.25mol氧原子,____________molCO2中含有3.01×
1023个CO2分子,它的质量是______________。
13、按下列化学反应基本类型依次填入四个化学方程式,要求后一个反应的反应物必须含有前一个反应的生成物:
(1)分解反应:
_______________________________________________________。
(2)置换反应:
_______________________________________________________