化学第八章 第一节 怎样解探究条件实验题Word文档下载推荐.docx
《化学第八章 第一节 怎样解探究条件实验题Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《化学第八章 第一节 怎样解探究条件实验题Word文档下载推荐.docx(12页珍藏版)》请在冰豆网上搜索。
请回答下列问题。
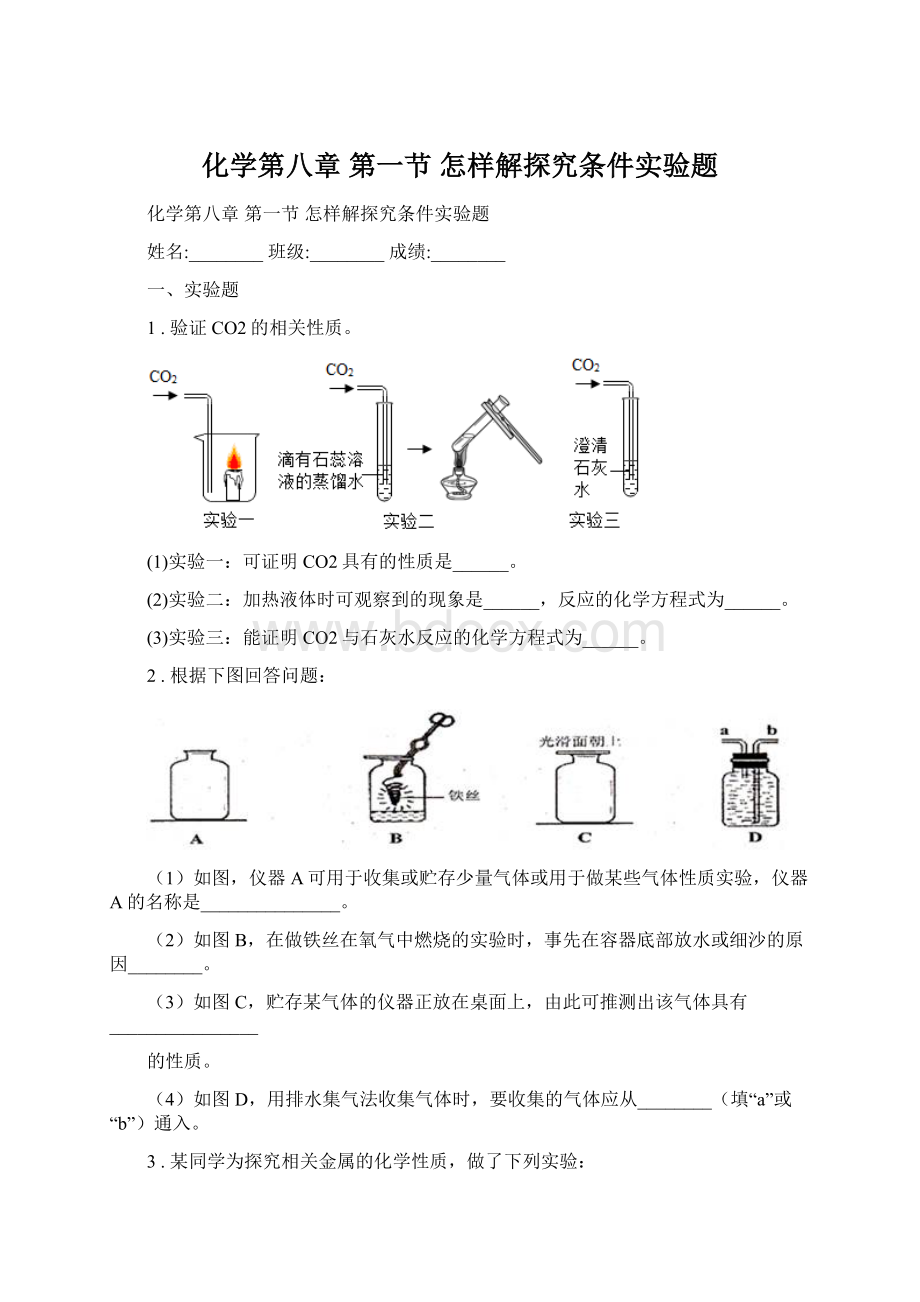
(1)若用高锰酸钾制取氧气,你认为还需增加的仪器是__,实验时该装置试管口应放一团棉花,其目的是__;
用高锰酸钾制取氧气的化学方程式为__。
用图2所示装置收集氧气,氧气应从__(填“a”或“b”)端导入。
(2)若要组装一套二氧化碳的发生和收集装置,可选择图1中的___(填标号)。
实验室制取二氧化碳的化学方程式为___。
(3)某同学借助干燥管、烧杯、铜网等仪器装配了一个在实验室中制取二氧化碳气体的装置,如图3所示。
在干燥管内的铜网上应盛放___;
若将铜网换成铁网,会产生什么后果?
___。
二、科学探究题
5.酸、碱、盐的性质实验练习时,某同学发现实验台上摆放的药品中
如图
,有一装溶液的试剂瓶标签破损,于是决定对这瓶溶液进行实验探究:
(提出问题)这瓶溶液是什么呢?
(获得信息)酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
(提出猜想)这瓶溶液是:
猜想一:
氯化钠溶液;
猜想二:
氢氧化钠溶液;
猜想三:
碳酸钠溶液。
(1)小丽取样滴加无酚酞试液,溶液呈红色,得出结论:
该溶液不可能是______溶液,理由是______。
(2)小刚另取样滴加稀盐酸有______产生,小刚于是得出结论:
该溶液是碳酸钠溶液,反应的化学方程式为______。
(3)小青认为小刚的结论不完全正确,理由是______,相关反应方程式为______。
小组同学讨论后一致认为还需要进行如下实验:
(继续探究)
另取样加入过量的CaCl2溶液,观察到有______产生,设计这一步骤的目的是______,涉及的化学方程式为______;
静置后,取上层清液,滴入______试液,溶液呈红色。
(实验结论)这瓶溶液是______。
(探究启示)实验取完药品后应______。
(实验反思)配制溶液时,标签上不仅要有溶液名称,还应有______。
6.碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质.
(查阅资料)
①Na2CO3+CaCl2═CaCO3↓+2NaCl
②2NaHCO3
Na2CO3+CO2↑+H2O
③Ca(HCO3)2
易溶于水.
④CaCl2溶液分别与NaHCO3、Na2CO3溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
NaHCO3
Na2CO3
0.1%
1%
5%
CaCl2
无明显现象
有浑浊
有浑浊,有微小气泡
有沉淀
有沉淀,有大量气泡
(进行实验)
序号
实验装置
主要实验步骤
实验现象
实验1
向2支试管中分别加入少量Na2CO3和
NaHCO3溶液,再分别滴加盐酸
2支试管中均有气泡产生
实验2
向Ⅱ中加入试剂a,向Ⅰ中加入少量Na2CO3或NaHCO3固体,分别加热一段时间
Na2CO3受热时Ⅱ中无明显现象
NaHCO3受热时Ⅱ中出现浑浊
实验3
向Ⅱ中加入试剂a,向Ⅰ中加入少量5%的NaHCO3溶液,再滴加5%的CaCl2溶液
Ⅰ中出现浑浊,有气泡产生Ⅱ中出现浑浊
(解释与结论)
(1)实验1中,NaHCO3与盐酸反应的化学方程式为_____.
(2)实验2中,试剂a为_____.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为:
2NaHCO3+CaCl2═_____+_____+_____+H2O
(反思与评价)
(1)实验2中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为_____(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是_____.
(3)用2种不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为:
①_____.
②_____.
7.《天工开物》中记载的“倭铅”即是金属锌,说明我国炼锌在明代就出现。
探究一
用锌制取氢气甲同学拟用如图实验装置完成制取氢气和测量生成气体体积实验:
(1)写出锌与稀硫酸反应的化学方程式____。
(2)装置连接顺序是:
A→___→___→D(填字母)。
探究二硫酸铜对氢气生成速率的影响
乙同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率,为此展开探究。
(设计实验)
在锥形瓶中分别放入足量的、等质量的、颗粒大小相同的锌粒,再向分液漏斗中加入由31.5%的稀硫酸,不同体积水、5%的硫酸铜溶液组成的混合液,试剂用量记录如下表:
混合液(试管编号)
①
②
③
④
⑤
31.5%的H2SO4溶液/mL
10
V1
5%的CuSO4溶液/mL
3.6
3.8
4.0
4.2
4.4
蒸馏水/mL
16.4
16.2
16.0
15.8
V2
收集70mL水所用时间/s
21.20
20.45
19.69
20.49
21.33
(3)表中的V1=____mL,V2=____mL。
(分析与结论)
(4)表中____组反应速率最快,原混合液中H2SO4和CuSO4溶质质量比为____(最简整数比)。
(提示:
31.5%的H2SO4溶液和5%的CuSO4溶液密度均为1.2g/mL)。
探究三锌与硫酸铜溶液反应
丙同学取打磨过的锌片按下表内容进行对比实验:
实验
项目
硫酸铜溶液
溶质质量分数
是否
添加稀硫酸
锌表面产生的现象
1.6%
否
黑色物质
加2滴
红色物质,有极少量的气泡
8%
红褐色物质
光亮红色物质,有少量的气泡
16%
⑥
光亮红色物质,有较多气泡
(5)锌与硫酸铜溶液反应要产生红色的物质,需要的条件是___。
(6)根据第⑤组实验判断,硫酸铜溶液可能显___(选填:
“酸”、“碱”或“中”)性。
8.化学小组用如图图所示装置进行木炭和氧化铜反应的实验
查阅资料:
①氧化铜和稀硫酸充分反应后生成硫酸铜和水
②氢氧化钠(NaOH)溶液能和二氧化碳后应,且无明显现象
在进行实验时,他们首先将碳和氧化铜碾成粉末,且混合均匀后,再开始实验,这样做的目的是______________________________;
充分反应后,化学小组的同学对试管内的固体成分进行了探究Ⅰ,对生成气体的成分进行了探究II,按要求填空。
探究I:
试管内固体的成分是什么?
(作出猜想)
Cu
_______________;
Cu和CuO
(实验验证)
实验操作
实验结论
取少量的固体加入试管中,然后加入过量稀硫酸,振荡
_____________。
猜想三成立
探究II:
生成的气体中是否含有一氧化碳?
通过上面的实验分析,生成的气体中一定含有二氧化碳,是否含有一氧化碳,小组同学进行了下列实验
结论
收集碳和氧化铜反应后产生的气体,再将气体通入上面装置中
_____________________________________________________。
生成的气体中有一氧化碳
则B中石灰水的作用是________,A中反应的化学方程式为____________。
(实验反思)从环保的角度思考,该装置的缺陷是___________。
9.元旦联欢会上,化学老师给同学们表演了一个“水能生火”的魔术(如图所示),
他将包有过氧化钠(Na2O2)粉末的脱脂棉放在石棉网上,向棉花上滴了几滴水,棉花立刻燃烧了起来。
同学们产生了浓厚的兴趣,为什么脱脂棉会燃烧起来呢?
(提出猜想)
a.小明认为过氧化钠(Na2O2)与水反应生成了可以支持燃烧的物质。
b.小刚又根据燃烧的条件,对小明的猜想进行了补充:
______。
(实验与分析)同学们设计了图的实验装置。
(1)打开分液漏斗的活塞,控制水滴加的速度,看到试管中有气泡产生,将带火星的木条靠近P出口,看到木条复燃,你推测此气体可能是_____。
(2)实验中还观察到,烧杯中的导气管口有气泡冒出,产生这一现象的原因是__________。
(3)完成了以上实验,老师介绍该反应的产物一共有两种,于是同学们又展开了进一步的研究,继续探究反应后生成的另一种物质。
请你回答:
另一种产物必含的元素是________,依据是_____________。
(老师介绍)过氧化钠不仅可以和水发生反应,也可以和二氧化碳反应,也能生成氧气。
因此,过氧化钠经常被用于潜水艇和防毒面具中提供氧气。
(补充实验)
明确了以上性质,小芳同学又设计了一个实验(如图):
将一团包有过氧化钠的粉末的棉花塞到漏斗的管中,漏斗下方点燃一支短蜡烛(蜡烛火焰与棉花不接触)。
请回答:
棉花____________(填“能”或“不能”)燃烧。
这主要是因为蜡烛燃烧生成能与过氧化钠(Na2O2)反应的物质___________________,同时反应放热。
10.某化学兴趣小组进行“铁丝在氧气中燃烧”的实验,并进行了一些探究活动,请你一同参与。
(1)铁丝在氧气中燃烧实验的示意图如图,图中螺旋状铁丝的末端系一根火柴的作用是_____;
集气瓶中先放一些水的作用是_____。
(探究一):
铁丝燃烧是否需要纯氧?
(实验内容):
取直径为0.38mm的铁丝,分别在体积分数为90%、70%、60%、55%的氧气中实验。
实验现象如表所示:
O2%
90%
70%
60%
55%
燃烧剧烈、燃烧时间长,效果好
燃烧比90%弱,燃烧时间短,实验成功
燃烧比70%弱,燃烧时间更短,实验成功
难以燃烧,只是发红
(结论1):
就0.38mm铁丝而言,铁丝燃烧对氧气体积分数的要求是_____
(选填“>”“=”或“<”)55%,且氧气浓度越大,燃烧现象越_____。
(填“剧烈”或“不剧烈”);
(讨论)如果实验