届高考化学领军一轮复习同步专题24 陌生化学方程式的书写精讲深剖Word下载.docx
《届高考化学领军一轮复习同步专题24 陌生化学方程式的书写精讲深剖Word下载.docx》由会员分享,可在线阅读,更多相关《届高考化学领军一轮复习同步专题24 陌生化学方程式的书写精讲深剖Word下载.docx(31页珍藏版)》请在冰豆网上搜索。
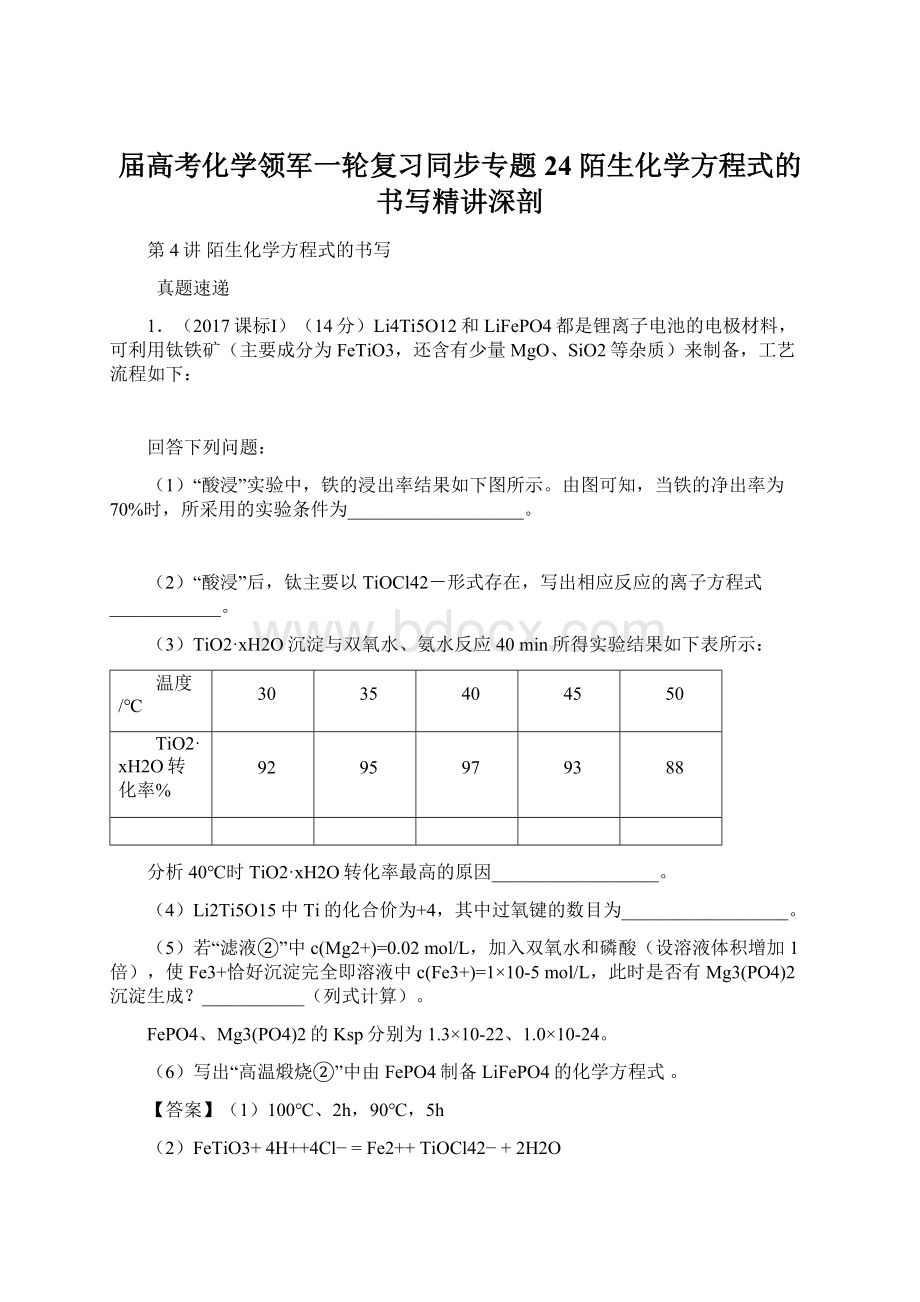
50
TiO2·
xH2O转化率%
92
95
97
93
88
分析40℃时TiO2·
xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×
10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?
___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×
10-22、1.0×
10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式。
【答案】
(1)100℃、2h,90℃,5h
(2)FeTiO3+4H++4Cl−=Fe2++TiOCl42−+2H2O
(3)低于40℃,TiO2·
xH2O转化反应速率随温度升高而增加;
超过40℃,双氧水分解与氨气逸出导致TiO2·
xH2O转化反应速率下降
(4)4
(5)Fe3+恰好沉淀完全时,c(PO43-)=mol·
L−1=1.3×
10-17mol·
L−1,c3(Mg2+)×
c2(PO43-)=(0.01)3×
(1.3×
10-17)2=1.7×
10-40<Ksp[Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。
(6)2FePO4+Li2CO3+H2C2O42LiFePO4+H2O↑+3CO2↑
(3)温度是影响速率的主要因素,但H2O2在高温下易分解、氨水易挥发,即原因是低于40℃,TiO2·
xH2O转化反应速率下降;
(4)Li2Ti5O15中Li为+1价,O为-2价,Ti为+4价,过氧根(O22-)中氧元素显-1价,设过氧键的数目为x,根据正负化合价代数和为0,可知(+1)×
2+(+4)×
5+(-2)×
(15-2x)+(-1)×
2x=0,解得:
x=4;
(5)Ksp[FePO4]=c(Fe3+)×
c(PO43-)=1.3×
10-2,则c(PO43-)==1.3×
10-17mol/L,Qc[Mg3(PO4)2]=c3(Mg2+)×
10-17)2=1.69×
10-40<1.0×
10—34,则无沉淀。
(6)高温下FePO4与Li2CO3和H2C2O4混合加热可得LiFePO4,根据电子守恒和原子守恒可得此反应的化学方程式为2FePO4+Li2CO3+H2C2O42LiFePO4+H2O↑+3CO2↑。
考纲解读
考点
内容
说明
氧化还原反应
了解氧化还原反应的本质。
了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
氧化还原反应方程式的书写是每年必考内容
考点精讲
考点一根据题目信息书写方程式
根据题目中的叙述,找出关键的字词,知道生成物是什么,写出化学方程式。
典例1(2018届四川省成都市第七中学高三下学期三诊模拟考试)海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水淡化的方法有蒸馏法、________________(填1种方法)。
(2)海水制得的饱和氯化钠溶液可以利用电解法直接制取次氯酸钠,制取的离子方程式为___________。
(3)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
______________
□Br2+□Na2CO3==□NaBrO3+□_____+□______
(4)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。
以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
己知:
常温下0.010mol/L金属离子在不同pH下的沉淀情况如下:
物质
开始沉淀
沉淀完全
Fe(OH)3
2.7
3.7
Fe(OH)2
7.6
9.6
Mn(OH)2
8.3
9.8
Mg(OH)2
①步骤②中需控制pH=9.8,其目的是_________________________。
②用NaClO氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式为___________________。
③步骤③可以将SOCl2与MgCl2·
6H2O混合加热制取无水MgCl2,SOCl2的作用是___________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。
除去0.2molCO(NH2)2时消耗NaClO__________g。
⑤如果沉淀0.010mol/LMgCl2溶液,根据表格中的数据计算,当pH=11.2时溶液中c(Mg2+)=____mol/L。
【答案】离子交换法或电渗析法Cl-+H2OClO-+H2↑3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去或使Mg2+以外杂质转化为氢氧化物沉淀而除去ClO-+2Fe2++5H2O=2Fe(OH)3↓+Cl-+4H+吸收MgCl2·
6H2O中结晶水,并产生HCl气体抑制Mg2+的水解44.71.0×
10-5.2
(3)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,Br元素部分由0价升高到+5价,另一部分从0价降低到-1价,则生成的NaBrO3与NaBr的物质的量之比为1:
5,所以配平方程式为:
3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑,故答案为:
3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;
(4)盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;
①步骤②中需控制pH=9.8在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,即控制pH=9.8的目的:
除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;
故答案为:
②加入次氯酸钠会氧化亚铁离子为三价铁,则次氯酸钠与Fe2+、H2O反应生成Fe(OH)3、Cl-和H+,反应的离子方程式为:
ClO-+2Fe2++5H2O=2Fe(OH)3↓+Cl-+4H+;
③镁离子水解生成氢氧化镁和氢离子,Mg2++2H2O⇌Mg(OH)2+2H+,水解反应属于吸热反应,加热温度升高,水解程度增大,通入HCl时,增加了溶液中的c(H+),能使水解平衡逆向移动,抑制Mg2+水解,HCl还能带出水份,最终得到无水MgCl2;
吸收MgCl2·
6H2O中结晶水,并产生HCl气体抑制Mg2+的水解;
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.2molCO(NH2)2消耗NaClO为0.6mol,则m(NaClO)=nM=0.6mol×
74.5g/mol=44.7g,故答案为:
44.7;
⑤根据表格数据可知,pH=9.6时,c(OH-)=10-4.4,镁离子开始沉淀,则Ksp[Mg(OH)2]=0.01×
(10-4.4)2=c(Mg2+)×
(10-2.8)2,解得:
c(Mg2+)=1.0×
10-5.2mol/L,故答案为:
1.0×
10-5.2。
典例2(2018届湖北省鄂州市高三下学期第三次模拟考试)某种电镀污泥中主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜、粗碲等,以实现有害废料的资源化利用,工艺流程如下:
已知:
煅烧时Cu2Te发生的反应为Cu2Te+2O22CuO+TeO2。
(1)煅烧时Cr2O3发生反应的化学方程式为______________。
(2)为提高酸浸速率,可采用的措施是____________(答出两条)。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有________(填化学式)。
电解沉积过程中析出单质铜的电极为_______极。
(4)工业上用铬酸钠(Na2Cr2O7)母液生产各酸钾(K2Cr2O7)工艺流程如下图所示:
通过冷却结晶能析出大量K2Cr2O7的原因是____________。
(5)测定产品中K2Cr2O7含量的方法如下:
称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·
L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。
(已知Cr2O72-被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为_____________。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中K2Cr2O7的纯度为_______﹪(已知M(K2Cr2O7)=294,计算结果保留三位有效数字)。
(6)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。
已知c(Cr3+)为3×
10-5mol·
L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全_________(填“是”或“否”)。
[已知:
Ksp[Fe(OH)3]=4.0×
10-38,Ksp[Cr(OH)3]=6.0×
10-31]。
【答案】2Cr2O3+3O2+4Na2CO34Na2CrO4+4CO2适当增大稀硫酸的浓度、升高温度、搅拌等CuSO4(也可答“CuSO4和H2SO4”)阴在低温条件下K2Cr2O7的溶解度在整个体系中最小,且K2Cr2O7的溶解度随温度的降低而显著减小。
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O49.0是
【解析】分析:
某种电镀污泥中主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜、粗碲等,根据流程图,煅烧时Cu2Te发生的反应为Cu2Te+2O22CuO+TeO2,Cr2O3与纯碱和空气中的氧气反应生成Na2CrO4,Na2CrO4酸化后生成Na2Cr2O7溶液;
沉渣