学年高中化学第三章第二节第3课时《铁的重要化合物》知识点归纳及例题解析新人教版必修1文档格式.docx
《学年高中化学第三章第二节第3课时《铁的重要化合物》知识点归纳及例题解析新人教版必修1文档格式.docx》由会员分享,可在线阅读,更多相关《学年高中化学第三章第二节第3课时《铁的重要化合物》知识点归纳及例题解析新人教版必修1文档格式.docx(9页珍藏版)》请在冰豆网上搜索。
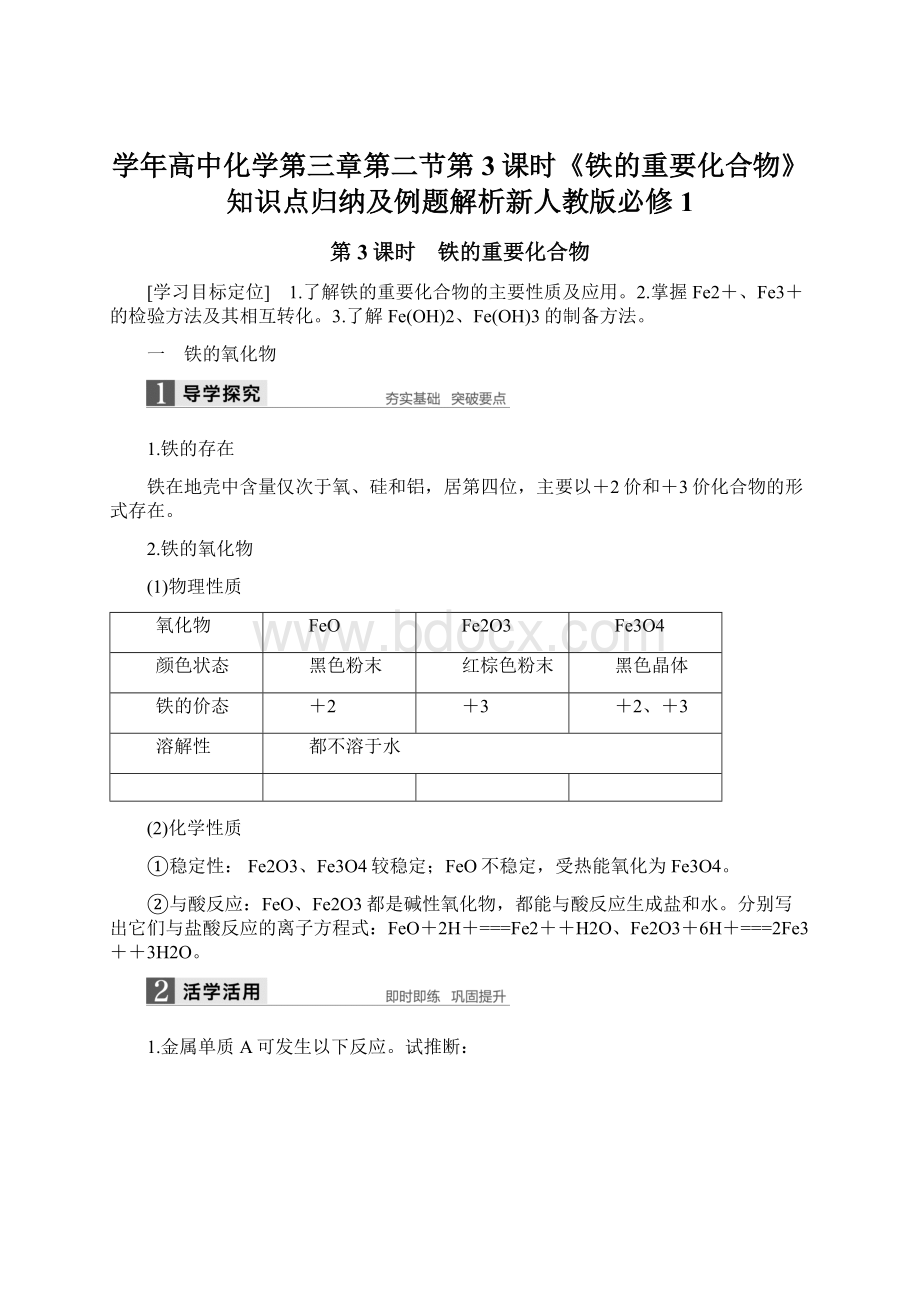
红棕色粉末
黑色晶体
铁的价态
+2
+3
+2、+3
溶解性
都不溶于水
(2)化学性质
①稳定性:
Fe2O3、Fe3O4较稳定;
FeO不稳定,受热能氧化为Fe3O4。
②与酸反应:
FeO、Fe2O3都是碱性氧化物,都能与酸反应生成盐和水。
分别写出它们与盐酸反应的离子方程式:
FeO+2H+===Fe2++H2O、Fe2O3+6H+===2Fe3++3H2O。
1.金属单质A可发生以下反应。
试推断:
(1)A、B、C、D、E分别是(写化学式,B写主要成分):
A________、B________、C________、D________、
E________。
(2)写出反应③和⑤的离子方程式:
③_____________________________;
⑤______________________。
答案
(1)Fe Fe2O3 Fe3O4 Cu H2
(2)Fe+Cu2+===Fe2++Cu Fe+2H+===Fe2++H2↑
解析 推断题的解题思路:
根据物质的物理性质(特别是色、态)和化学性质(相互转化关系、反应条件等),找出具有特征条件的物质,再由相互转化关系逐步推断。
如本题中结合B、C的颜色及与CuCl2、稀盐酸反应的性质可推知A为Fe。
二 铁的氢氧化物
1.铁的氢氧化物的制备
实验操作
实验现象
结论(用化学方程式表示)
试管中有红褐色沉淀产生
Fe3++3OH-===Fe(OH)3↓
试管中先生成白色沉淀,迅速变成灰绿色,最后变成红褐色
Fe2++2OH-===Fe(OH)2↓(白色)、4Fe(OH)2+O2+2H2O===4Fe(OH)3
2.氢氧化铁和氢氧化亚铁都为不溶性碱,由此可推测它们具有的性质是
(1)都能与酸反应生成相应的盐和水,它们分别与盐酸反应的离子方程式是①Fe(OH)3+3H+===Fe3++3H2O,②Fe(OH)2+2H+===Fe2++2H2O。
(2)不稳定,受热易分解,其化学方程式分别为
①Fe(OH)3:
2Fe(OH)3Fe2O3+3H2O,
②Fe(OH)2:
Fe(OH)2FeO+H2O。
归纳总结
铁的氢氧化物的性质及制取
(1)氢氧化铁和氢氧化亚铁的物质类别是不溶性碱,其主要化学性质为都能与酸反应生成盐和水,不稳定,受热易分解。
(2)铁的氢氧化物的制取方法是相应盐和碱反应,制取氢氧化亚铁时,常得到红褐色沉淀是因为Fe(OH)2极易被空气中的O2氧化成Fe(OH)3,所以为了防止NaOH溶液加入时带入空气,可将吸有NaOH溶液的长胶头滴管伸入到FeSO4液面下,再挤出NaOH溶液。
2.化合物A、B组成元素相同,且B为白色。
C是一种与B含有相同价态该金属元素的硫酸盐,向C中加入适量的
NaOH溶液,可观察到生成的沉淀迅速变为灰绿色,最后变为红褐色沉淀A,加热A可得红棕色粉末D。
回答下列问题:
(1)写出各物质的化学式:
A________、B________、C________、D________。
(2)写出B转化为A的化学方程式:
_______________________________________。
写出A受热分解的化学方程式:
_____________________________________________。
答案
(1)Fe(OH)3 Fe(OH)2 FeSO4 Fe2O3
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3Fe2O3+3H2O
解析 解答本题的关键是抓住C与NaOH溶液反应的特征现象,确定A是Fe(OH)3,C是FeSO4,B为Fe(OH)2,D为Fe2O3。
3.根据下列实验装置和操作,回答有关问题。
按图中所示装置,用两种不同的操作分别进行实验,观察B容器中的现象。
(1)先夹紧止水夹a,再使A容器中开始反应。
实验中B容器中观察到的现象是________________________________________________________________________;
B容器中发生反应的离子方程式是___________________________________________。
(2)打开止水夹a,使A容器开始反应一段时间后再夹紧止水夹a,实验中观察到的现象是________________。
B容器中发生反应的离子方程式是____________________________________________。
答案
(1)容器A中的溶液进入B容器中,有白色沉淀生成,沉淀迅速变为灰绿色,最后变成红褐色 2OH-+Fe2+===Fe(OH)2↓;
4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)a打开时,观察到B容器中管口有气泡产生,再夹紧a时,溶液进入B容器中产生白色沉淀,且长时间不变 2OH-+Fe2+===Fe(OH)2↓
解析 此题是一道关于制备Fe(OH)2的创新实验题。
制备Fe(OH)2可有多种不同的方法,但有一共同的特点就是在操作时防止与空气接触,这样才能得到白色的Fe(OH)2沉淀。
本题中当NaOH中空气未排尽时,NaOH与FeSO4反应的产物Fe(OH)2只能短暂存在,但当通入H2一段时间后,即认为空气已排净,生成的Fe(OH)2能较长时间存在。
三 铁盐和亚铁盐
1.Fe2+和Fe3+的检验
向5mLFeCl2溶液中加入KSCN溶液,现象是溶液无明显变化;
向5mLFeCl3溶液中加入KSCN溶液,现象是溶液变为红色。
2.Fe3+的氧化性
在盛有氯化铁溶液的试管中,先加入KSCN溶液,再加入铁粉,现象是溶液先变红后褪色,反应的离子方程式是Fe3++3SCN-===Fe(SCN)3,2Fe3++Fe===3Fe2+;
若再向反应后的溶液中加入新制氯水,现象是溶液又变为红色,反应的离子方程式是2Fe2++Cl2===2Fe3++2Cl-。
1.Fe2+、Fe3+的检验方法
(1)观察法:
浅绿色溶液中含有Fe2+;
棕黄色溶液中含有Fe3+。
(2)加碱法:
若产生的白色沉淀迅速变为灰绿色,最后变为红褐色的为Fe2+;
若直接产生红褐色沉淀的为Fe3+。
(3)加KSCN:
无明显现象,再加新制氯水溶液变红色的为Fe2+;
若溶液变红色的为Fe3+。
2.Fe2+、Fe3+、Fe之间的相互转化关系
(1)Fe只具有还原性。
可被弱氧化剂(H+、S、Fe3+等)氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。
(2)Fe2+既有氧化性又有还原性。
可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+;
可被还原剂(Al、Zn、CO、C等)还原为Fe。
(3)Fe3+只具有氧化性,可被还原剂(Fe、Cu等)还原为Fe2+,被强还原剂(Al、Zn、CO等)还原为Fe。
4.将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应)。
试判断下列情况下,溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有____________________________________;
(2)若氯化铜有剩余,则容器中可能有_____________________________________;
(3)若氯化铁和氯化铜都有剩余,则容器中不可能有____________,可能有__________。
答案
(1)Fe3+、Cu2+
(2)Fe2+、Fe3+或Fe2+、Cu
(3)Fe、Cu Fe2+
解析 本题属于物质共存问题。
解答时应首先弄清物质间可能发生的反应,凡相互间能发生反应的物质就不可能大量共存。
本题涉及的反应有
①Fe+2FeCl3===3FeCl2
②Fe+CuCl2===Cu+FeCl2
③Cu+2FeCl3===2FeCl2+CuCl2
(1)若铁粉有剩余,则容器中不可能有Fe3+、Cu2+,因为它们能发生上述①②反应。
(2)若CuCl2有剩余,则容器中不可能有Fe,可能有Fe2+、Fe3+或Fe2+、Cu。
(3)若FeCl3和CuCl2均有剩余,则容器中不可能有Fe、Cu,可能有Fe2+。
四 铜盐
1.物理性质
硫酸铜、氯化铜、硝酸铜等铜盐溶于水;
铜绿的主要成分是Cu2(OH)2CO3,其难溶于水。
2.化学性质
(1)铜的化学性质不活泼,使用铜器皿比较安全。
(2)铜盐属于重金属盐,都有毒,原因是铜离子能与蛋白质作用,使蛋白质变性而失去生理活性。
5.下列说法正确的是( )
A.铜的化学性质活泼,不宜用铜制作盛食品的器皿
B.铜的导电能力不如铝
C.由于Cu2+有氧化性,所以用CuSO4来配制农药
D.因为Cu2+能使蛋白质变性,所以铜盐溶液有毒
答案 D
解析 金属铜的化学性质比较稳定,所以使用铜器皿比较安全;
铜属于重金属,铜盐有毒,因Cu2+会与蛋白质作用,使蛋白质变性。
1.下列关于铁矿石的说法正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.铁矿石的主要成分与铁锈的主要成分相同
C.磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色
D.Fe3O4俗称铁红
答案 C
2.证明某溶液中只含有Fe2+而不含有Fe3+的实验方法是( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.只需滴加KSCN溶液
C.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D.滴加酸性高锰酸钾溶液后溶液褪色
3.向200mL0.1mol·
L-1的Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为( )
A.1.44gB.1.6gC.2.82gD.4.36g
答案 B
解析 在实验过程中发生如下反应:
Fe2++2OH-===Fe(OH)2↓,加热、灼烧时又会发生下列变化:
Fe(OH)2―→Fe(OH)3―→Fe2O3,根据反应前后铁原子守恒从而可得所得固体的质量为1.6g。
4.向含有K+、Mg2+、Fe2+和Al3+的溶液中加入足量Na2O2微热并搅拌后,再加入过量稀盐酸,则溶液中离子的物质的量浓度发生变化的是( )
A.Mg2+B.K+C.Fe2+D.Al3+
解析 加入Na2O2发生反应:
2H2O+2Na2O2===4NaOH+O2↑,FeCl2+2NaOH===Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O===4Fe(OH)3,再加入盐酸:
Fe(OH)3+3HCl===FeCl3+3H2O,故原溶液中Fe2+转化为Fe3+,Fe2+的浓度减小,Fe3+的浓度增大;
Mg2+和Al3+与氢氧化钠分别生成氢氧化镁、氢氧化铝,但再加入盐酸时又发生中和反应而溶解,因此最终是不变化的。
5.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①②③B.①②④
C.①②③④D.②③④
解析 因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3