创新设计高考化学江苏专用二轮题型专攻微题型18 化学反应原理综合题含新题及解析Word格式.docx
《创新设计高考化学江苏专用二轮题型专攻微题型18 化学反应原理综合题含新题及解析Word格式.docx》由会员分享,可在线阅读,更多相关《创新设计高考化学江苏专用二轮题型专攻微题型18 化学反应原理综合题含新题及解析Word格式.docx(12页珍藏版)》请在冰豆网上搜索。
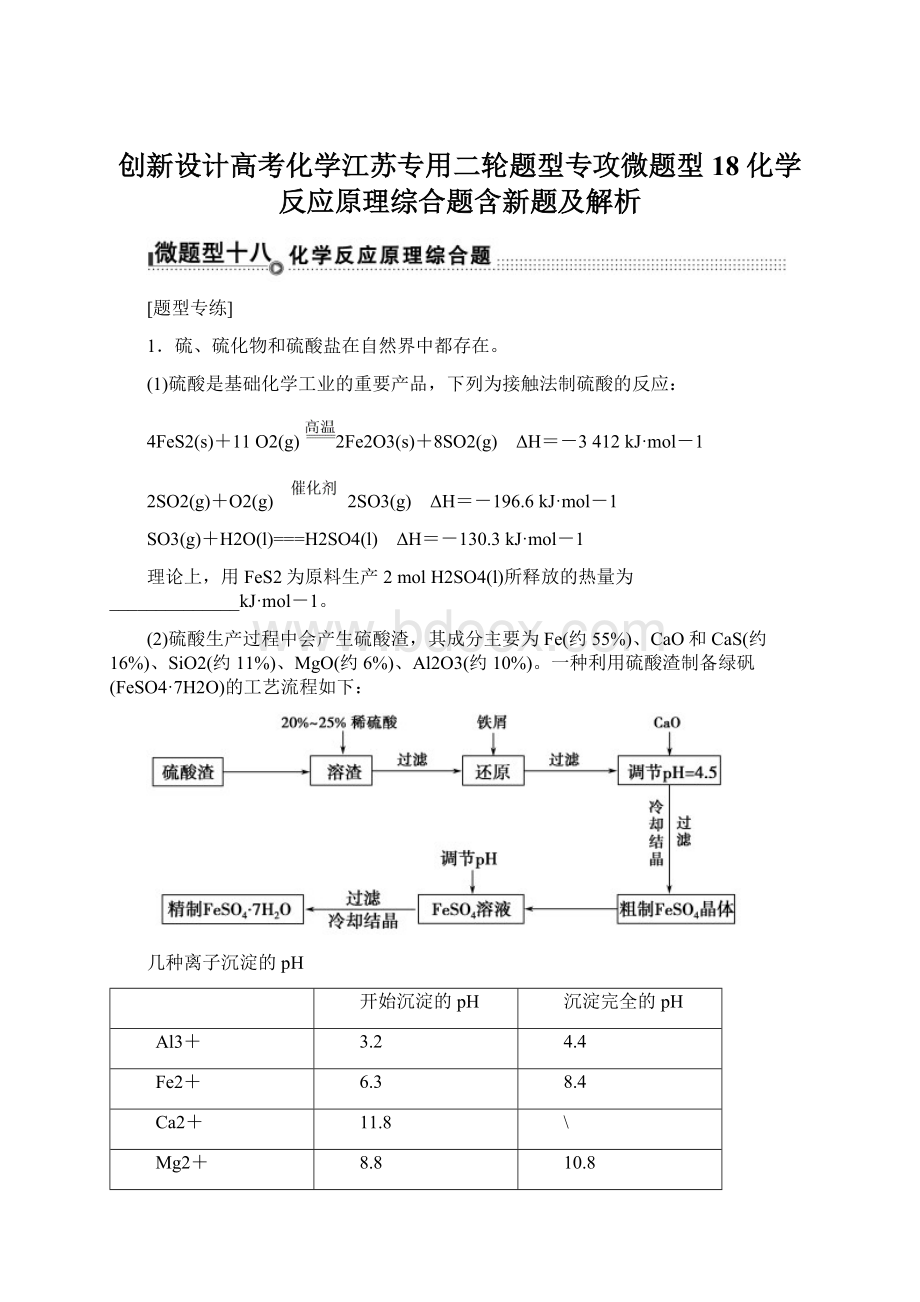
Al3+
3.2
4.4
Fe2+
6.3
8.4
Ca2+
11.8
\
Mg2+
8.8
10.8
回答下列问题:
①上述流程中加入铁屑时反应的离子方程式为__________________________。
②上述制备过程中加入CaO调节pH=4.5时,产生沉淀的主要成分为_______。
③精制FeSO4·
7H2O前,需向滤液中加入H2SO4调节pH,其目的是_________________________________________。
④研究发现,其他条件相同,结晶温度在70℃左右时硫酸亚铁纯度最高。
分析温度大于70℃时,硫酸亚铁纯度降低的主要原因可能为_____________________________________________。
(3)H2S是一种无色、有毒且有恶臭味的气体。
煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S产生。
某研究小组设计了一种硫化氢—空气燃料电池,总反应为2H2S+O2===2S+2H2O,简易结构如图所示。
①硫化氢应通入到电极________(填“a”或“b”)
②b极发生的电极反应式为_____________________________________。
解析
(1)根据盖斯定律可得,以FeS2为原料生产H2SO4(l)总的热化学方程式是2FeS2(s)+O2(g)+4H2O(l)===Fe2O3(s)+4H2SO4(l) ΔH=-2620.4kJ·
mol-1,生产2molH2SO4(l)所释放的热量为1310.2kJ·
(2)①硫酸渣酸溶后的溶液中含Ca2+、Fe2+、Fe3+、Al3+、Mg2+、H+,加入铁屑,与Fe3+、H+反应。
②pH=4.5时Al3+生成沉淀,同时也有CaSO4沉淀生成。
(3)由电子流动方向可知b电极为负极,再根据总方程式,H2S是还原剂,是负极反应物,发生氧化反应。
答案
(1)1310.2
(2)①Fe+2H+===Fe2++H2↑,Fe+2Fe3+===3Fe2+ ②CaSO4、Al(OH)3 ③抑制Fe2+水解 ④Fe2+被氧化成Fe3+的量增多
(3)①b ②H2S+O2--2e-===S+H2O
2.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
①Fe2O3(s)+3C(s)===2Fe(s)+3CO(g) ΔH1=+489.0kJ·
mol-1,②C(s)+CO2(g)===2CO(g) ΔH2=+172.5kJ·
则CO还原Fe2O3(s)的热化学方程式为______________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。
写出该电池的负极反应式:
__________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
测得CH3OH的物质的量随时间的变化如图所示。
①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KI________KⅡ。
(填“>
”、“=”或“<
”)
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器
甲
乙
反应物投入量
1molCO2、3molH2
amolCO2、bmolH2、cmolCH3OH(g)、cmolH2O(g)
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为________。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。
紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图甲。
在0~15h内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为________(填序号)。
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图乙。
①乙酸的生成速率主要取决于温度影响的范围是________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:
____________________。
解析
(1)由盖斯定律可知,①-②×
3得:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=ΔH1-3ΔH2=-28.5kJ·
(2)燃料电池中可燃物CO是负极反应物,发生氧化反应失去电子,电极反应式为CO+4OH--2e-===CO+2H2O。
(3)①从曲线上看,Ⅱ先到平衡,故Ⅱ的温度高,温度高CH3OH含量低,即温度升高平衡逆向移动,平衡常数减小,故KⅠ>
KⅡ。
②甲容器中,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始/mol 1 3 0 0
变化/mol x 3x x x
平衡/mol 1-x 3-3x x x
1-x+3-3x+x+x=4×
0.8 x=0.4mol
乙容器中,
起始/mol a b c c
相当/mol c+a 3c+b 0 0
由等效平衡可知:
c+a=1 3+c+b=3
由反应逆向进行可知,c>
0.4又由极限法可知0.4<
c<
1。
(4)由图甲可知,0~15h内,CH4产量Ⅱ>
Ⅲ>
Ⅰ,故速率Ⅱ>
Ⅰ。
(5)由图乙小于300℃时,催化剂活性和乙酸的生成速率相同的变化趋势,大于300℃,乙酸乙酸的生成速率增大,催化剂活性下降,故乙酸的生成速率主要取决于温度影响的范围是大于300℃。
③Cu2Al2O4中Cu为+1价,可被HNO3氧化。
答案
(1)Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-28.5kJ·
(2)CO+4OH--2e-===CO+2H2O
(3)①>
②0.4<
c≤1
(4)Ⅱ>
Ⅰ
(5)①300℃~400℃
②3Cu2Al2O4+32H++2NO===6Cu2++6Al3++2NO↑+16H2O
3.一氧化碳被广泛应用于冶金工业和电子工业。
(1)高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
①4CO(g)+Fe3O4(s)===4CO2(g)+3Fe(s) ΔH=akJ·
mol-
②CO(g)+3Fe2O3(s)===CO2(g)+2Fe3O4(s) ΔH=bkJ·
反应3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s)的ΔH=________kJ·
mol-1(用含a、b的代数式表示)。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:
2CH3OH(g)HCOOCH3(g)+2H2(g) ΔH>
第二步:
HCOOCH3(g)CH3OH(g)+CO(g) ΔH>
①第一步反应的机理可以用图1表示,中间产物X的结构简式为________。
图1
②在工业生产中,为提高CO的产率可采取的合理措施有________。
(3)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为_____________________________________。
图2 图3
(4)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:
首先用CO将33.2g样品在加热条件下还原为粗镍;
然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为________。
(5)为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。
若空气中含CO,则溶液中会产生黑色的Pd沉淀。
每生成5.3gPd沉淀,反应转移的电子数为________。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3所示。
这种传感器利用原电池原理,则该电池的负极反应式为________。
解析
(1)由目标反应中没有Fe3O4,故根据盖斯定律可知,(①×
2+②)/3即得目标反应,故ΔH=(2a+b)/3kJ·
(2)①由图示的过程可以看出,先是甲醇分解生成了H2和X,然后X与甲醇反应生成了H2和HCOOCH3,由此可以根据原子守恒得到中间产物X为甲醛,即HCHO。
②由甲醇为反应原料生成CO的两步反应都是气体物质的量增大的反应,同时又都是吸热反应,所以为了提高CO的产率应使反应向右进行,应采用的方法是升高温度,降低压强。
(3)由衍射图可以看出生成的产物比较多,但是其中能与盐酸反应生成两种盐的只能是FeAl2O4。
(4)由题目描述,首先是由CO还原三氧化二镍生成了粗镍,其反应方程式式为Ni2O3+3CO△,2Ni+3CO2,然后再使Ni与CO反应生成Ni(CO)4,反应方程式为Ni+4CO===Ni(CO)4由两个反应式可知在镍相同的情况下CO的物质的量之比为3∶8。
(5)生成5.3gPd,也就是0.05molPd,从化合价变化看,Pd是从+2价转化成了0价,即转移了两个电子,所以生成0.05molPb转移的电子物质的量为0.1mol,即电子数为0.1NA。
答案
(1)(2a+b)/3
(2)①HCHO ②升高温度,降低压强
(3)FeAl2O4+8H+===Fe2++2Al3++4H2O
(4)3∶8
(5)①6.02×
1022个或0.1NA
②CO+H2O-2e-===CO2+2H+
4.质子交换膜燃料电池广受关注。
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:
C(s)+1/2O2(g)===CO(g) ΔH1=-110.35kJ·
2H2O(l)===2H2(g)+O2(g) ΔH2=+571.6kJ·
H2O(l)===H2O(g) ΔH3=+44.0kJ·
则C(s)+H2O(g)===CO(g)+H2(g) ΔH4=________。
(2)燃料气(流速为1800mL·
h-1;
体积分数为:
50%H2,0.98%CO,1.64%O2,47.38%N2)中的CO会使电极催化剂中毒,使用CuO