有关镁、铝、铁的典型图像、推断、实验题专题Word文件下载.doc
《有关镁、铝、铁的典型图像、推断、实验题专题Word文件下载.doc》由会员分享,可在线阅读,更多相关《有关镁、铝、铁的典型图像、推断、实验题专题Word文件下载.doc(8页珍藏版)》请在冰豆网上搜索。
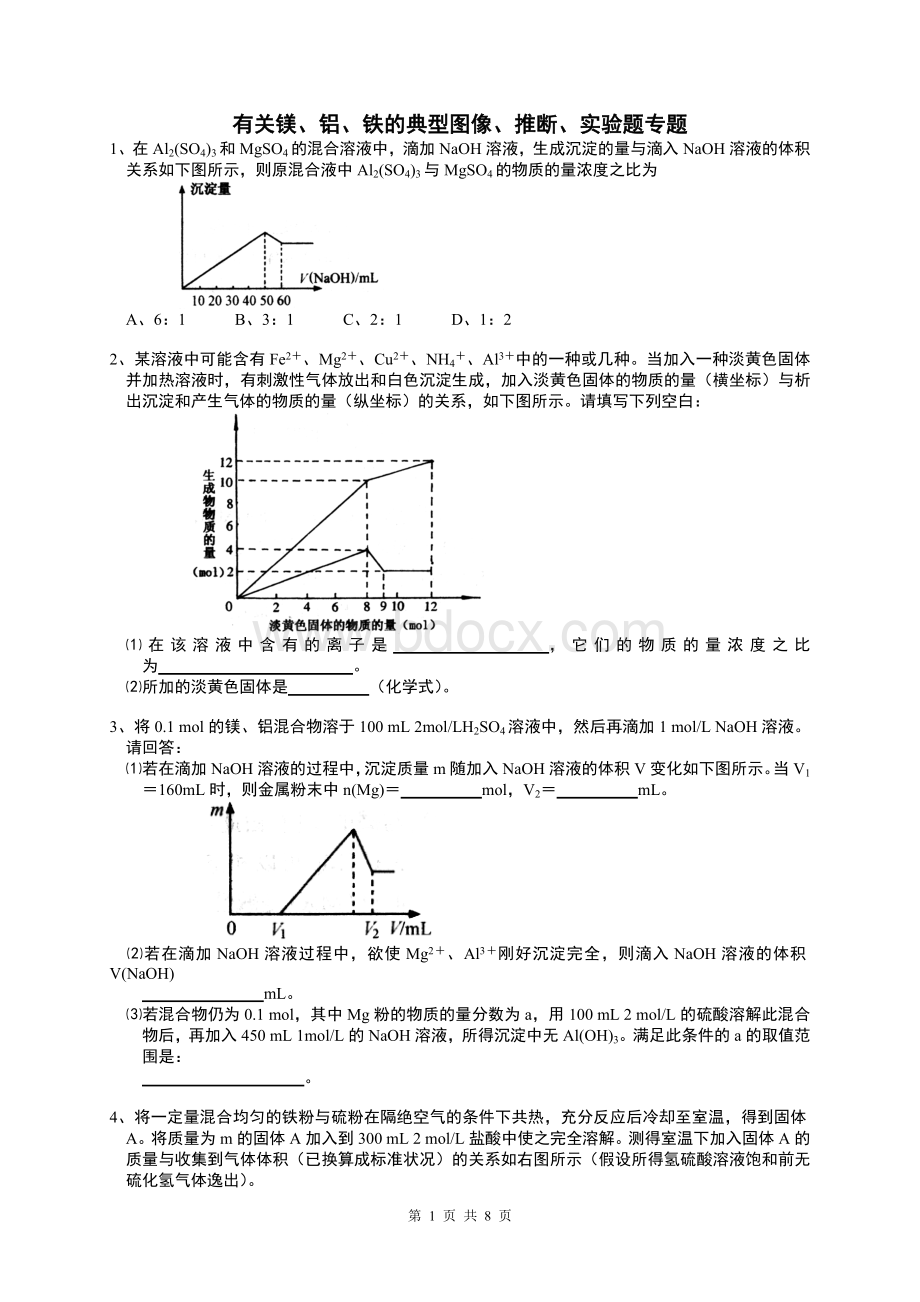
mL。
⑶若混合物仍为0.1mol,其中Mg粉的物质的量分数为a,用100mL2mol/L的硫酸溶解此混合物后,再加入450mL1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。
满足此条件的a的取值范围是:
。
4、将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。
将质量为m的固体A加入到300mL2mol/L盐酸中使之完全溶解。
测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
已知:
①加入固体A的质量m≤3.2g时,收集到的气体为H2;
②当m>3.2g时,收集到的气体为H2和H2S的混合气
体。
⑴3.2g固体A中所含的物质有 。
⑵3.2g固体A中各物质的物质的量分别为
,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为 (忽略溶液体积的变化)。
⑶当固体A全部溶于上述盐酸,且A的质量m>3.2g时,收集到的气体体积(标准状况下)
V= mL(用含m的代数式表示)。
5、如下图所示:
已知A、D、E、F是中学化学中常见的单质,B、C是氧化物,且B的式量是232。
请填空:
⑴A是 ,E是 。
(填化学式)
⑵D跟水反应的化学方程式为 。
⑶C电解时,每生成1molA,同时生成 molE。
6、黑色固体物质A有如下图所示的转化关系。
每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。
⑴写出B和C的化学式:
B ;
C 。
⑵写出反应④的离子方程式:
。
空气
沉淀
(红褐色)
B
N
溶液
沉淀a
反应Ⅲ
M
(白色)
A
滤液
(淡黄色)
反应Ⅰ
反应Ⅱ
C
A不足
7、A、B、C是常见的金属化合物的水溶液,A溶液的焰色为黄色。
M是常见的共价挥发性氢化物,N为M的最高价氧化产物的水溶液,将M分别通入A、B的反应如下图所示,M与C溶液不发生反应。
⑴写出化学式:
A ,B ,M ,N ;
⑵写出下列反应的离子方程式:
反应Ⅰ:
;
反应Ⅱ:
反应Ⅲ:
。
8、某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。
设计的简易实验装置如下图。
该实验的主要操作步骤如下:
①配制浓度均为1mol/L盐酸和醋酸溶液;
②用 量取10.00mL1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带ag,并系于铜丝末端,a的数值至少为 ;
④在广口瓶中装足量的水,按图连接好装置;
检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应
,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
。
⑵本实验中应选用 (填序号)的量筒。
A、100mL B、200mL C、500mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:
Vm= 。
⑷简述速率不等的原因 ,铜丝不与酸接触的原因是 。
9、在标准状况下进行甲、乙、丙三组实验:
三组各取30.0mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号
甲
乙
丙
合金质量/mg
255
385
459
产生气体体积/mL
280
336
⑴甲组实验中,盐酸 (选填“适量”“过量”或“不足量”,下同),理由是
。
要算出盐酸的物质的量浓度,题中可作计算依据的数据是 。
求得的盐酸的物质的量浓度为 。
⑵求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是 ,求得的Mg、Al的物质的量之比为 ;
⑶在丙组实验之后,向容器中加入1.00mol·
L-1NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶性固体,求滤液中各溶质的物质的量和所加入NaOH溶液的体积(写计算过程)。
10、下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色的铁粉变为黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。
请回答下列问题:
⑴B中发生反应的化学方程式为 。
⑵反应前后A中投放碎瓷片的目的是 。
⑶某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。
溶液颜色无明显变化,试解释原因 。
⑷上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气体即可检验H2的存在。
实验开始时,打开K1、K2,关闭K3,使反应先进行一段时间之后,必须进行
操作,方可关闭K2、打开K3,再收集气体。
当收集到半瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法是
。
⑸替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是 。
11、实验装置如下图所示。
先关闭K,使A中的反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。
实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
请回答下列有关问题:
⑴C中全部产物有 、 、 。
⑵本实验先使A中反应进行,再加热C装置,其目的是 。
⑶停止实验时,先打开K,再停止滴加浓硫酸,熄灭酒精灯,橡胶气胆B在实验中的作用是
。
⑷若无装置B、K,使用普通导管,本实验的尾气吸收装置可以选用上图中装置 (填写序号,多选扣分)。
⑸C中的Mg应放在不锈钢垫片上而不能直接接触管壁的原因是
1、[题意分析及答案:
]
[答案:
]D。
由50→60mL时,可知10mLNaOH溶液刚好溶解了Al(OH)3,故产生这些Al(OH)3需30mLNaOH,则在50mLNaOH溶液中有20mL与Mg2+反应,∴n(Al3+):
n(Mg2+)=1:
1,则Al2(SO4)3与MgSO4的物质的量浓度之比为1:
2。
2、[题意分析及答案:
由题意中有刺激性气体放出和白色沉淀生成,∴溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+;
所加淡黄色固体只能是Na2O2。
本题的图像实际为两个图合在一起,较上的是气体,较下的是沉淀。
由纵坐标可知:
n(Mg2+)=n[Mg(OH)2]=2mol,n(Al3+)=4mol-n[Mg(OH)2]=2mol。
当n(Na2O2)=8mol时,n(O2)=4mol,∴n(NH4+)=n(NH3)=10mol-n(O2)=6mol。
∴n(Mg2+):
n(Al3+):
n(NH4+)=1:
1:
3。
]⑴NH4+、Al3+、Mg2+,n(Mg2+):
⑵Na2O2。
3、[题意分析及答案:
⑴由图像可知:
V1mL的NaOH溶液是与过量H2SO4反应的,则与Mg、Al反应的为H2SO4:
0.2mol-0.16mol×
=0.12mol。
假设n(Mg)=xmol,n(Al)=ymol,则有方程组:
,解得:
x=0.06mol,y=0.04mol。
当加入V2mLNaOH溶液时,得到Mg(OH)2↓和NaAlO2,关系式为:
Mg2+~2OH-,Al3+~4OH-,∴V2=160mL+=440mL。
⑵当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4,关系式为2NaOH~H2SO4,
∴V(NaOH)==400mL。
⑶当所得沉淀中无Al(OH)3时,NaOH溶液过量,反应后生成的溶质为:
Na2SO4、NaAlO2。
则根据Na元素守恒:
n(NaOH)=0.45L×
1mol/L≥0.1L×
2mol/L×
2+0.1×
(1-a)mol。
解得a≥,则