高考化学全国通用版大一轮复习检测第六章 化Word文件下载.docx
《高考化学全国通用版大一轮复习检测第六章 化Word文件下载.docx》由会员分享,可在线阅读,更多相关《高考化学全国通用版大一轮复习检测第六章 化Word文件下载.docx(14页珍藏版)》请在冰豆网上搜索。
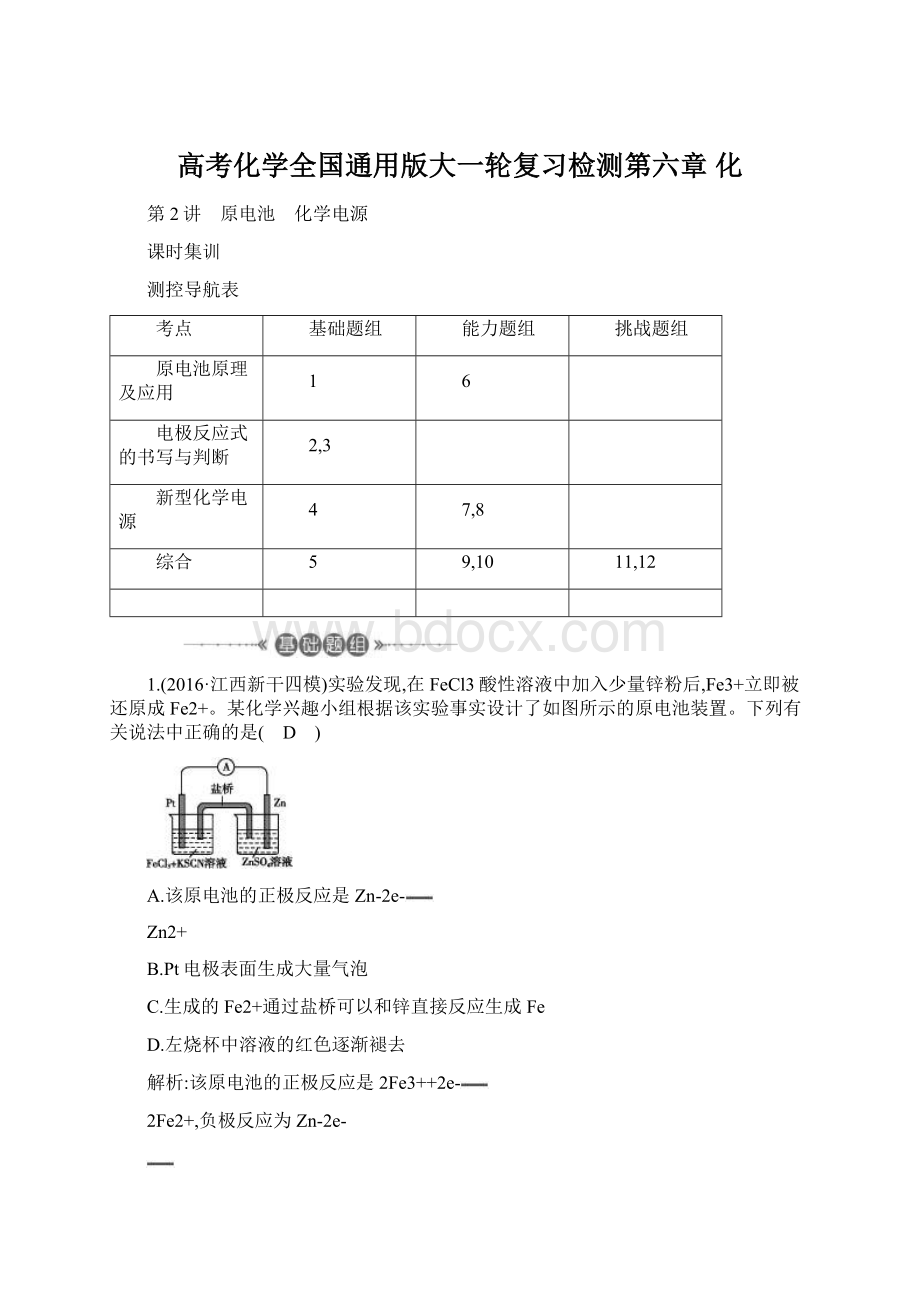
江西新干四模)实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+。
某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。
下列有关说法中正确的是( D )
A.该原电池的正极反应是Zn-2e-
Zn2+
B.Pt电极表面生成大量气泡
C.生成的Fe2+通过盐桥可以和锌直接反应生成Fe
D.左烧杯中溶液的红色逐渐褪去
解析:
该原电池的正极反应是2Fe3++2e-
2Fe2+,负极反应为Zn-2e-
Zn2+,故A错误;
该原电池反应为Zn+2FeCl3
2FeCl2+ZnCl2,该反应不生成气体,故B错误;
原电池中阳离子移动到正极,则生成的Fe2+在左边的烧杯中,故C错误;
左边烧杯中发生2Fe3++2e-
2Fe2+,则左烧杯中溶液的红色逐渐褪去,故D正确。
2.(2016·
湖南湘潭模拟)普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼作容器,中央插一根碳棒,碳棒顶端加一铜帽。
在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;
该电池工作时的总反应为Zn+2N
+2MnO2
[Zn(NH3)2]2++Mn2O3+H2O
关于锌锰干电池的下列说法中正确的是( B )
A.当该电池电压逐渐下降后,利用电解原理能重新充电复原
B.电池正极的电极反应式为2MnO2+2N
+2e-
Mn2O3+2NH3+H2O
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g
普通锌锰干电池是一次电池,所以当该电池电压逐渐下降后,不能充电复原,故A错误;
该原电池放电时,正极上二氧化锰得电子发生还原反应,电极反应式为2MnO2+2N
Mn2O3+2NH3+H2O,故B正确;
原电池工作时,电子从负极沿导线流向正极,故C错误;
由Zn+2NH3
-2e-
[Zn(NH3)2]2+知,外电路中每通过0.1mol电子,锌的质量理论上减小3.25g,故D错误。
3.(2016·
北京海淀区校级模拟)高效能电池的研发制约电动汽车的推广。
有一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应式为2C2H6+7O2+8KOH
4K2CO3+10H2O,有关此电池的推断正确的是( C )
A.负极反应式为14H2O+7O2+28e-
28OH-
B.放电过程中KOH的物质的量浓度不变
C.每消耗1molC2H6,则电路上转移的电子为14mol
D.放电一段时间后,负极周围的pH升高
负极上乙烷失电子发生氧化反应,电极反应式为C2H6+18OH-
-14e-
2C
+12H2O,正极反应式为2H2O+O2+4e-
4OH-,故A错误;
该反应中有水生成,导致溶液体积增大,KOH参加反应导致物质的量减少,所以KOH浓度降低,pH下降,故B、D错误。
4.(2016·
江西樟树模拟)Mg
AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源。
电池的总反应可表示为Mg+2AgCl
MgCl2+2Ag。
下列关于该电池的说法错误的是( C )
A.该电池工作时,正极反应为2AgCl+2e-
2Cl-+2Ag
B.镁电极作该电池负极,负极反应为Mg-2e-
Mg2+
C.有24gMg被氧化时,可还原得到108gAg
D.装备该电池的鱼雷在水中行进时,海水作为电解质溶液
由电池反应方程式看出,Mg是还原剂、AgCl是氧化剂,故金属Mg作负极,正极反应为2AgCl+2e-
2Cl-+2Ag,故A正确;
金属Mg作负极,其电极反应式为Mg-2e-
Mg2+,故B正确;
电极反应式Mg-2e-
Mg2+,24gMg即1mol被氧化时,转移电子是2mol,正极反应为2AgCl+2e-
2Cl-+2Ag,可还原得到216gAg,故C错误;
因为该电池能被海水激活,海水可以作为电解质溶液,故D正确。
5.如图所示,是原电池的装置图。
请回答:
(1)若溶液C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
;
反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)若需将反应:
Cu+2Fe3+
Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为 ,B(正极)极材料为 ,溶液C为 。
(3)若溶液C为CuCl2溶液,Zn是 极,Cu极发生 反应,电极反应为 。
反应过程溶液中c(Cu2+) (填“变大”“变小”或“不变”)。
(4)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
电池总反应为2CH3OH+3O2
2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为
。
若线路中转移2mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为 L。
(1)铁作负极,则该原电池反应是铁与稀硫酸置换氢气的反应,所以正极反应是H+得电子生成氢气,电极反应式为2H++2e-
H2↑;
溶液中氢离子放电,导致溶液中氢离子浓度减小,pH升高。
(2)Cu+2Fe3+
Cu2++2Fe2+设计成如题图所示的原电池装置,根据方程式中物质发生的反应类型判断,Cu发生氧化反应,作原电池的负极,所以A极材料是Cu,B极材料是比Cu不活泼的导电物质如石墨、Ag等即可。
溶液C中含有Fe3+,如FeCl3溶液。
(3)Zn比较活泼,在原电池中作负极,Cu作正极,正极发生还原反应,
Cu2+在正极得到电子变成Cu,电极反应为Cu2++2e-
Cu,Cu2+发生了反应,则c(Cu2+)变小。
(4)根据图中的电子流向知c是负极,是甲醇发生氧化反应:
CH3OH
-6e-+H2O
CO2+6H+,线路中转移2mol电子时消耗氧气0.5mol,标
准状况下体积为11.2L。
答案:
(1)2H++2e-
H2↑ 升高
(2)Cu 石墨 FeCl3溶液
(3)负 还原 Cu2++2e-
Cu 变小
(4)负极 CH3OH-6e-+H2O
CO2+6H+ 11.2
6.(2016·
甘肃兰州一中月考)某同学利用氧化还原反应:
2KMnO4+
10FeSO4+8H2SO4
2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图所示原电池,盐桥中装有饱和溶液。
下列说法正确的是( D )
A.b电极上发生还原反应
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的S
移向甲烧杯
D.a电极上发生的反应为Mn
+8H++5e-
Mn2++4H2O
根据氧化还原反应方程式可知,氧化剂是KMnO4,故a为正极,发生还原反应,A错误;
a为正极,b为负极,电子沿外电路从负极流向正极,即电子从b流向a,B错误;
原电池工作时,阴离子流向负极,即乙烧杯,C错误;
a电极为正极,Mn
得电子生成Mn2+,D正确。
7.(2016·
江西新干四模)如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2
Fe+2Li2S。
下列说法
不正确的是( C )
A.该装置将化学能转化为电能
B.电子移动方向是由a极流向b极
C.可以用水代替SO(CH3)2作溶剂
D.b极反应式是FeS2+4Li++4e-
Fe+2Li2S
分析装置图可知是原电池反应原理,是化学能转化为电能的装置,故A正确;
原电池中电子从负极沿外电路流向正极,原电池中a为负极,是由a极流向b极,故B正确;
Li是活泼金属,能与H2O反应,因此不能用水代替SO(CH3)2作溶剂,故C不正确;
b电极为正极,得到电子发生还原反应,电极反应式为FeS2+4Li++4e-
Fe+2Li2S,故D正确。
8.(2016·
河北唐山三模)用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,化学反应方程式为Pb+PbO2+4HBF4
2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质。
下列说法正确的是( C )
A.放电时,负极反应为PbO2+4H++2e-
Pb2++2H2O
B.充电时,当阳极质量增加23.9g时转移0.4mol电子
C.放电时,正极区电解质溶液的pH增大
D.充电时,Pb电极与电源的正极相连
放电时,负极上应该是金属铅发生失电子的氧化反应,不是还原反应,A错误;
充电时阳极发生氧化反应Pb2++2H2O-2e-
PbO2+4H+,产生1molPbO2,增重1mol×
239g/mol=239g,转移电子2mol,阳极质量增加23.9g时转移0.2mol电子,B错误;
放电时正极上发生还原反应,PbO2+4H++2e-
Pb2++2H2O,氢离子浓度减小,所以pH增大,C正确;
充电时,Pb电极和电源的负极相连,D错误。
9.(2016·
山东青岛期末)乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为2CH2
CH2+O2
2CH3CHO。
下列有关说法正确的是( B )
A.a电极发生还原反应
B.放电时,每转移2mol电子,理论上需要消耗28g乙烯
C.b极反应式为O2+4e-+2H2O
4OH-
D.电子移动方向:
电极a→磷酸溶液→电极b
由题图可以看出a极通入乙烯,作负极,放电时乙烯发生氧化反应生成乙醛,故A错误;
电解质溶液显酸性,b极通入氧气,放电后生成水,电极反应式为O2+4e-+4H+
2H2O,再结合总反应式,则转移2mol电子消耗乙烯28g,故B正确、C错误;
放电时电子从负极通过外电路向正极移动,电解质溶液中阴离子向负极移动,阳离子向正极移动,故D错误。
10.导学号16972150
(1)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。
二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93kW·
h/kg)。
若电解质为酸性,二甲醚直接燃料电池的负极反应为
,
一个二甲醚分子经过电化学氧化,可以产生 个电子的电量;
该电池的理论输出电压为1.20V,能量密度E= (列式计算。
能量密度=电池输出电能/燃料质量,
1kW·
h=3.6×
106J)。
(2)如图为钠硫高能电池的结构示意图。
该电池的工作温度为320℃左右,电池反应为2Na+xS
Na2Sx,正极的电极反应式为 。
M(由Na2O和Al2O3制得)的两个作用是
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
(1)电解质为酸性时,CH3OCH3失去电子生成CO2和H+;
CH3OCH3中的C为-2价,因此1个CH3OCH3可产生12个电子的电量;
1000gCH3OCH3输出的电能为1.2V×
×
12×
96500C/mo