qsr820法规解读_精品文档表格文件下载.xls
《qsr820法规解读_精品文档表格文件下载.xls》由会员分享,可在线阅读,更多相关《qsr820法规解读_精品文档表格文件下载.xls(42页珍藏版)》请在冰豆网上搜索。
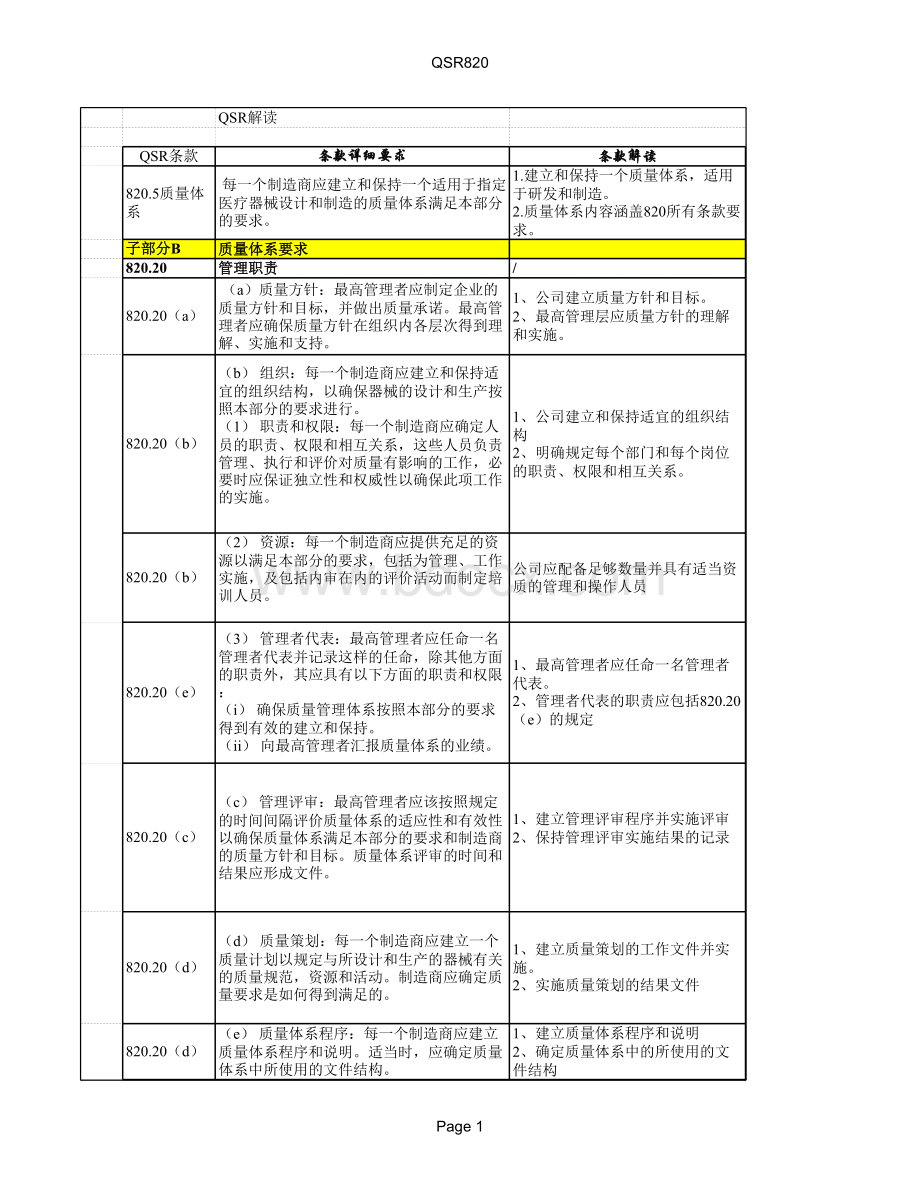
1、公司建立和保持适宜的组织结构2、明确规定每个部门和每个岗位的职责、权限和相互关系。
820.20(b)
(2)资源:
每一个制造商应提供充足的资源以满足本部分的要求,包括为管理、工作实施,及包括内审在内的评价活动而制定培训人员。
公司应配备足够数量并具有适当资质的管理和操作人员820.20(e)(3)管理者代表:
最高管理者应任命一名管理者代表并记录这样的任命,除其他方面的职责外,其应具有以下方面的职责和权限:
(i)确保质量管理体系按照本部分的要求得到有效的建立和保持。
(ii)向最高管理者汇报质量体系的业绩。
1、最高管理者应任命一名管理者代表。
2、管理者代表的职责应包括820.20(e)的规定820.20(c)(c)管理评审:
最高管理者应该按照规定的时间间隔评价质量体系的适应性和有效性以确保质量体系满足本部分的要求和制造商的质量方针和目标。
质量体系评审的时间和结果应形成文件。
1、建立管理评审程序并实施评审2、保持管理评审实施结果的记录820.20(d)(d)质量策划:
每一个制造商应建立一个质量计划以规定与所设计和生产的器械有关的质量规范,资源和活动。
制造商应确定质量要求是如何得到满足的。
1、建立质量策划的工作文件并实施。
2、实施质量策划的结果文件820.20(d)(e)质量体系程序:
每一个制造商应建立质量体系程序和说明。
适当时,应确定质量体系中所使用的文件结构。
1、建立质量体系程序和说明2、确定质量体系中的所使用的文件结构Page1QSR820820.22质量审核每一个制造商应建立质量审核程序并实施审核以确保质量体系符合质量体系要求并保持有效性。
进行质量审核的人员不应是直接负责受审核的事项。
必要时要采取纠正措施包括对不合格的再次审核。
应报告每次质量审核的结果,这样的结果应由负责受审核方的负责人进行评审。
质量审核和再次审核的结果和日期应形成文件。
1、建立质量审核并实施审核2、保持质量审核和再次审核结果的记录820.25人人员员820.25(a)(a)总则:
每一个制造商应具有充足的人力资源,人员应具备必要的教育背景、培训和经验以确保完成本部分所要求的活动。
公司应配备足够数量并具有适当资质(教育背景、培训、经验)的管理和操作人员;
审核过程进行评估820.25(b)(b)培训:
每一个制造商应建立一个识别培训需求的程序以确保所有人员能够接受适宜的培训以完成本职工作。
培训应形成文件。
(1)作为培训的一部分,工作人员应了解由于其不恰当的操作而造成的器械缺陷。
(2)进行验证和确认活动的人员应了解在工作中可能遇到的器械缺陷和故障。
1、建立人员培训的管理文件2、保持人员培训的记录子子部部分分C设设计计控控制制820.30设设计计控控制制子子部部分分D文文件件控控制制820.40文文件件控控制制/820.40(a)制造商应建立和保持程序已控制所有本部分要求的文件,程序应规定以下内容:
(a)文件的批准和发布:
每一个制造商应指定人员在文件发布前,评审文件的适应性和批准文件,以确定满足本部分的要求。
文件的批准包括批准的日期和批准人的签名应形成文件。
满足本部分要求的文件应在使用现场方便获得,或必要时获得。
应及时清除使用现场所有的作废文件,以防止非预期的使用。
建立和保持文件控制程序,文件控制程序的内容至少包括820.40(a)规定的内容Page2QSR820820.40(b)(b)文件更改:
除非有其他的特殊制定,否则,对文件的更改应得到原审批部门的评审和批准。
应采用适当的方式将文件的更改通知有关人员。
每一个制造商应保持文件的更改记录。
更改记录应包括对更改的描述,受更改影响的文件的识别,批准人的签字,批准日期和更改生效的时间。
建立和保持文件更改的控制程序,其内容至少要符合820.40(b)规定的内容子子部部分分E采采购购控控制制820.50采采购购控控制制子子部部分分F标标识识和和可可追追溯溯性性820.60标识在产品的接收、生产、销售和安装的过程中,每一个制造商应建立和保持标识产品的程序,以防止混用。
建立和保持产品标识的程序,并实施,以防止混用820.65可追溯性外科植入器械、支持或维持生命的器械、或按照标识上提供的使用说明进行合理使用时产生操作故障会对使用者产生重大伤害的器械,其制造商应建立和保持程序,用控制号码识别每一单件、批次的成品器械和组件(适当时)。
程序应便于纠正措施的实施。
这样的标识应记录在设备历史记录(DHR)中。
建立和保持产品追溯的程序,并实施子子部部分分GG生生产产和和过过程程控控制制820.70生产和过程控制/820.70(a)(a)总则:
每一个制造商应建立、实施、控制和监视生产过程以确保器械符合其规范。
在生产过程中会导致生产的器械与器械规范有偏差。
制造商应建立和保持描述过程控制必要性的过程控制程序,以确保符合规范要求,过程控制应包括:
1、建立和保持生产过程控制的程序,并符合820法规要求2、过程控制的内容应包括820.70(a)的规定820.70(a)
(1)形成文件的指导书,标准的操作程序(SOPS),规定和控制生产方式的方法;
建立生产过程控制的作业指导书或操作规程(SOP)820.70(a)
(2)生产过程中,过程参数、组件和器械特性的监视和测量;
建立生产过程中,过程参数、组件和器械特性的监视和测量的作业指导书或或操作规程(SOP)820.70(a)(3)对规定的参考标准或代码的符合性;
过程控制应符合相应的参考标准或代码Page3QSR820820.70(a)(4)过程和过程设备的批准;
生产过程所使用的设备和过程应经过批准820.70(a)(5)操作工的操作准则应以形成文件的标准或经确定和批准的代表性的样品的形式来表示。
建立生产操作过程的作业指导书或操作规程(SOP)820.70(b)(b)生产和过程的更改:
每一个制造商应建立和保持对规范、方法、过程或程序的更改。
这样的更改应在实施之前得到验证,或适当时按照820.75要求进行确认。
应将这些活动形成文件。
更改应按照820.40的规定得到批准。
建立和保持对规范、方法、过程或程序的更改程序820.70(c)(c)环境控制:
环境条件对产品质量有影响,制造商应建立和保持程序以充分的控制这些环境条件。
应对环境控制体系进行周期性的检查,以验证该体系,包括必要的设备充分适宜并运行良好。
这些活动应形成文件并得到评审。
环境条件对产品质量有影响,应建立和保持环境控制的程序820.70(d)(d)人员:
如果人员和产品或人员和环境的接触能够对产品质量产生不良影响,每一个制造商应建立和保持对健康、清洁、人员规范和服装的要求。
组织应确保所有特殊环境条件下临时工作的人员接受适当培训或在训练有素的人员监督下工作。
如果人员对产品或环境接触有不良影响,需要建立和保持对健康、清洁、人员规范和服装的管理文件820.70(e)(e)污染控制:
每一个制造商应建立和保持程序,以防止对产品质量有不良影响的设备或产品的污染。
建立和保持污染控制的程序,以防止对产品质量有不良影响820.70(f)(f)建筑物:
建筑物的应经过适宜的设计,并要有足够的空间来完成必要的操作,防止混用,保证有序操作。
建筑物应过适宜的设计,并要足够空间来完成必要的操作Page4QSR820820.70(g)(g)设备:
每一个制造商应确保生产过程中使用的所有设备满足规定的要求,并对其进行适宜的设计、构造、放置和安装以便于维护、调试、清洁和使用。
建立设备设计、构造、放置和安装以及清洁、维护、使用的管理制度820.70(g)
(1)维护计划:
每一个制造商应建立和保持对设备的调整、清洁和维护计划,以确保满足生产规范。
维护活动包括维护活动的日期和人员都应形成文件。
建立设备调整、清洁和维护计划,并实施820.70(g)
(2)检查:
每一个制造商应按照已建立的程序完成周期的检查以确保符合使用的设备维修计划。
检查包括检查的日期和人员应形成文件。
建立设备周期性检查程序,以确保符合使用的设备维修计划,并实施820.70(g)(3)调试:
每一个制造商应确保将设备的固有局限性和容许公差明示在需周期性调试的设备上或跟随设备的附件,或使完成这些调试的人员能够方便获得。
需要周期性调试的设备上应明确标示设备的固有局限性和容许公差820.70(h)(h)制造材料:
当制造材料将会对产品质量有不良影响,制造商应建立和保持对这类材料的报废和使用程序以确保对其报废和限制数量不会影响器械质量。
报废和限制使用制造材料应保持记录。
当制造材料将会产品质量有影响时,应建立和保持对这类材料的报废和使用的程序。
并保存报废和限制使用制造材料的记录。
820.70(i)(i)自动化过程:
如果在生产或质量体系中使用计算机或自动化的数据处理系统时,制造商应按照已制定的方案,对软件的预期用途进行确认。
在软件更改的批准和发布前对更改进行确认。
这些确认活动和结果应形成文件。
如果在生产或质量体系中使用计算机或自动化的数据处理系统时,应制定确认方案,对软件的预期用途进行确认。
820.72检检验验、测测量量和和实实验验设设备备820.72(a)(a)检验、测量和实验设备的控制。
每一个制造商应确保所有的检验、测量和实验设备能适用于其预期的目的并能产生有效结果。
这些设备包括机械设备、自动化设备、电子检验和实验设备。
每一个制造商应建立和保持程序以确保设备能够定期的校准、检定、检查和维护。
程序还应包括设备的搬运、防护和贮存的规定,以便使其精确性和使用的适应性得到保持。
这些活动应形成文件。
应建立和保持计量设备校准、检定、检查、维护、搬运、防护和贮存的程序。
程序内容应符合法规820.72(a)的规定Page5QSR820820.72(b)(b)校准:
校准程序应包含准确度和精确度的明确指导和极限。
当未满足准确度和精确度的极限时,应提供补救措施以再次确定极限并评价是否对器械质量有任何不良影响。
应建立设备计量设备校准程序,程序内容包括法规820.72(b)规定的内容820.72(b)
(1)校准标准:
检验、测量和实验设备所使用的校准标准应可追溯到国家或国际标准。
如果没有国家或国际标准或国家或国际标准不适用时,制造商应使用独立的、可重现的标准。
如果没有适用的标准,制造商应建立和保持自己内部的标准。
应建立校准标准的管理制度,所使用的校准标准可追溯到国家或国际标准;
无国家或国际标准,应使用独立、可重现的标准;
无适用的标准,应建立和保持自己的标准820.72(b)
(2)校准记录:
设备的标识、校准日期、校准人员和下次校准日期形成文件。
这些记录应在设备的零件上或跟随设备附件,或使得使用设备的人员或负责校准设备人员能方便获得。
设备校准应保持相应的校准标识、校准记录、校准证书/报告;
设备上应明示校准标识820.75过过程程确确认认820.75(a)(a)如果过程确认不能被后续的检验和实验过程得以充分验证,则应按照规定的程序对该过程进行充分的确认。
确认活动和结果、包括日期和完成确认活动人员的签名,适当时使用的主要的确认设备应形成文件。
应建立过程确认的程序文件,对不能被后续检验和实验过程得以充分验证的过程进行过程确认820.75(b)(b