第二套溶液中的平衡.docx
《第二套溶液中的平衡.docx》由会员分享,可在线阅读,更多相关《第二套溶液中的平衡.docx(74页珍藏版)》请在冰豆网上搜索。
第二套溶液中的平衡
化学强化训练试题二
一、选择题
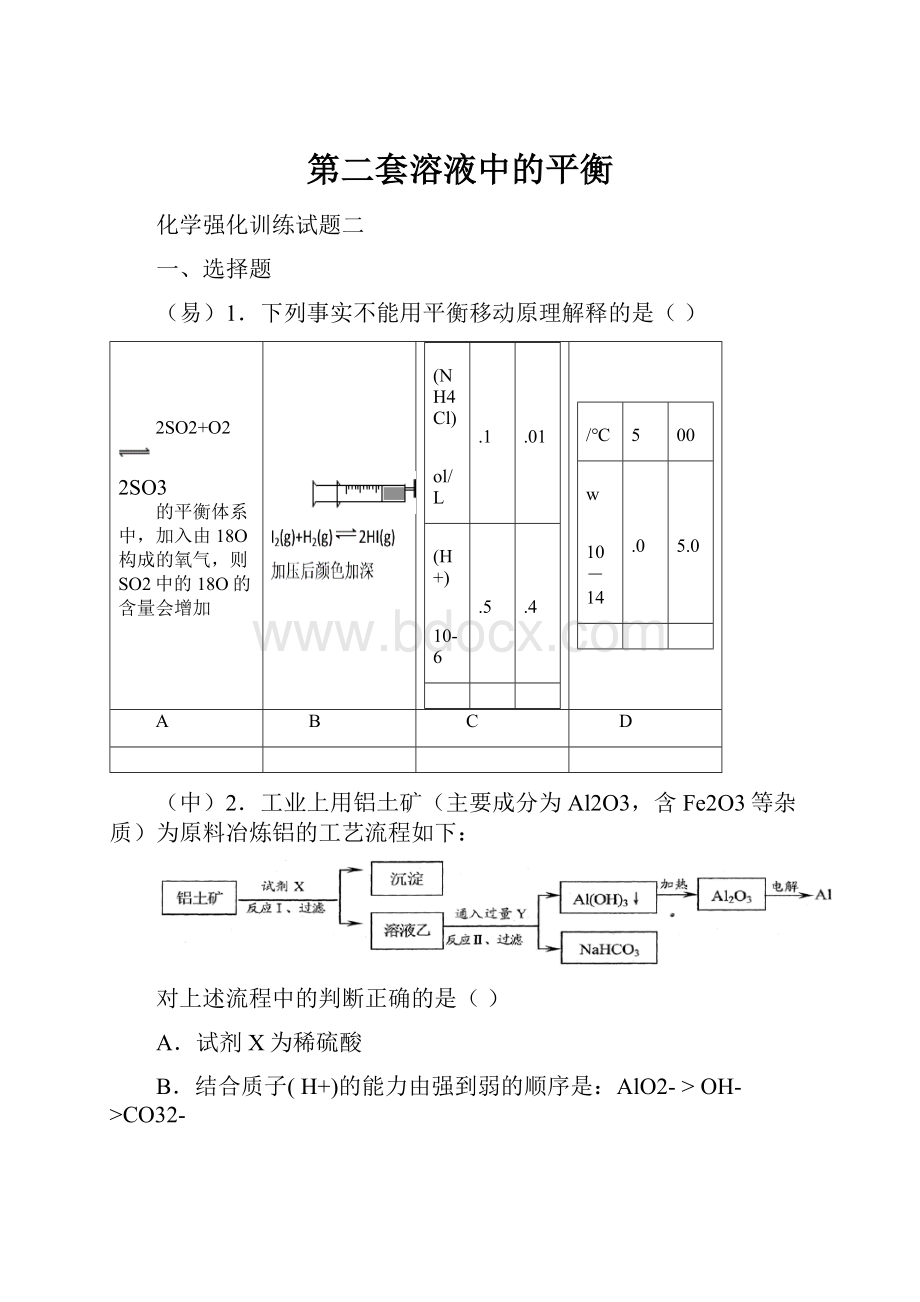
(易)1.下列事实不能用平衡移动原理解释的是()
2SO2+O2
2SO3
的平衡体系中,加入由18O构成的氧气,则SO2中的18O的含量会增加
c(NH4Cl)
mol/L
0.1
0.01
c(H+)
×10-6
7.5
2.4
t/℃
25
100
Kw
×10-14
1.0
55.0
A
B
C
D
(中)2.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
对上述流程中的判断正确的是()
A.试剂X为稀硫酸
B.结合质子(H+)的能力由强到弱的顺序是:
AlO2->OH->CO32-
C.反应II中生成Al(OH)3的反应为:
CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
3.25℃时,已知弱酸的电离常数:
K(CH3COOH)=1.8×10-5;K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8。
则下列说法正确的是()
A.25℃时,0.1mol/L的醋酸溶液比0.01mol/L的醋酸溶液的K值小
B.25℃时,甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈黄色
C.新制氯水与碳酸氢钠不反应
D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:
pH(Na2CO3)>pH(NaClO)>pH(CH3COONa)
(难)4.某无色溶液中只可能含有NH4+、K+、Al3+、Mg2+、Fe3+、Cl-、CO32-、SO42-等离子中的几种离子。
①取10mL该溶液于试管中滴加Ba(NO3)2溶液并加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
②另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,沉淀的量与所加氢氧化钠溶液体积如图所示
下列说法正确的是()
A.溶液中一定存在的离子有K+、NH4+、Al3+、SO42-
B.溶液中一定不存在的离子有Cl-、Fe3+、Mg2+、K+、CO32-
C.实验中NaOH溶液的物质的量浓度为0.lmol/L
D.实验中无法确定K+的存在
5.下列图示与对应的叙述相符的是
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:
a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:
2NO2(g)
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
6.氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq)+OH—(aq)
F—(aq)+H2O(l)△H=-67.7kJ/mol
H+(aq)+OH—(aq)
H2O(l)△H=-57.3kJ/mol
在10mL0.1mol/L的NaOH溶液中,加入10mL浓度为cmol/L的HF稀溶液,下列说法中错误的是()
A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发)
B.水电离的热化学方程式为:
H2O
(1)
H+(aq)+OH—(aq);△H=+57.3kJ/mol
C.当c>0.1时,一定不存在:
c(Na+)=c(F—)
D.若混合后溶液中:
c(Na+)>c(OH—)>c(F—)>c(H+),则c一定小于0.1
7.氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。
已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:
溶质
Na2CO3
NaHCO3
NaClO
NaHSO3
pH
11.6
9.7
10.3
5.2
下列说法中,正确的是()
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
8.一元弱酸HA(aq)中存在下列电离平衡:
HA
A-+H+。
将1.0molHA分子加入水中制得1.0L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
9.下列有关说法正确的是()
A.常温下,0.1mol·L—1Na2S溶液中存在:
c(OH—)=c(H+)+c(HS—)+c(H2S)
B.常温下,0.1mol·L—1HA溶液与0.1mol·L—1NaOH溶液正好完全反应时,溶液中一定存在:
c(Na+)=c(A—)>c(OH—)=c(H+)
C.常温下,向0.1mol·L—1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,
溶液中
的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中:
c(Na+)=c(CH3COOH)>c(CH3COO—)>c(H+)=c(OH—)
10.下列说法正确的是
A.某温度时,1LpH=6的水溶液,含
离子
B.含10.6gNa2CO3溶液中,所含阴离子总数等于
C.VLamol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。
D.电解精炼粗铜时,每转移
电子,阳极上溶解的
原子数必为
11.一定温度下,下列溶液的离子浓度关系式正确的是
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10—5mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):
①>②>③
12.室温下,甲、乙两烧杯均盛有5mlpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是
A.溶液的体积:
10V甲≤V乙
B.水电离出的OH-浓度:
10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:
甲≤乙
D.若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:
甲≤乙
13.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:
c(Na+)=c(Cl-)>cCH3COO-)>c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):
c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
14.下列关于0.10mol·L-1NaHCO3溶液的说法正确的是
A.溶质的电离方程式为NaHCO3=Na++H++CO32-
B.25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:
c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
D.温度升高,c(HCO3-)增大
15.常温下,向20.00mL0.100mol·L-1CH3COONa溶液中逐滴加入0.100mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。
下列说法正确的是
A.点①所示溶液中:
c(Na+)=c(Cl-)>c(H+)=c(OH-)
B.点②所示溶液中:
c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:
c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:
c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
16.常温下,浓度均为0.1mol/L的溶液:
①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH4+):
③>①
B.水电离出的c(H+):
②>①
C.①和②等体积混合后的溶液:
c(NH4+)+c(NH3·H2O)=0.05mol/L
D.①和③等体积混合后的溶液pH>7:
c(NH4+)>c(Cl—)>c(OH-)>c(H+)
17.下列实验能达到预期目的的是()
编号
实验内容
实验目的
A
室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅
证明Na2CO3溶液中存在水解平衡
C
向10mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀
证明在相同温度下的Ksp:
Mg(OH)2>Fe(OH)3
D
分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大
证明非金属性S>C
18.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液
的pH如下表:
下列判断不正确的是
A.HA的电离方程式为:
B.不考虑其他组的实验结果,
C.③组实验中,混合溶液中
D.①组实验中,混合溶液中
19.常温下,对下列四种溶液的叙述正确的是
①
②
③
④
pH
10
10
4
4
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
A.四种溶液分别加水稀释10倍,pH变化最大的是①和④
B.②、④两溶液相比,两者的kw相同
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为:
c(NH4+)>c(Cl-)>c(H+)>c(OH-)
20.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
②1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量完全相等
③pH相等的四种溶液:
a.CH3COONab.C6H5ONac.NaHCO3d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:
d④pH=8.3的NaHCO3溶液:
c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
⑤pH=2的一元酸和pH=12的二元强碱等体积混合:
c(OH-)≤c(H+)
⑥pH=4、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:
c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
A.①②④B.①③⑤C.③⑤⑥D.②④⑥
21.常温下,向l00mL0.01mol/LHA的溶液中逐滴加入0.02mol/LMOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。
下列说法中不正确的是
A.HA为一元强酸
B.N点水的电离程度小于K点水的电离程度
C.随着MOH溶液的滴加,比值
不变
D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L
22.下列有关叙述正确的是()
A.等浓度的NaClO、NaHCO3混合溶液中:
c(HClO)+c(ClO-)=c(HCO
)+c(H2CO3)
B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍
C.100mlpH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强
D.pH=5.5的CH3COOH与CH3COONa混合溶液中:
c(Na+)>c(CH3COO-)
23.25℃时,水的离子积为Kw,该温度下将amol·L-1一元酸HA与bmol·L-1一元强碱BOH等体积混合,若恰好完全反应,下列结论中不正确的是
A.混合液中:
c(H+)≤
B.混合液中:
c(HA)+c(A-)=amol·L-1
C.a=bD.混合液中:
c(H+)+c(B+)=c(OH-)+c(A-)
24.下列选项合理的是()
A.pH皆等于3的两种溶液都稀释100倍后,pH都为5
B.10mL0.02mol/LHCl溶液与10mL0.02mol/LBa(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:
c(NH4+)>c(Cl—)>c(OH—)>c(H+)
25.下列图示与对应的叙述不相符的是
图1 图2 图3 图4
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线
D.图4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶
液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
26.常温下,浓度均为0.1m
ol/L的下列四种盐溶液,其pH测定如下表所示:
序号
①
②
③
④
溶液
CH3COONa
NaHCO3
Na2CO3
NaClO
pH
8.8
9.7
11.6
10.3
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
27.下列图示与对应的叙述相符的是
A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系
C.如上图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+)
D.用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
28.25°C时,弱酸的电离平衡常数如下表:
弱酸
CH3COOH
HCN
H2CO3
Ka
1.8×10-5
4.9×10-10
K1:
4.3×10-7
K2:
5.6×10-11
下列有关说法正确的是( )
A.等物质的量浓度的各溶液的pH关系为:
pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.amol·L-1HCN与bmol·L-1NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力增大
D.NaHCO3和Na2CO3的混合液中:
c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
29.室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合后的体积变化)( )
序号
①
②
③
④
pH
12
12
2
2
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:
①>②
C.把①、④两溶液等体积混合后所得溶液中:
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
30.下列说法正确的是()
A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
B.浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液:
2c(Na+)=3[c(CO32-)+c(HCO3-)]
C.在高锰酸钾溶液中,H+、K+、SO42-、葡萄糖分子可以大量共存
D.已知:
Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl
31.25℃时,将amol·L-1的氨水与bmol·L-1的盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。
下列叙述错误的是
A.混合溶液可能显示酸性、碱性或中性
B.混合溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-)
C.若a>b,则混合溶液中c(C1-)=c(NH4+)+c(NH3·H2O)
D.若混合溶液显中性;则NH3·H2O的电离平衡常数为
mol·L-1
32.常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
A.H2A为二元弱酸
B.PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(B2-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
33.25°C时某些弱酸的电离平衡常数如下表,下列说法正确的是()
化学式
CH3COOH
HClO
H2CO3
Ka
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.1×10-7
Ka2=5.6×10-11
A.等物质的量浓度溶液酸性由强到弱的顺序为:
H2CO3>CH3COOH>HClO
B.等物质的量浓度溶液pH由大到小的顺序为:
Na2CO3>NaClO>NaHCO3>CH3COONa
C.等物质的量浓度的NaClO和NaHCO3混合溶液中:
c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:
ClO—+CO2+H2O=CO32—+2HClO
34.下表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是
pH
c(CrO42—)
c(HCrO4—)
c(Cr2O72—)
c(H2CrO4)
4
0.0003
0.1040
0.4480
0
6
0.0319
0.0999
0.4370
0
7
0.2745
0.0860
0.3195
0
9
0.9960
0.0031
0.0004
0
A.铬酸第一级电离方程式为H2CrO4
H++HCrO4—
B.要得到CrO42—应控制溶液的pH>9
C.当电离达到平衡时,2v(正)(HCrO4—)=v(逆)(Cr2O72—)
D.该铬酸溶液的物质的量浓度约为1.00mol/L
35.25℃时,弱酸的电离平衡常数如下表,下列表述错误的是
弱酸
CH3COOH
HCN
H2CO3
K
1.8×10-5
4.9×10-10
K1=4.3×10-7K2=5.6×10-11
A.CN-+H2O+CO2→HCN+HCO3-
B.相同温度时三种溶液的pH关系:
Na2CO3>NaCN>CH3COONa
C.等体积、等物质的量浓度的CH3COOH和Na2CO3反应后的溶液呈碱性
D.amol/LHCN与bmol/LNaOH等体积混合溶液c(Na+)>c(CN-),则a一定小于b
36.有0.1mol·L-1的三种溶液:
①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,c(CH3COO-)=c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
37.常见的无机酸25℃时在水溶液中的电离平衡常数如下表
无机酸
氢氰酸(HCN)
碳酸(H2CO3)
氢氟酸(HF)
电离平衡常数K值
6.2×10—10(K)
4.2×10—7(K1)
5.6×10—11(K2)
6.61×10—4(K)
下列选项正确的是
A.氟化钠溶液中通入过量CO2:
F—+H2O+CO2=HF+HCO3—
B.Na2CO3溶液中:
2c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3)
C.中和等体积、等pH的氢氰酸(HCN)和氢氟酸(HF)消耗NaOH的量前者大于后者
D.等浓度的NaCN和NaF溶液中pH值前者小于后者
38.盐酸、醋酸和碳酸氢钠是生活中常见的物质。
下列表述正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH-
B.NaHCO3溶液中:
c (H+)+c (Na+)= c (HCO3-)+2c(CO32-)+c(OH-)
C.中和体积与物质的量浓度都相同的HCl溶液和CH3COOH溶液消耗NaOH物质的量相同
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同
39.关于溶液的下列说法正确的是()
A.c(H+)︰c(OH-)=1:
10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在
B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在
C.往0.1mol/LCH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中