卤素总结.docx
《卤素总结.docx》由会员分享,可在线阅读,更多相关《卤素总结.docx(9页珍藏版)》请在冰豆网上搜索。
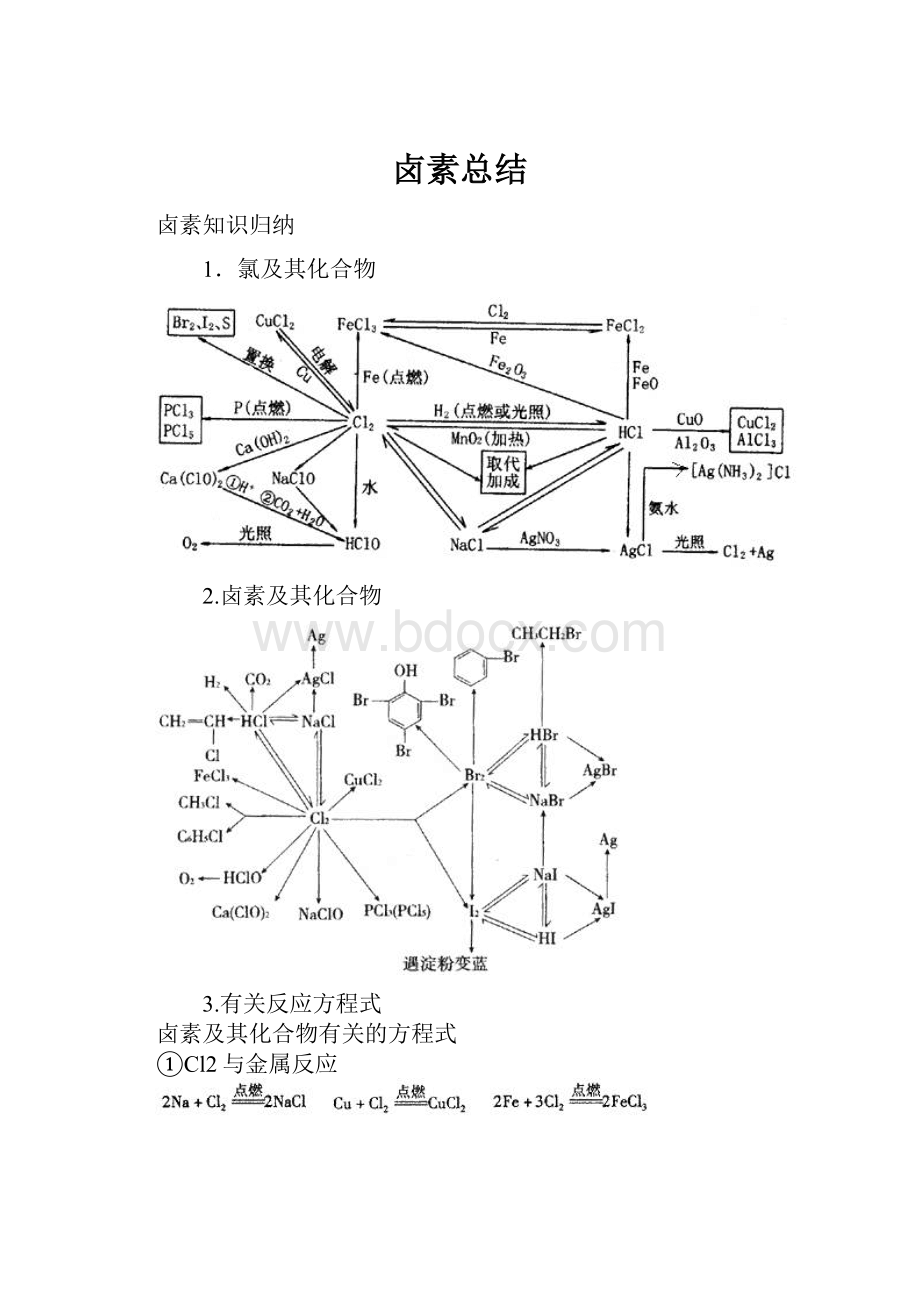
卤素总结
卤素知识归纳
1.氯及其化合物
2.卤素及其化合物
3.有关反应方程式
卤素及其化合物有关的方程式
①Cl2与金属反应
②Cl2与非金属反应
③Cl2与水反应
④Cl2与碱反应
Cl2+2NaOH=NaCl+NaClO+H2O(尾气吸收)
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(制漂白粉)
Ca(ClO2)+CO2+H2O=CaCO3↓+2HClO(日常漂白原理)
3Cl2+8NH3=6NH4Cl+N2
⑤Cl2与还原性化合物作用
Cl2+NaBr=2NaCl+Br2 Cl2+2KI=2KCl+I2 Cl2+2FeCl2=2FeCl3
3Cl2+6FeBr2=2FeCl3+4FeBr3(少量Cl2) 3Cl2+2FeBr2=2FeCl3+2Br2(足量Cl2)
Cl2+SO2+2H2O=H2SO4+2HCl Cl2+H2S=2HCl+S↓
⑥Cl2与有机物的作用
⑦Cl2制备
16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
14HCl(浓)+K2Cr2O7=2KCl+2CrCl3+3Cl2↑+7H2O
4HCl(浓)+Ca(ClO)2=CaCl2+Cl2↑+2H2O
⑧HCl的有关反应
Zn+2HCl=ZnCl2+H2↑ Al2O3+6HCl=2AlCl3+3H2O Al(OH)3+3HCl=AlCl3+3H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
⑨氟、碘的有关方程式
2F2+2H2O=4HF+O2 2F2+Xe
XeF4
Si+4HF=SiF4+2H2 4HF+SiO2=SiF4↑+2H2O
CaSiO3+6HF=CaF2↓+SiF4↑+3H2O
Fe+I2
FeI2
碘与淀粉溶液变蓝色。
AgNO3+KI=AgI↓+KNO3
4.氯水的成分和性质
(1)成分:
氯水是氯气的水溶液,通常状况下,1体积能溶解约2体积氯气,形成淡绿色液体,溶解于水中的氯气能够部分与水反应生成盐酸和次氯酸.
Cl2+H2O=HCl+HClO
新制的氯水中只有约39%的氯气与水反应,余者以氯分子形式存在于溶液中,故氯水呈淡黄绿色.新制的氯水中主要含有Cl2、HClO、H2O、H+、Cl—、ClO—(HClO为弱酸,部分电离出少量H+、ClO—),以及水电离出来的少量OH—等。
通常所说的氯水就是指新制的氯水,须随配随用,保存在棕色瓶中。
久置的氯水由于次氯酸见光分解:
2HClO=2HCl+O2↑,而变成很稀的盐酸,其中主要含有H+、Cl—、H2O、O2(少量).
(2)性质:
①新制的氯水可以代替氯气.如:
A.能使碘化钾淀粉试纸变蓝。
B.氯水和某些非金属阴离子的反应,向KI、Na2S、NaBr的溶液中加氯水。
C.氯水和某些还原性阳离子的反应,向FeCl2溶液中加氯水.
D.氯水和某些还原性氢化物的反应,向氯水中通H2S、HBr、HI等.
E.氯水和不饱和有机物的加成反应,向氯水中通入乙烯、乙炔等.
②氯水可体现H+、HClO的性质,如石蕊试液滴入氯水中,溶液先变红后褪色,变红是由于HCl电离产生的H+表现酸性,褪色是因为次氯酸具有强氧化性,能将有机色素氧化而使其褪色,氧化还原反应速率不如H+的反应速率快,故先变红后褪色.
③氯水还可单独表现出HClO的性质,例如用氯水消毒、杀菌、漂白,就是利用氯水中的HClO具有强氧化性杀死水中的细菌或氧化有机色素.
④氯水又可表现出Cl—的性质,如氯水滴入到AgNO3溶液中,产生不溶于稀HNO3的白色沉淀;用自来水配制AgNO3溶液时产生白色沉淀。
⑤氯水又能单独表现H+的特点,例如向Na2CO3溶液中滴加氯水,有大量气体(CO2)产生。
(3)氯水与液氯的区别:
氯水是混和物,而液氯是纯净物。
5.溴水褪色的种种反应
(1)能使溴水褪色的无机物
如:
H2S:
Br2+H2S=2HBr+S↓(褪色且浑浊)
SO2:
Br2+SO2+2H2O=H2SO4+2HBr
Na2SO3:
Br2+Na2SO3+H2O=Na2SO4+2HBr
Mg粉(或Zn粉等):
Br2+Mg=MgBr2
NaOH等强碱:
Br2+2NaOH=NaBr+NaBrO+H2O
Na2CO3(或AgNO3等盐)
Br2+H2O=HBr+HBrO
2HBr+Na2CO3=2NaBr+CO2↑+H2O
(2)能使溴水褪色的有机物
①含C=C或叁键的物质
不饱和烃:
如烯烃、炔烃、二烯烃、苯乙烯等
不饱和烃的衍生物,:
如烯醇、烯醛、烯酯、卤代烯烃、油酸、油酸某酯、油等 天然橡胶(聚异戊二烯)
②石油产品:
如裂化气、裂解气、裂化汽油等
③苯酚及其同系物(发生取代反应,有沉淀产生)
④含醛基的化合物,如醛类、葡萄糖、甲酸、还原性糖等
注意:
①某些与溴不发生反应的有机物如卤代烃、四氯化碳、氯仿、溴苯、直馏汽油、苯及苯的同系物,液态环烷烃,低级酯、液态饱和烃、二硫化碳等能萃取溴,虽能使溴水层变无色,但油层变橙红色,一般来说使溴水褪色并不包括这类物质.
②溴水与碘化钾溶液作用后生成的I2的水溶液为深黄色至褐色,颜色加深而不是变浅.
6.卤素及其化合物性质递变规律
(1)卤素单质物理性质的递变规律
从F2→I2
①单质的颜色由浅变深;
②单质的状态:
由气态到液态逐渐变成固态;
③单质的密度依次增大;
④单质的熔沸点逐渐升高;
(2)卤素单质的氧化性递变规律
由于卤原子最外层都为7个电子,易获得电子成为8电子稳定结构,是典型的非金属元素,都具有强氧化性.但从F→I随核电荷数递增,获得电子的能力递减,因此氧化性规律为F2>Cl2>Br2>I2。
表现出的性质有:
①与H2反应:
生成卤化氢的反应由易到难;卤化氢的稳定性由强到弱,即HF>HCl>HBr>HI。
②与金属化合生成金属卤化物:
且除I2外,与可变价金属反应时生成高价卤化物。
③与还原性物质反应。
④F2与H2O反应,H2O做还原剂。
(3)卤素单质既有氧化性又有还原性规律
由于卤素的最低价态为—1价,最高价(F除外)为+7价,而卤素单质的价态为零价,处于中间价态.因此,当它与某些物质反应时表现出既有氧化性又有还原性:
①与H2O反应(除F2外)生成HX和HXO
②与强碱溶液反应(除F2外)生成卤化物和次卤酸盐
(4)卤素阴离子的还原性规律
易获得电子的物质,其得电子后失电子是较难的,即单质的氧化性越强,对应阴离子的还原性越弱,因此,X—还原性规律为:
F—<Cl—<Br—<I—。
(5)卤化氢的酸性和还原性规律
HX在水溶液中能电离出H+和X—,但因F→I原子半径逐渐增大,其H—F到H—I的键能逐渐减小,所以在水溶液中的电离程度逐渐增大.HX的酸性和还原性规律为:
HF<HCl<HBr<HI,且HCl、HBr、HI的水溶液均为强酸,只有HF是弱酸.
(6)同种卤素含氧酸的酸性规律
同种元素的含氧酸,其价态越高,酸性越强,因此有:
HClO4>HClO3>HClO2>HClO。
(7)同种卤素含氧酸的氧化性规律
HClO>HClO2>HClO3>HClO4一般情况下元素化合物的氧化性随化合价升高而氧化性增强,但卤素却例外。
(8)不同种卤素含氧酸的酸性和氧化性规律
①除F2外,从Cl→I的最高价氧化物对应水化物的酸性依次减弱:
即HClO4>HBrO4>HIO4
②同价态卤素含氧酸氧化性依次减弱:
即HClO>HBrO>HIO
(9)卤化银的溶解性和稳定性规律
①在AgX中,只有AgF易溶于水,其余均难溶于水和稀HNO3,且按AgCl>AgBr>AgI的顺序溶解度依次减小,而颜色却逐渐加深,分别为白色、浅黄色、黄色
②AgX都不稳定,见光或受热易分解为卤素单质和银,且按AgF>AgCl>AgBr>AgI的顺序稳定性依次减弱
7.卤素特性归纳
①Cl2、Br2、I2与水反应类型相同,可用通式X2+H2O=HX+HXO,而F2特殊F2+2H2O=4HF+O2,由此得出它们与碱反应Cl2、Br2、I2相同,F2不同。
②F2、Cl2、Br2与Fe作用得+3价铁,而碘使铁显+2价I2+Fe
FeI2
③Cl—、Br—、I—跟AgNO3分别产生白色沉淀、浅黄色沉淀、黄色沉淀;而AgF可溶于水,无色溶液
④氯水具有漂白性,但溴水、碘水中HBrO和HIO很少,漂白性很差.
⑤HCl的制备是利用浓硫酸和氯化钠反应,而HBr、HI的制备不可用浓硫酸,因其具有强氧化性,可把Br—、I-氧化成Br2、I2
⑥氯的含氧酸随价态升高氧化性降低,氧化性HClO>HClO2>HClO3>HClO4.
⑦碘遇淀粉溶液变蓝,但淀粉碘化钾试纸投入氯水中不变蓝,因为氯水过量,发生下列反应I2+5Cl2+6H2O=2HIO3+10HCl
⑧氢氟酸为弱酸,余者为强酸,且酸性逐渐增强。
氢氟酸腐蚀玻璃,其他氢卤酸没有此性质
8.烟、雾、气的区别
(1)烟是大量细小固体颗粒分散在气体中形成的混合物。
如铜在氯气中燃烧产生棕黄色的烟;金属钠在氯气中燃烧产生白烟。
(2)雾是大量细小液滴分散在气体中形成的混合物。
如打开盛浓盐酸的试剂瓶的瓶盖,会看到瓶口出现大量的白雾,这是浓盐酸挥发出来的氯化氢吸收空气中的水所形成的大量盐酸液滴分散在空气中形成的混合物。
(3)烟雾是大量细小固体颗粒与大量细小液滴同时分散在气体中形成的混合物。
如磷在氯气中燃烧往往得到的是PCl3(液态)和PCl5(固态)的混合物,观察到的现象是产生白色烟雾。
(4)气是指气态物质,无色气体是看不见的,有颜色的气体是可以观察到的。
9.卤化氢和氢卤酸的三性
(1)热稳定性
卤化氢的热稳定性按HF—HCl—HBr—HI的顺序依次减弱.这与卤原子半径大小顺序F<Cl<Br<I有关。
因其原子半径越小与氢结合越牢,例如氟在暗处跟氢气就能剧烈化合,并发生爆炸,形成气态氢化物氟化氢最稳定,价键最不易断裂;而碘与氢气需在加热条件下才化合,生成的碘化氢最不稳定,并易分解。
(2)还原性
卤化氢(HX)和氢卤酸(化学式也为HX)的还原性,实际上是指X-失电子的能力。
卤化氢还原性的强弱是很不相同的,这可以从相应卤化物与浓硫酸作用的产物不同加以证实。
大量实验事实证明,卤离子的还原性按F——Cl——Br——I—的顺序依次增强.从卤离子的结构看,这可用X—的半径按F——Cl——Br——I—依次增大,使X—失电子能力依次增强来解释.
(3)酸性
氢卤酸中除HF外,其余都是强酸,而且按HCl—HBr—HI的顺序依次增强。
在中学阶段,可以由卤原子的半径按F—Cl—Br—I的顺序依次增大(其电子层依次增加所致)得以粗浅的解释。
HX均易溶于水,分散在溶剂水分子之间,受极性水分子的作用发生电离,X—半径越大越易受水分子极化,电离成H+和X—程度越大,H+浓度也就越大,酸性越强。
因此,它们酸性的强弱顺序按HF—HCl—HBr—HI的顺序依次增强。
10.拟卤化合物简介
(1)拟卤素
有少数分子与卤素单质性质相似,故把它们叫做拟卤素,如氰(CN)2、硫氰(SCN)2等.它们对应的拟卤阴离子为CN—、SCN—,在性质上与卤素阴离子的性质也相似。
拟卤素的主要化学性质有:
①拟卤素单质具有较强氧化性,与卤素单质相比其氧化性的顺序为F2>Cl2>Br2>(CN)2>(SCN)2>I2
②在水中或碱溶液中易发生歧化反应。
如(CN)2+H2O=HCN+HCNO;(CN)2+2OH—=CN—+CNO—+H2O
③与金属生成一价阴离子的盐。
如(CN)2+2Na=2NaCN.
(2)卤素互化物
指两种不同卤素相互化合形成的化合物。
常见的卤素互化物有:
BrCl、ICl、BrF3、BrF5等,大多数卤素互化物不稳定,具有比卤素单质(F2除外)更强的化学活泼性。
主要反应有:
①易水解。
如ICl+H2O=HCl+HIO
②强氧化性
与金属反应,如2M+nBrCI=MCln+MBrn(M代表金属元素,n为其化合价)
与某些盐的反应,如2NaI+BrCl=NaCI+NaBr+I2
③与还原性的物质反应.如SO2+2H2O+BrCl=HBr+HCl+H2SO4