物质的构成奥秘教案.docx
《物质的构成奥秘教案.docx》由会员分享,可在线阅读,更多相关《物质的构成奥秘教案.docx(10页珍藏版)》请在冰豆网上搜索。
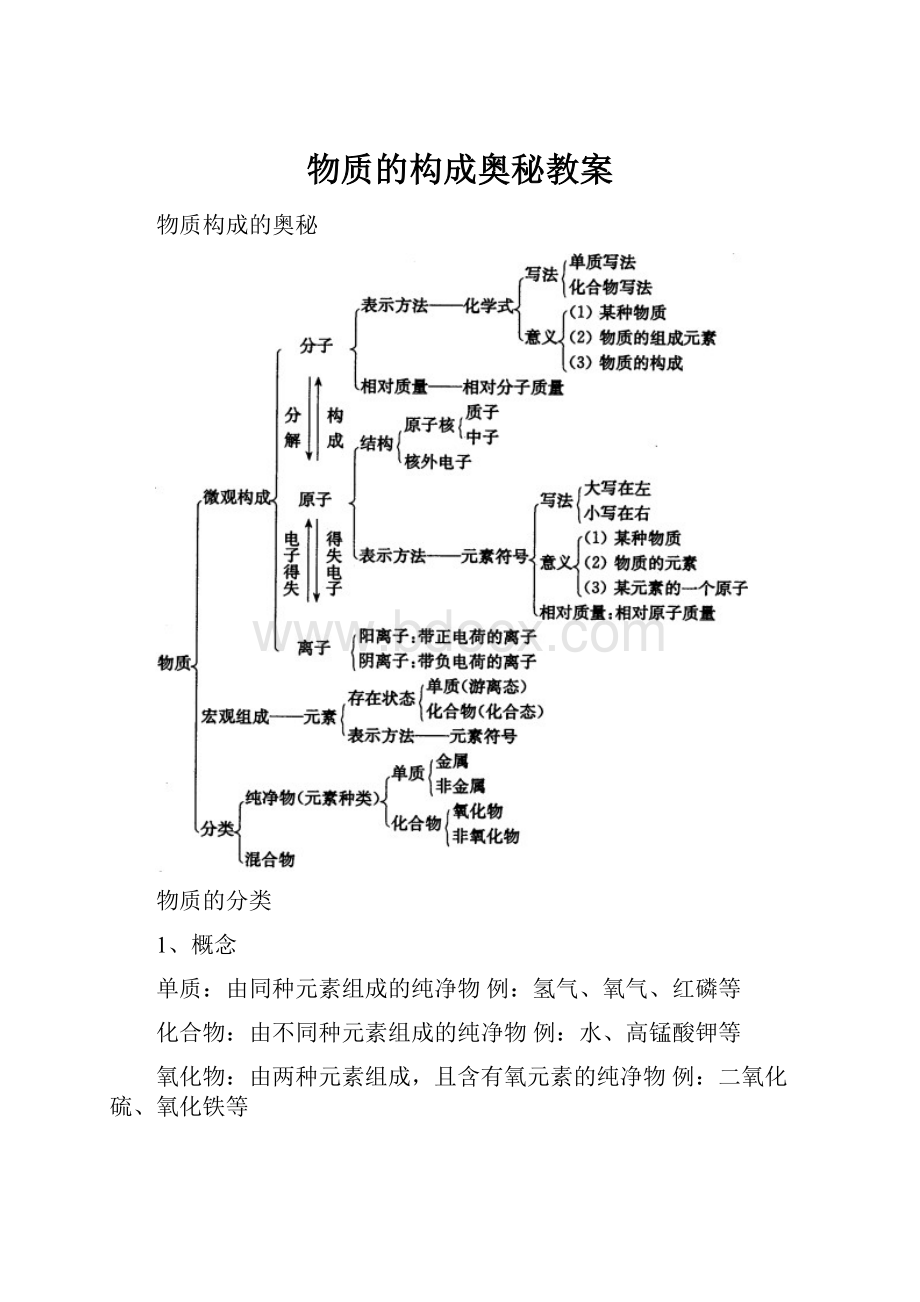
物质的构成奥秘教案
物质构成的奥秘
物质的分类
1、概念
单质:
由同种元素组成的纯净物例:
氢气、氧气、红磷等
化合物:
由不同种元素组成的纯净物例:
水、高锰酸钾等
氧化物:
由两种元素组成,且含有氧元素的纯净物例:
二氧化硫、氧化铁等
注意:
单质、化合物前提必须是纯净物,即划分单质、化合物的标准是根据纯净物的元素种类来划分的。
若只含一种元素的纯净物就属于单质;若含有几种元素的纯净物就属于化合物
2、物质分类的步骤
①根据物质种类分为纯净物与混合物
②写出纯净物的化学符号
③根据元素种类将纯净物分为单质与化合物
④在化合物中根据氧化物的概念找出氧化物
3、物质的组成、构成及分类
组成:
物质(纯净物)由元素组成
原子:
金属、稀有气体、碳、硅等。
物质 构成 分子:
如氯化氢由氯化氢分子构成。
H2、O2、N2、Cl2。
离子:
NaCl等离子化合物,如氯化钠由钠离子(Na+)氯离子(Cl-)构成
混合物(多种物质)
分类 单质 :
金属、非金属、稀有气体
纯净物 (一种元素)
(一种物质)化合物:
有机化合物CH4、C2H5OH、C6H12O6、淀粉、蛋白质
(多种元素)氧化物H2OCuOCO2
酸HClH2SO4HNO3
盐NaClCuSO4Na2CO3
无机化合物 碱NaOHCa(OH)2KOH
分子和原子
构成物质的微粒:
分子、原子等微粒
1、由分子构成的物质:
例如水、二氧化碳、氢气、氧气等物质
2、由原子构成的物质:
金属、稀有气体、金刚石、石墨等物质
3、物质构成的描述:
物质由××分子(或原子)构成。
例如:
铁由铁原子构成;氧气由氧分子构成。
分子
1、基本性质:
⑴质量、体积都很小;
⑵在不停地运动且与温度有关。
温度越高,运动速率越快例:
水的挥发、品红的扩散;
⑶分子间存在间隔。
同一物质气态时分子间隔最大,固体时分子间隔最小;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
⑷同种物质间分子的性质相同,不同物质间分子的性质不同。
2、分子的构成:
分子由原子构成。
分子构成的描述:
①××分子由××原子和××原子构成。
例如:
水分子由氢原子和氧原子构成
②一个××分子由几个××原子和几个××原子构成。
例如:
一个水分子由一个氧原子和二个氢原子构成
3、含义:
分子是保持物质化学性质的最小微粒。
例:
氢分子是保持氢气化学性质的最小粒子
原子
1、含义:
原子是化学变化中最小的微粒。
例:
氢原子、氧原子是电解水中的最小粒子
2、分子与原子的比较
分子
原子
定义
分子是保持物质化学性质最小的微粒
原子是化学变化中的最小微粒。
性质
体积小、质量小;不断运动;有间隙
联系
分子是由原子构成的。
分子、原子都是构成物质的微粒。
区别
化学变化中,分子可分,原子不可分。
3、从分子和原子角度来区别下列几组概念
⑴物理变化与化学变化
由分子构成的物质,发生物理变化时,分子种类不变;发生化学变化时,分子种类发生了改变。
化学反应的实质:
在化学反应中分子分裂为原子,原子重新组合成新的分子。
⑵纯净物与混合物
由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。
⑶单质与化合物
单质的分子由同种原子构成;化合物的分子由不同种原子构成。
原子的结构
(1)原子结构的认识
(2)在原子中由于原子核带正电,带的正电荷数(即核电荷数)与核外电子带的负电荷数(数值上等于核外电子数)相等,电性相反,所以原子不显电性
因此:
核电荷数=质子数=核外电子数
注意:
①原子中质子数不一定等于中子数。
②并不是所有原子的原子核中都有中子。
例如:
氢原子核中无中子。
③不同种类的原子核内质子数不同,中子数可能相同,也可能不同。
2
、相对原子质量:
定义:
以碳—12原子质量的1/12作为标准,其他原子的质量跟它的相比较所得的比,就是这种原子的相对原子质量。
注意:
(1)原子的质量极小。
科学上一般都不用原子的实际质量,而用相对质量进行计算。
(2)以碳—12原子是指质子数与中子数都是6的碳原子。
(3)相对原子质量是一个比值,单位为“1”
(4)原子的质量主要集中在原子核上,电子的质量很小,忽略不计。
因此,相对原子质量=质子数+中子数。
原子结构图:
①圆圈内的数字:
表示原子的质子数
②+:
表示原子核的电性
③弧线:
表示电子层
④弧线上的数字:
表示该电子层上的电子数
1、核外电子排布的规律:
①第一层最多容纳2个电子;
②第二层最多容纳8个电子;
③最外层最多容纳8个电子(若第一层为最外层时,最多容纳2个电子)
元素
含义:
具有相同质子数(或核电荷数)的一类原子的总称。
注意:
元素是一类原子的总称;这类原子的质子数相同
因此:
元素的种类由原子的质子数决定,质子数不同,元素种类不同。
元素与原子的比较:
元素
原子
区
别
含义
宏观概念,只分种类不计个数
微观概念,既分种类又分个数
适用范围
从宏观描述物质的组成。
常用来表示物质由哪几种元素组成。
如水由氢元素和氧元素组成
从微观描述物质(或分子)的构成。
常用来表示物质由哪些原子构成或分子由哪些原子构成,如水分子由氢原子和氧原子构成;铁由铁原子构成。
联系
元素是同类原子的总称,原子是元素的基本单元
元素的分类:
元素分为金属元素、非金属元素和稀有气体元素三种
元素的分布:
①地壳中含量前四位的元素:
O、Si、Al、Fe
②生物细胞中含量前四位的元素:
O、C、H、N
③空气中前二位的元素:
N、O
注意:
在化学反应前后元素种类不变
元素符号
1、书写原则:
第一个字母大写,第二个字母小写。
2、表示的意义;表示某种元素、表示某种元素的一个原子。
例如:
O:
表示氧元素;表示一个氧原子。
3、元素符号前面的数字的含义;表示原子的个数。
例如:
6N:
6表示6个氮原子。
元素周期表
1、发现者:
俄国科学家门捷列夫
2、结构:
7个周期16个族
3、元素周期表与原子结构的关系:
①同一周期的元素原子的电子层数相同,电子层数=周期数
②同一族的元素原子的最外层电子数相同,最外层电子数=主族数
原子序数=质子数=核电荷数=电子数
元素周期表中每一方格提供的信息:
元素最外层电子数与元素性质的关系
1、金属元素:
最外层电子数<4易失电子
2、非金属元素:
最外层电子数≥4易得电子
3、稀有气体元素:
最外层电子数为8(He为2)不易得失电子
4、最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构。
因此元素的化学性质由原子的最外层电子数决定。
当两种原子的最外层电子数相同,则这两种元素的化学性质相似。
(注意:
氦原子与镁原子虽然最外层电子数相同,但是氦原子最外层已达相对稳定结构,镁原子的最外层未达到相对稳定结构,所氦元素与镁元素的化学性质不相似)
离子
1、概念:
带电的原子或原子团
2、分类及形成:
阳离子(由于原子失去电子而形成)带正电
阴离子(由于原子得到电子而形成)带负电
注意:
原子在变为离子时,质子数、元素种类没有改变;电子数、最外层电子数、元素化学性质发生了改变。
3、表示方法:
在元素符号右上角标明电性和电荷数,数字在前,符号在后。
若数字为1时,可省略不写。
例如:
钠离子:
Na+。
4、离子符号表示的意义:
表示一个某种离子;表示带n个单位某种电荷的离子。
例如:
Fe3+:
带3个单位正电荷的铁离子
5、元素符号右上角的数字的含义:
表示一个离子所带的电荷数。
例如:
Fe3+:
3表示一个铁离子带3个单位的正电荷
6、离子中质子数与电子数的关系:
阳离子:
质子数>电子数阴离子:
质子数<电子数
7、离子与原子的区别与联系
粒子的种类
原子
离子
阳离子
阴离子
区
别
粒子结构
质子数=电子数
质子数>电子数
质子数<电子数
粒子电性
不显电性
显正电
显负电
符号
用元素符号表示
用离子符号表示
用离子符号表示
相互转化
阳离子原子阴离子
相同点
都是构成物质的一种微粒;质量、体积都很小;在不停运动;有间隙
8、离子个数的表示方法:
在离子符号前面加系数。
例如:
2个钠离子:
2Na+
9、离子符号前面的数字:
表示离子的个数。