采购项目需求一览表.docx
《采购项目需求一览表.docx》由会员分享,可在线阅读,更多相关《采购项目需求一览表.docx(12页珍藏版)》请在冰豆网上搜索。
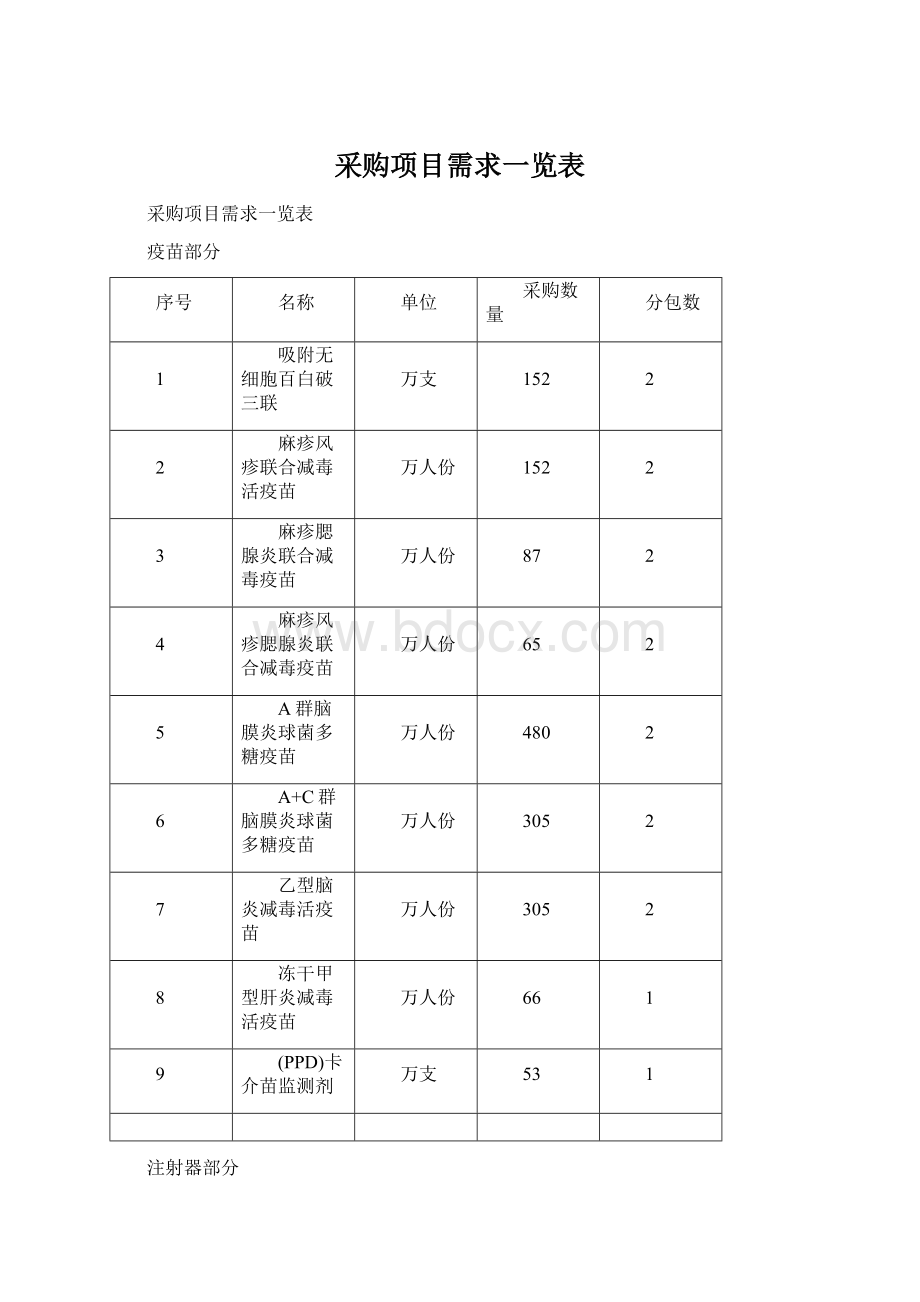
采购项目需求一览表
采购项目需求一览表
疫苗部分
序号
名称
单位
采购数量
分包数
1
吸附无细胞百白破三联
万支
152
2
2
麻疹风疹联合减毒活疫苗
万人份
152
2
3
麻疹腮腺炎联合减毒疫苗
万人份
87
2
4
麻疹风疹腮腺炎联合减毒疫苗
万人份
65
2
5
A群脑膜炎球菌多糖疫苗
万人份
480
2
6
A+C群脑膜炎球菌多糖疫苗
万人份
305
2
7
乙型脑炎减毒活疫苗
万人份
305
2
8
冻干甲型肝炎减毒活疫苗
万人份
66
1
9
(PPD)卡介苗监测剂
万支
53
1
注射器部分
包号
名称
单位
采购数量
1
0.1ml自毁型注射器
万支
148
2
0.5ml自毁型注射器
万支
2366
3
1.0ml自毁型注射器
万支
67
4
0.5ml一次性注射器
万支
1168
5
1.0ml一次性注射器
万支
67
6
2.5ml一次性注射器(或5ml一次性注射器)
万支
98(或49)
疫苗技术参数
一、疫苗技术参数总体要求
(一)疫苗包装标识:
符合国食药监注〔2005〕257号关于纳入国家免疫规划疫苗包装标注特殊标识的通知要求,其最小外包装上,必须标明“政府免费”字样以及“免疫规划”专用标识。
(二)疫苗及其配套稀释液包装:
安瓿密封无泄露、无破损,外包装必须坚固,能适应航空、铁路、公路运输。
(三)疫苗及其监测用制品贮存、运输:
中标企业必须按照卫生部、国家食品药品监督管理局制订的《疫苗储存和运输管理规范》的规定,在冷藏条件下贮存、运输疫苗,确保疫苗及其监测用制品质量。
(四)交货地点、交货日期和售后服务按合同规定。
二、疫苗技术参数详细要求
1:
吸附无细胞百白破三联
1.功能及用途
1.1用途:
接种本疫苗后,可刺激机体产生细胞免疫应答。
1.2功能:
用于预防百日咳、白喉、破伤风病
2.技术指标
2.1成分由无细胞百日咳疫苗原液、白喉类毒素原液、破伤风类毒素原液加氢氧化铝佐剂组成。
2.2外形及规格乳白色悬液(不应有摇不散的凝块或异物),0.5ml/支。
2.3疫苗效价每1剂次人用量(0.5ml/支):
含无细胞百日咳疫苗效价不低于4.0IU,含白喉疫苗效价不低于30IU,含破伤风疫苗效价不低于40IU。
2.4免疫原性及安全性,大规模人群接种后安全、有效,免疫原性及安全性符合国家规定要求。
2.5无菌检查依法检查,应符合国家规定。
3.包装应符合“生物制品包装规程”规定。
4.储运温度于2-8℃运输保存。
5.有效期自鉴定合格之日起,有效期为个18月。
2:
麻疹风疹联合减毒活疫苗
1.功能及用途
1.1.用途:
本疫苗服用后可刺激机体产生抗麻疹病毒和风疹病毒的免疫力。
1.2.功能:
用于预防麻疹和风疹。
2.技术指标
2.1.类型:
麻疹病毒为沪-191株或经批准的其他麻疹病毒减毒株Schwarz株、Edmonston株。
风疹细胞为人2倍体细胞BRD11株、2BS株、MRC-5株或经批准的其他风疹细胞株WistarRA27/3株。
2.2.病毒含量:
剂型为0.5ml/支,二价疫苗按一定比例混合,其中含麻疹活病毒不低于3.0lgCCID50,其中含风疹活病毒含量不低于3.2lgCCID50。
2.3.免疫原性:
大规模人群接种后安全、有效,免疫原性及安全性符合国家规定。
3.外观及规格0.5ml/支/1人份,外观为乳酪色疏松体,复溶后为澄明液体无异物。
4.热稳定性37℃放置7天后:
麻疹活病毒不低于3.3lgCCID50/ml,风疹病毒低度不低于3.5lgCCID50/ml,每毫升二种病毒滴度下降均应不高于1.0lg。
5.无菌检查依法检查,应符合国家规定。
6.异常病毒检查依法检查,应符合国家规定。
7.包装应符合“生物制品包装规程”规定。
8.储运温度于2-8℃避光保存和运输。
9.有效期自鉴定合格之日起,有效期为个18月。
3:
麻疹腮腺炎联合减毒疫苗
1.用途:
本疫苗接种后可刺激机体产生抗麻疹病毒和腮腺炎病毒的免疫力。
2.功能:
用于预防麻疹和流行性腮腺炎
3.技术指标
3.1.类型:
麻疹病毒为沪-191株或经批准的其他麻疹病毒减毒株Schwarz株、Edmonston株。
腮腺炎病毒为S79株或经批准的其他腮腺炎病毒减毒株RIT4385株、GerylLynn株。
3.2.病毒含量:
剂型为0.5ml/支,二价疫苗按一定比例混合,其中含麻疹活病毒不低于3.0lgCCID50,其中含腮腺炎活病毒不低于3.7lgCCID50。
3.3免疫原性:
大规模人群接种后安全、有效,免疫原性及安全性符合国家规定。
4.外观及规格0.5ml/支/1人份,外观为乳酪色疏松体,复溶后应为橘红色澄明液体无异物。
5.热稳定性37℃放置7天后:
麻疹活病毒不低于3.3lgCCID50/ml,腮腺炎疫苗病毒滴度不低于4.0lgCCID50/ml,两种病毒滴度下降均应不高于1.0lg。
6.无菌检查依法检查,应符合国家规定。
7.异常病毒检查依法检查,应符合国家规定。
8.包装应符合“生物制品包装规程”规定。
9.储运温度于2-8℃避光保存和运输。
10.有效期自鉴定合格之日起,有效期为个18月。
4:
麻疹风疹腮腺炎联合减毒疫苗
1功能及用途
1.1.用途:
本疫苗服用后可刺激机体产生抗麻疹病毒、风疹病毒和腮腺炎病毒的免疫力
1.2.功能:
用于预防麻疹、风疹和流行性腮腺炎
2.技术指标
2.1.类型:
麻疹病毒为沪-191株或经批准的其他麻疹病毒减毒株Schwarz株、Edmonston株。
风疹细胞为人2倍体细胞BRD11株、2BS株、MRC-5株或经批准的其他风疹细胞株WistarRA27/3株。
腮腺炎病毒为S79株或经批准的其他腮腺炎病毒减毒株RIT4385株、GerylLynn株。
2.2.病毒含量:
剂型为0.5ml/支,三价疫苗按一定比例混合,其中含麻疹活病毒量3.3—4.0lgCCID50,其中含风疹活病毒量3.3—4.0lgCCID50,其中含腮腺炎活病毒量4.0—5.0lgCCID50,
2.3免疫原性:
大规模人群接种后安全、有效,免疫原性及安全性符合国家规定。
3.外观及规格0.5ml/支/1人份,外观为乳酪色疏松体,复溶后为澄明液体无异物。
4.热稳定性37℃放置7天后:
麻疹活病毒不低于3.0lgCCID50/ml,风疹病毒低度不低于3.0lgCCID50/ml,腺炎活病毒不低于4.3lgCCID50/ml,每毫升三种病毒滴度下降均应不高于1.0lg。
5.牛血清蛋白残留量≤25ng/0.5ml。
6.防腐剂无。
7.无菌检查依法检查,应符合国家规定。
8.异常病毒检查依法检查,应符合国家规定。
9.包装应符合“生物制品包装规程”规定。
10.储运温度于2-8℃避光保存和运输。
11.有效期自鉴定合格之日起,有效期为个18月。
5:
A群脑膜炎球菌多糖疫苗
1.功能及用途
1.1.用途本疫苗服用后可刺激机体产生抗A群脑膜炎球菌引起的流行性脑膜炎的免疫力。
1.2.功能用于预防流行性A群脑膜炎球菌引起的流行性脑膜炎。
2.技术指标
2.1.类型A群脑膜炎奈瑟氏球菌菌种为CMCC29201(A4)。
用A脑膜炎奈瑟氏菌,经提纯获得的加膜多糖抗原,纯化后加入乳糖作为稳定剂冻干制成。
2.2.外观及规格0.5ml/1人份,外观为白色酥松题,加入所附PBS后迅速溶解,溶液为澄明液体无异物,无沉淀。
每一人用剂次(0.5ml/1人份)含A群多糖不低于30ug。
3.热稳定性依法检查,应符合国家规定。
4.无菌检查依法检查,应符合国家规定。
5.异常病毒检查依法检查,应符合国家规定。
6.疫苗稀释剂为无菌无热源的PBS。
7.包装应符合“生物制品包装规程”规定。
8.储运温度于2-8℃避光保存和运输。
9.有效期自鉴定合格之日起,有效期为个18月。
6:
A+C群脑膜炎球菌多糖疫苗
1.功能及用途
1.1.用途本疫苗服用后可刺激机体产生抗A群C群脑膜炎球菌引起的流行性脑膜炎的免疫力。
1.2功能用于预防流行性A群C群脑膜炎球菌引起的流行性脑膜炎。
3.技术指标
3.1类型A群脑膜炎奈瑟氏球菌菌种为CMCC29201(A4),C群脑膜炎奈瑟氏球菌菌种C11290205。
A、C群脑膜炎奈瑟氏菌,经提纯获得的加膜多糖抗原,纯化后加入乳糖作为稳定剂冻干制成。
3.2外观及规格0.5ml/支/1人份,外观为白色酥松题,加入所附PBS后迅速溶解,溶液为澄明液体无异物,无沉淀。
4.多糖含量每一人用剂次(0.5ml/支/1人份)含A群多糖不低于30ug,含C群多糖不低于30ug。
5.热稳定性依法检查,应符合国家规定。
6.无菌检查依法检查,应符合国家规定。
7.异常病毒检查依法检查,应符合国家规定。
疫苗稀释剂为无菌无热源的PBS。
8.包装应符合“生物制品包装规程”规定。
9.储运温度于2-8℃避光保存和运输。
10.有效期自鉴定合格之日起,有效期为个18月。
7:
乙型脑炎减毒活疫苗
1.功能及用途
1.1用途本疫苗服用后可刺激机体产生抗乙脑病毒的免疫力
1.2功能用于预防流行性乙型脑炎
3.技术指标
4.类型(精制)乙型脑炎减毒活疫苗。
每一人用剂次(0.5ml/支)含乙脑活病毒不低于5.4lgPFU。
5.外观及规格0.5ml/支/1人份,外观为淡黄色疏松体,复溶后为橘红色或淡粉色澄明液体无异物,无沉淀。
6.免疫原性及安全性,大规模人群接种后,安全有效,免疫原性及安全性符合国家规定要求。
7.热稳定性于37℃放置7天,病毒滴度应不低于5.7lgPFU/ml.,病毒滴度下降均应不高于1.0lgPFU/ml。
8.无菌检查依法检查,应符合国家规定。
9.异常病毒检查依法检查,应符合国家规定。
10.疫苗稀释剂为灭菌的PBS,PH值应为7.2--8.0,无菌检查符合国家规定。
11.包装应符合“生物制品包装规程”规定。
12.储运温度于2-8℃避光保存和运输。
13.有效期自鉴定合格之日起,有效期为个18月。
8:
冻干甲型肝炎减毒活疫苗
1.功能及用途
1.1用途本疫苗服用后可刺激机体产生抗甲型肝炎病毒的免疫力
1.2功能用于预防甲型肝炎。
3技术指标
3.1类型冻干甲型肝炎减毒活疫苗。
复溶后每瓶1ml,每1人次用剂量为1.0ml,含甲型肝炎活病毒应不低于6.50IgCCID50。
3.2外观及规格应为乳酪色疏松体,复溶后外观为澄明液体,无异物。
4.免疫原性大规模人群接种后安全、有效,免疫原性及安全性符合国家规定要求。
5.热稳定性于37℃放置72小时后,病毒滴度下降应不高于0.50lg.
6.无菌检查依法检查,应符合国家规定。
7.支原体检查依法检查,应符合国家规定。
8.包装应符合“生物制品包装规程”规定。
9.储运温度于2-8℃避光保存和运输。
10.有效期自鉴定合格之日起,有效期为个18个月。
9:
(PPD)卡介苗监测剂
1.
功能及用途
1.1
用途
卡介苗接种后机体免疫反应的监测
1.2
功能
用于监测接种效果。
2
技术指标
2.1
成分
结核菌素纯蛋白衍生物
或
卡介菌纯蛋白衍生物
2.2
规格
每瓶1ml、2ml每1次任用剂量为0.1ml。
含BCG-PPD5IU
每瓶1ml、2ml每1次任用剂量为0.1ml。
含TB-PPD5IU、2IU。
2.3
外观
无色澄明液体,无不溶物或异物。
3.
苯酚含量
应不高于3.0g/L
4.
ph值
应为6.8~7.4
5.
无菌检查
依法检查,应符合国家规定。
6.
包装
应符合“生物制品包装规程”规定。
7.
储运温度
于2-8°c运输保存。
8.
有效期
2-8°c为12个月。
注射器采购要求
一、总体要求:
1外观
1.1在300lx~700lx的照度下,注射器应清洁、无微粒和异物;
1.2注射器不得有毛边、毛刺、塑流、缺损等缺陷;
1.3注射器的外套应有足够的透明度,能清晰地看到基准线;
1.4注射器的内表面(包括橡胶活塞),不得有明显可见的润滑剂汇聚。
2包装
包装上至少应有下列标志:
2.1内装物的说明,包括公称容量;
2.2“无菌”、“无热原”字样或相当标记;
2.3“一次性使用”或相当字样;
2.4批号以“批”字开头;
2.5失效日期的年和月;
2.6若附注射针,应注明规格(外径和长度);
2.7在使用前检查每一单包装完整性的警示;
2.8“政府免费提供”字样。
2.9“免疫规划专用”字样。
二、注射器技术要求:
10.1ml一次性自毁型(蓝芯)注射器
1、最大容量:
0.1ml+20%;
2、刻度:
只允许两个刻度,0和0.1ml;
3、渗漏:
在88kPa负压作用下保持5分钟,外套与活塞接触部位不得产生漏气现象,且活塞与芯杆不得脱离;
4、死腔:
最大残留量≤25微升;
5、排气:
吸入疫苗时带入的气泡易于排出;
6、自毁功能:
当注射器注射0.1ml疫苗或排出0.1ml蒸馏水后,应完全自动丧失其使用功能;
7、活塞在注射器中按每分钟100mm运动,可测的阻力应小于下列值:
7.1最大启动力:
10N;
7.2最大平均力:
5N;
8、外观:
8.1注射器不得有毛边、毛刺、塑流、缺损等缺陷;
8.2注射器的外套应有足够的透明度,能清晰地看到刻度线;
8.3注射器的内表面(包括橡胶活塞),不得有明显可见的润滑剂汇聚;
9、针头:
4.5号针,带针头帽,针头固定于针筒,不可移动,针尖应锋利,穿刺力应符合有关标准;
10、防震荡能力:
在模拟运输的震荡情况下,注射器的使用不受影响。
当注射器从1米高处落到水泥地面后不能影响注射器的使用及自毁功能。
2:
0.5ml一次性自毁型注射器。
1、最大容量:
0.5ml+20%;
2、刻度:
只允许两个刻度,0和0.5ml;
3、渗漏:
在88kPa负压作用下保持5分钟,外套与活塞接触部位不得产生漏气现象,且活塞与芯杆不得脱离;
4、死腔:
最大残留量≤25微升;
5、排气:
吸入疫苗时带入的气泡易于排出;
6、自毁功能:
当注射器注射0.5ml疫苗或排出0.5ml蒸馏水后,应完全自动丧失其使用功能;
7、活塞在注射器中按每分钟100mm运动,可测的阻力应小于下列值:
7.1最大启动力:
10N;
7.2最大平均力:
5N;
8、外观:
8.1注射器不得有毛边、毛刺、塑流、缺损等缺陷;
8.2注射器的外套应有足够的透明度,能清晰地看到刻度线;
8.3注射器的内表面(包括橡胶活塞),不得有明显可见的润滑剂汇聚;
9、针头:
5号针,带针头帽,针头固定于针筒,不可移动,针尖应锋利,穿刺力应符合有关标准;
10、防震荡能力:
在模拟运输的震荡情况下,注射器的使用不受影响。
当注射器从1米高处落到水泥地面后不能影响注射器的使用及自毁功能。
3:
1ml一次性自毁型注射器
1、产品结构:
主要用于人体皮下、静脉和肌肉注射,亦可用于静脉采集血样;
2、产品规格:
针头:
中头式;5号针0.5*20mm针头。
针头采用进口优质医用不锈钢管制造,进口磨尖设备加工,针尖极其锋利,易于穿刺。
符合国家标准。
3、材料及质量要求:
经环氧乙烷灭菌,环氧乙烷的残留量应不大于10微克/克,产品无菌、无热原、无溶血作用,具有良好的滑动性能和密封性,针尖锋利,注射器外套应有足够透明度,能清晰地看到基准线;标尺的分度容量线及计量数字印刷应完整,便于观察液体。
符合国家标准。
4、0.5ml一次性注射器
1、产品结构:
主要用于人体皮下、静脉和肌肉注射,亦可用于静脉采集血样;
2、产品规格:
针头:
中头式;5号针,0.5*25mm针头。
针头采用进口优质医用不锈钢管制造,进口磨尖设备加工,针尖极其锋利,易于穿刺。
符合国家标准。
3、材料及质量要求:
经环氧乙烷灭菌,环氧乙烷的残留量应不大于10微克/克,产品无菌、无热原、无溶血作用,具有良好的滑动性能和密封性,针尖锋利,注射器外套应有足够透明度,能清晰地看到基准线;标尺的分度容量线及计量数字印刷应完整,便于观察液体。
符合国家标准。
5:
1ml一次性注射器
1、产品结构:
主要用于人体皮下、静脉和肌肉注射,亦可用于静脉采集血样;
2、产品规格:
针头:
中头式;5号针0.5*25mm针头。
针头采用进口优质医用不锈钢管制造,进口磨尖设备加工,针尖极其锋利,易于穿刺。
符合国家标准。
3、材料及质量要求:
经环氧乙烷灭菌,环氧乙烷的残留量应不大于10微克/克,产品无菌、无热原、无溶血作用,具有良好的滑动性能和密封性,针尖锋利,注射器外套应有足够透明度,能清晰地看到基准线;标尺的分度容量线及计量数字印刷应完整,便于观察液体。
符合国家标准。
6、2.5ml一次性注射器
1、产品结构:
主要用于人体皮下、静脉和肌肉注射,亦可用于静脉采集血样;
2、产品规格:
针头:
中头式;6号针头,0.6*25mm针头;
针头采用进口优质医用不锈钢管制造,进口磨尖设备加工,针尖极其锋利,易于穿刺。
符合国家标准。
3、材料及质量要求:
经环氧乙烷灭菌,环氧乙烷的残留量应不大于10微克/克,产品无菌、无热原、无溶血作用,具有良好的滑动性能和密封性,针尖锋利,注射器外套应有足够透明度,能清晰地看到基准线;标尺的分度容量线及计量数字印刷应完整,便于观察液体。
符合国家标准。
5ml一次性注射器
1、产品结构:
主要用于人体皮下、静脉和肌肉注射,亦可用于静脉采集血样;
2、产品规格:
针头:
中头式;7号针头,0.7*32mm针头。
针头采用进口优质医用不锈钢管制造,进口磨尖设备加工,针尖极其锋利,易于穿刺。
符合国家标准。
3、材料及质量要求:
经环氧乙烷灭菌,环氧乙烷的残留量应不大于10微克/克,产品无菌、无热原、无溶血作用,具有良好的滑动性能和密封性,针尖锋利,注射器外套应有足够透明度,能清晰地看到基准线;标尺的分度容量线及计量数字印刷应完整,便于观察液体。
符合国家标准。