高中化学工业流程题答题指导.doc
《高中化学工业流程题答题指导.doc》由会员分享,可在线阅读,更多相关《高中化学工业流程题答题指导.doc(6页珍藏版)》请在冰豆网上搜索。
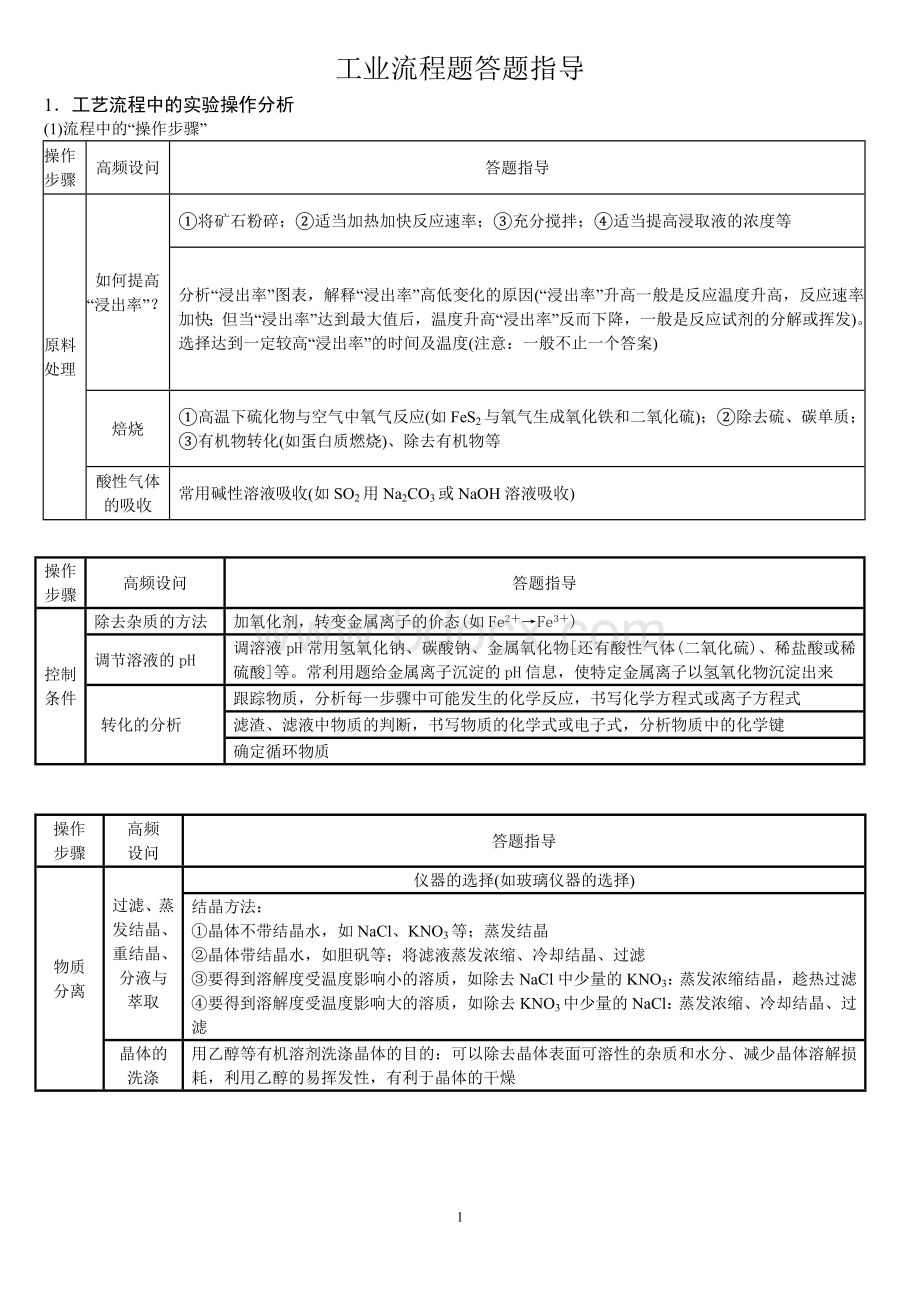
工业流程题答题指导
1.工艺流程中的实验操作分析
(1)流程中的“操作步骤”
操作
步骤
高频设问
答题指导
原料
处理
如何提高
“浸出率”?
①将矿石粉碎;②适当加热加快反应速率;③充分搅拌;④适当提高浸取液的浓度等
分析“浸出率”图表,解释“浸出率”高低变化的原因(“浸出率”升高一般是反应温度升高,反应速率加快;但当“浸出率”达到最大值后,温度升高“浸出率”反而下降,一般是反应试剂的分解或挥发)。
选择达到一定较高“浸出率”的时间及温度(注意:
一般不止一个答案)
焙烧
①高温下硫化物与空气中氧气反应(如FeS2与氧气生成氧化铁和二氧化硫);②除去硫、碳单质;③有机物转化(如蛋白质燃烧)、除去有机物等
酸性气体
的吸收
常用碱性溶液吸收(如SO2用Na2CO3或NaOH溶液吸收)
操作
步骤
高频设问
答题指导
控制
条件
除去杂质的方法
加氧化剂,转变金属离子的价态(如Fe2+→Fe3+)
调节溶液的pH
调溶液pH常用氢氧化钠、碳酸钠、金属氧化物[还有酸性气体(二氧化硫)、稀盐酸或稀硫酸]等。
常利用题给金属离子沉淀的pH信息,使特定金属离子以氢氧化物沉淀出来
物质转化的分析
跟踪物质,分析每一步骤中可能发生的化学反应,书写化学方程式或离子方程式
滤渣、滤液中物质的判断,书写物质的化学式或电子式,分析物质中的化学键
确定循环物质
操作
步骤
高频
设问
答题指导
物质
分离
过滤、蒸发结晶、重结晶、分液与萃取
仪器的选择(如玻璃仪器的选择)
结晶方法:
①晶体不带结晶水,如NaCl、KNO3等;蒸发结晶
②晶体带结晶水,如胆矾等;将滤液蒸发浓缩、冷却结晶、过滤
③要得到溶解度受温度影响小的溶质,如除去NaCl中少量的KNO3:
蒸发浓缩结晶,趁热过滤
④要得到溶解度受温度影响大的溶质,如除去KNO3中少量的NaCl:
蒸发浓缩、冷却结晶、过滤
晶体的洗涤
用乙醇等有机溶剂洗涤晶体的目的:
可以除去晶体表面可溶性的杂质和水分、减少晶体溶解损耗,利用乙醇的易挥发性,有利于晶体的干燥
操作步骤
高频
设问
答题指导
物质分离
过滤、蒸发结晶、重结晶、分液与萃取
仪器的选择(如玻璃仪器的选择)
结晶方法:
①晶体不带结晶水,如NaCl、KNO3等;蒸发结晶
②晶体带结晶水,如胆矾等;将滤液蒸发浓缩、冷却结晶、过滤
③要得到溶解度受温度影响小的溶质,如除去NaCl中少量的KNO3:
蒸发浓缩结晶,趁热过滤
④要得到溶解度受温度影响大的溶质,如除去KNO3中少量的NaCl:
蒸发浓缩、冷却结晶、过滤
晶体的洗涤
用乙醇等有机溶剂洗涤晶体的目的:
可以除去晶体表面可溶性的杂质和水分、减少晶体溶解损耗,利用乙醇的易挥发性,有利于晶体的干燥
(2)流程中的“操作目的”
操作目的
答题指导
固体原料进
行“粉碎”
减小颗粒直径,增大浸取时的反应速率,提高浸取率
酸(或碱)溶
①原料经酸(或碱)溶后转变成可溶物进入溶液中,以达到与难溶物分离的目的
②用碱性溶液吸收酸性气体原料
灼烧(焙烧)
①除去硫、碳单质;②有机物转化、除去有机物;③高温下原料与空气中氧气反应等
金属用热碳酸
钠溶液洗涤
除去金属表面的油污
过滤
固体与液体的分离;要分清楚需要的物质在滤液中还是在滤渣中。
滤渣是难溶于水的物质,如SiO2、PbSO4、难溶的金属氢氧化物和碳酸盐等
操作目的
答题指导
萃取与分液
选用合适的萃取剂(如四氯化碳、金属萃取剂),萃取后,静置、分液——将分液漏斗玻璃塞的凹槽与分液漏斗口的小孔对准。
下层液体从下口放出,上层液体从上口倒出
加入氧化剂
(或还原剂)
①转化为目标产物的价态
②除去杂质离子(如把Fe2+氧化成Fe3+,而后调溶液的pH,使其转化为Fe(OH)3沉淀除去)
加入沉淀剂
①生成硫化物沉淀(如加入硫化钠、硫化铵、硫化亚铁等)
②加入可溶性碳酸盐,生成碳酸盐沉淀
③加入氟化钠,除去Ca2+、Mg2+
判断能否加
其他物质
要考虑是否引入杂质(或影响产物的纯度)等
操作目的
答题指导
在空气中或在其他气体中进行的反应或操作
要考虑O2、H2O、CO2或其他气体是否参与反应;能否达到隔绝空气、防氧化、防水解、防潮解等目的
调溶液pH
①生成金属氢氧化物,以达到除去金属离子的目的
②抑制盐类水解
③促进盐类水解生成沉淀,有利于过滤分离
④用pH计测量溶液的pH
⑤用pH试纸测定溶液的pH:
将一小块pH试纸放在洁净干燥的玻璃片或表面皿上,用洁净的玻璃棒蘸取少量待测液点在pH试纸的中部,待试纸变色后再与标准比色卡对照读数
操作目的
答题指导
控制温度
①控制物质的溶解与结晶
②防止某些物质分解或挥发(如H2O2、氨水、草酸)
③控制反应速率、使催化剂达到最大活性、防止副反应的发生
④控制化学反应的方向,使化学平衡移动
⑤煮沸:
促进溶液中的气体(如氧气)挥发逸出
⑥趁热过滤:
减少因降温而析出的溶质的量
洗涤晶体
洗涤试剂
适用范围
目的
蒸馏水
冷水
产物不溶于水
除去固体表面吸附着的××杂质;可适当降低固体因为溶解而造成的损失
热水
有特殊物质其溶解度随着温度升高而下降
除去固体表面吸附着的××杂质;可适当降低固体因为温度变化溶解而造成的损失
洗涤晶体
有机溶剂(酒精、丙酮等)
固体易溶于水、
难溶于有机溶剂
减少固体溶解;利用有机溶剂的挥发性除去固体表面的水分,产品易干燥
饱和溶液
对纯度要求
不高的产品
减少固体溶解
酸、碱溶液
产物不溶
于酸、碱
除去固体表面吸附着的可溶于酸、碱的杂质;减少固体溶解
洗涤沉淀方法:
向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次
提高原子
利用率
绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用)
2.流程中物质成分的确定
(3)滤渣、滤液成分的确定
要考虑样品中原料和杂质的成分在每一步骤中与每一种试剂反应的情况:
①反应过程中哪些物质(离子)消失了?
②所加试剂是否过量或离子间发生化学反应,又产生了哪些新离子?
要考虑这些离子间是否会发生反应。
3.化工流程题中的“流程分析”
流程图的结构图解
一、物质制备型
【题型方法技巧】
明确题目要制备什么物质,给的原料是什么,利用已有化学知识并结合题干给出的提示信息勾勒出原料到目标产物的化学转化路径。
流程中药品、各种条件的选择都是为了能更多地获得产品,核心是提高反应物的转化率。
围绕这个核心分析药品、操作、条件的作用,做到有的放矢。
1.如果在制备过程中出现或用到受热易分解的物质,则要注意对温度的控制。
如侯德榜制碱中的NaHCO3,还有H2O2、Ca(HCO3)2、KMnO4、AgNO3、HNO3(浓)等物质。
2.如果产物是一种会水解的盐,且水解产物中有挥发性的酸产生时,则要加相对应的酸来抑制水解。
如制备FeCl3、AlCl3、MgCl2、Cu(NO3)2等物质,要蒸发其溶液得到固体溶质时,都要加相应的酸或在酸性气流中进行来抑制其水解。
3.如果产物是一种强氧化性物质或强还原性物质,则要防止它们被其他物质还原或氧化。
如产物是含Fe2+、SO、I-等离子的物质,要防止反应过程中O2的介入。
4.如果产物是一种易吸收空气中的CO2或水(潮解或发生反应)而变质的物质(如NaOH固体等),则要注意在制备过程中对CO2或水的去除,也要防止空气中的CO2或水进入装置中。
5.当题目中给出多种物质的沸点、溶解度信息,则意味着需要用蒸馏、高温(或低温)过滤来进行分离。
6.在回答题目中条件的选择原因时主要可从以下几个方面分析:
(1)对反应速率有何影响。
(2)对平衡转化率是否有利。
(3)对综合效益有何影响。
如原料成本、原料来源(是否广泛、可再生)、能源成本、对设备的要求、环境保护(从绿色化学方面作答)等。
二、分离提纯型
【题型方法技巧】
1.题型特点
分离提纯型工艺流程题多以矿物、各种废弃物为原料,经过各种处理,除去杂质获得有价值的产品。
考查的核心在各种分离提纯的实验操作以及条件的控制选择上。
虽然把题目形式设计为工艺流程框图,但其实质还是对混合物的除杂、分离、提纯操作的考查。
2.解题思路
从试题中找出想要什么,要除去的杂质有哪些;加入的试剂都与哪些物质发生了反应,转化成了什么物质;怎样操作才能将杂质除去(注重信息的提取与加工)。
核心是杂质的去除要彻底。
3.常用分离方法
(1)固体与固体的分离
(2)固体与液体的分离
(3)液体与液体的分离
4.常见操作的答题思考角度
常见操作
答题思考角度
分离、提纯
过滤、蒸发、分液、蒸馏等常规操作。
从溶液中得到晶体的方法:
蒸发浓缩—冷却结晶—过滤(—洗涤、干燥);或蒸发结晶
提高原子利用率
绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用)
在空气中或在其他气体
中进行的反应或操作
要考虑O2、H2O、CO2或其他气体是否参与反应或能否达到隔绝空气,防氧化、水解、潮解等目的
判断沉淀是否洗涤干净
取少量最后一次洗涤液,检验其中是否还有某种离子存在
控制溶液的pH
方法见前述
控制温度(常用水
浴、冰浴或油浴)
①防止副反应的发生;
②使化学平衡移动:
控制化学反应的方向;
③控制固体的溶解与结晶;
④控制反应速率:
使催化剂达到最大活性;
⑤升温:
促进溶液中的气体逸出,使某物质达到沸点挥发;
⑥加热煮沸:
促进水解,聚沉后利于过滤分离;
⑦趁热过滤:
减少因降温而析出溶质的量;
⑧降温:
防止物质高温分解或挥发;降温(或减压)可以减少能源成本,降低对设备的要求
洗涤晶体
①常见洗涤方式见前述;
②洗涤沉淀方法:
往漏斗中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次
表面处理
“水洗”除去表面可溶性杂质,金属晶体可用机械法(打磨)或化学法除去表面氧化物、提高光洁度等
6