浙江绍兴三中届高三第二次模拟考试理科综合化学部分.docx
《浙江绍兴三中届高三第二次模拟考试理科综合化学部分.docx》由会员分享,可在线阅读,更多相关《浙江绍兴三中届高三第二次模拟考试理科综合化学部分.docx(11页珍藏版)》请在冰豆网上搜索。
浙江绍兴三中届高三第二次模拟考试理科综合化学部分
2015年高考理科综合模拟试卷(化学部分)
双向明细表
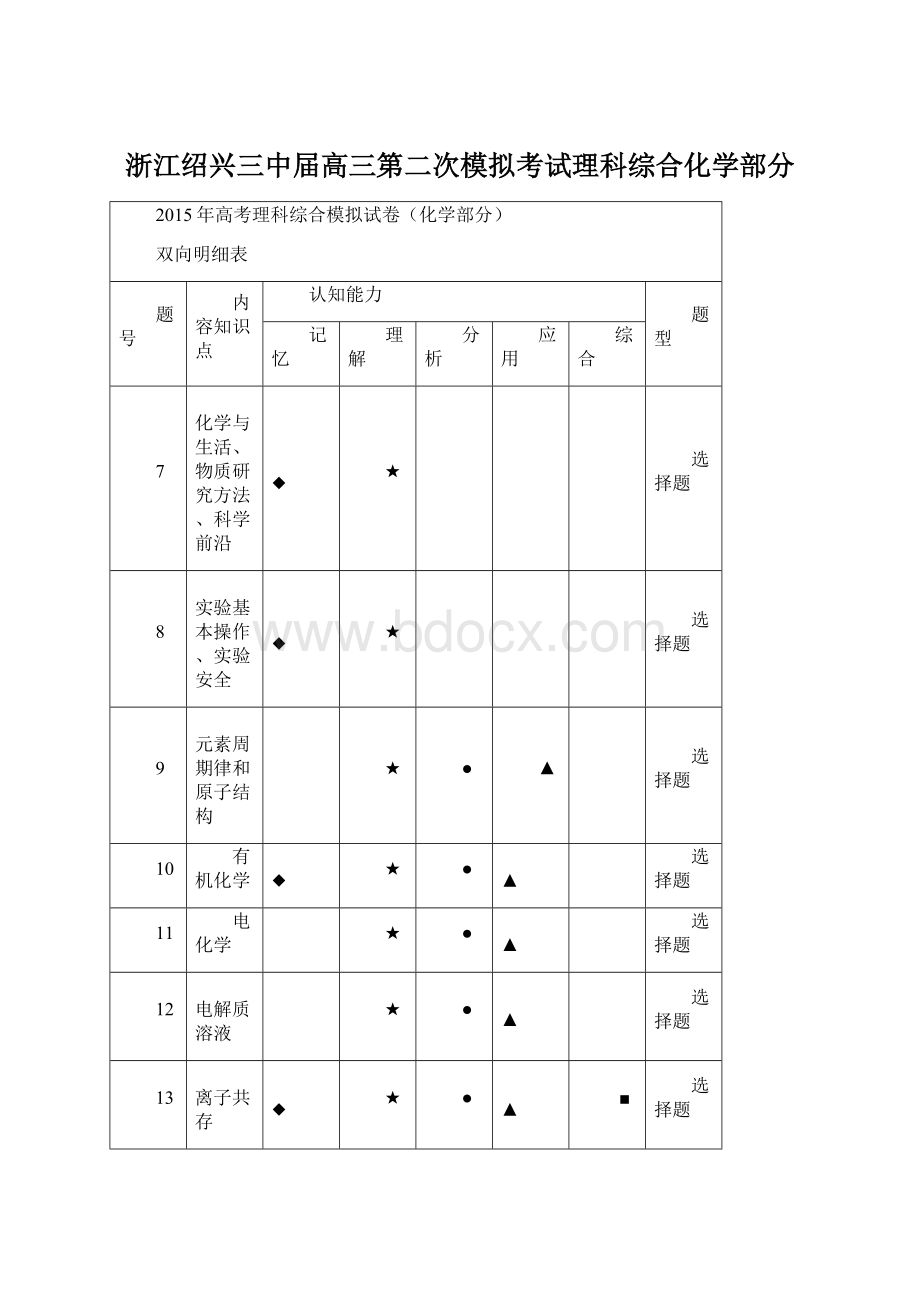
题号
内容知识点
认知能力
题型
记忆
理解
分析
应用
综合
7
化学与生活、物质研究方法、科学前沿
◆
★
选择题
8
实验基本操作、实验安全
◆
★
选择题
9
元素周期律和原子结构
★
●
▲
选择题
10
有机化学
◆
★
●
▲
选择题
11
电化学
★
●
▲
选择题
12
电解质溶液
★
●
▲
选择题
13
离子共存
◆
★
●
▲
■
选择题
26
有机综合
◆
★
●
▲
■
解答题
27
元素、能量、电解质溶液
◆
★
●
▲
■
解答题
28
自发反应、速率、化学平衡综合
◆
★
●
▲
■
解答题
29
实验综合
◆
★
●
▲
■
解答题
浙江绍兴三中2015届高三第二次模拟考试理科综合(化学部分)
考试时间:
50分钟试卷满分:
100分
可能用到的相对原子质量:
H-1C-12O-16Mg-24Al-27Cl-35.5Cu-64
第Ι卷(选择题共42分)
一、选择题(本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一个选项正确,选对的得6分,选错的得0分。
)
7、(改编2015温州一模)下列说法不正确的是(▲)
A.2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨
率步入了纳米时代。
利用此类光学显微镜可以观察活细胞内蛋白质等大分子。
B.能量是可以互相转化的。
植物的光合作用可将太阳能转变成化学能,单晶硅可将光能转变成电能。
原电池和电解池可实现化学能和电能的相互转换
C.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法
D.利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法
8、(原创)下列说法正确的是(▲)
A.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B.用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH值
C.用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液
D.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理
9、(原创)主族元素X、Y、Z的简单离子核外电子排布相同,已知原子半径X>Y,离子半
径Y>X,且Y和Z能形成离子化合物。
由此判断关于三种元素说法正确的是(▲)
A.原子序数不可能为Z>Y>XB.X可能是非金属元素
C.Z一定在Y的下一周期D.Y不可能在Z的下一周期
10、(改编2015宁波一模)下列说法正确的是(▲)
A.丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物
B.分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4﹣二甲基戊烷或3,3﹣二甲基戊烷
C.完全燃烧等质量的甲醛、乙酸、葡萄糖、蔗糖消耗的氧气量相等
D.还原性染料靛蓝的结构简式为:
,它的分子式是:
C16H10N2O2
11、(改编2013浙江省赛)电浮选凝聚法是工业上采用的一种污水处
理方法,某研究小组用电浮选凝聚法处理污水,
设计装置如图所示,下列说法正确的是(▲)
A.装置A中碳棒为阴极
B.装置B中通入空气的电极反应是O2+2H2O+4e﹣═4OH﹣
C.污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果
D.标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH411.2L
12、(改编2014年上海东华杯)常温下,向20ml0.1mol/L酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液。
有关微粒的物质的量与混合溶液的pH有如图关系,
下列说法正确的是(▲)
A.HT-在溶液中水解程度大于电离程度
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C.当V(NaOH)=30mL时,溶液中存在c(Na+)﹥c(HT-)﹥c(T2-)﹥
c(OH-)﹥c(H+)
D.当V(NaOH)=40ml时,溶液中存在c(OH-)=c(HT-)+2c(H2T)+c(H+)
13、(原创)某混合溶液中可能含有下列离子中的若干种:
K+、Na+、Fe2+、Fe3+、SO42-、NO2-、
CO32-,现取三份20mL该溶液进行如下实验:
(1)第一份加入足量盐酸,无任何气体产生
(2)第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
(3)第三份滴加0.10mol·L-l酸性KMnO4溶液,恰好完全反应,消耗其体积为VmL
(4)另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是(▲)
A.原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32-
B.由实验
(1)无法推断原混合溶液中是否含有SO42-
C.由实验
(2)、(3)可判定原混合溶液中是否含有Fe3+
D.由实验(3)可判定原混合溶液中存在NO2-
第Ⅱ卷(非选择题部分共58分)
26(改编2014绍兴期末)(10分)甘蔗主要用于生产蔗糖,生产后的甘蔗渣主要成分为纤维素,综合利用方案如下:
(1)写出D中的官能团_______▲________;
(2)“B→C”反应类型为_______▲________;
(3)等物质的量的A、B、C完全燃烧时消耗O2之比为_______▲________;
(4)在催化剂存在条件下,B与乙烯发生加成反应得到不与金属Na反应的有机物,试写
出该反应的的化学方程式_______▲________;
(5)设计简单实验方案,如何从B、C、D的混合液中提纯D:
▲。
27(改编2013年睿达杯)(18分)Ⅰ.A、B、C是中学化学中常见的三种短周期元素。
已知:
①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出C的单质和强碱溶液反应的离子方程式▲。
(2)意大利罗马大学的FuNvioCacace等人获得了极具理论研究意义的B4气态分子。
B4分子结构与白磷分子结构相似,已知断裂1molB—B吸收167kJ的热量,生成1molB≡B放
出942kJ热量。
试写出由B4气态分子变成B2气态分子的热化学方程式:
▲。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。
X遇水蒸气可形成一种常见的漂白性物质。
则X的结构式为▲,X与水反应的化学方程式是▲。
(4)B2H4是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:
H2B-BH2+H2O
▲。
Ⅱ.由2种元素组成的化合物M,是某种具有优异磁学性质的新型电子材料的主要成分。
其制备流程如下:
(5)从氧化还原角度分析,说明NaNH2制备中是否会生成Na2NH、Na3N的原因:
▲;
(6)根据图示信息,写出NaN3制备的方程式▲;
(7)取4.76g的M用足量稀硫酸溶解,在所得反应液中加入足量的NaOH溶液,发现有刺
激性气味且能使湿润红色石蕊试纸变蓝的气体产生,同时溶液中产生白色沉淀,迅速
变成灰绿色,最终变为红褐色,沉淀灼烧后质量为6.40g。
根据以上分析,写出元素G的名称▲,M的化学式▲;
28、(改编)(15分)Ⅰ.在一个容积固定不变的密闭容器中进行反应:
2X(g)+Y(g)
2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。
回答下列问题:
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的熵变△S▲0(填:
“<,>,=”)。
该反应在▲(填:
高温或低温)条件下能自发进行。
(2)该反应的v-t图像如图2中左图所示。
若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图2中右图所示。
以下说法正确的是▲。
①a1>a2②b1t2
④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如右上图所示。
下列说法正确的是▲。
A.A、C两点的反应速率:
A>C
B.A、C两点的气体密度:
A<C
C.B、C两点的气体的平均相对分子质量:
B<C
D.由状态B到状态A,可以用加热的方法
Ⅱ.(4)工业制取水煤气的过程中会伴随:
CO(g)+H2O(g)
CO2(g)+H2(g)⊿H﹥0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是▲。
实验编号
反应物投入量
平衡时H2浓度
吸收或放出的热量
反应物转化率
A
1、1、0、0
c1
Q1
α1
B
0、0、2、2
c2
Q2
α2
C
2、2、0、0
c3
Q3
α3
A.2c1=c2=c3B.2Q1=Q2=Q3C.α1=α2=α3D.α1+α2=1
(5)下图表示上述反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:
图中t2时刻发生改变的条件是▲(写出一种)。
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。
29、(改编2009江门一模)(15分)氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、纺织印染、颜料、医药、电镀、有机合成等行业。
以工业海绵铜为原料,采用硝酸铵氧化分解技术生产硫酸铜进而生产氯化亚铜。
海绵铜的主要成分是CuO和Cu,生产工艺流程图如下。
思考并回答下列问题。
(1)生产原理:
①溶解时生成的还原产物在酸性溶液中稳定存在,请写出此时的氧化还原反应离子方程
式:
▲。
②还原氯化:
2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4
(2)得到副产品的化学式为▲;
(3)生产后阶段,从滤液获得副产品的步骤:
①蒸发浓缩②冷却结晶③▲
④洗涤⑤干燥。
(4)产品的洗涤方法是,先用pH=2的稀H2SO4洗,后用95%的酒精洗。
酒精洗的目的是▲;请设计简单实验方案,检验稀H2SO4洗时是否洗干净:
▲。
(5)定量分析
称取2.000gCuCl样品(杂质不参与反应),溶于一定量的0.5000mol·L-1FeCl3溶液中,
加水稀释至200mL得到溶液,取20.00mL用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,
消耗20.00mLCe(SO4)2。
①此实验涉及溶液配制与定量滴定的基本操作中,合理的是▲;
②有关反应式:
Fe3++CuCl=Fe2++Cu2++Cl-Ce4++Fe2+=Fe3++Ce3+
则样品中CuCl的质量分数▲。
2015年高考理科综合模拟试卷(化学部分)答题卷
一、选择题(本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一个选项正确,选对的得6分,选错的得0分。
)
7
8
9
10
11
12
13
D
C
A
D
C
D
C
26.(10分)
(1)
(2)(3)
(4)
(5)
27.(18分)
(1)
(2)
(3)
(4)
(5)
(6)
(7)
28、(15分)
⑴,
⑵⑶
⑷
⑸
29.(15分)
(1)
(2)(3)
(4)
(5)①②
2015年高考理科综合模拟试卷(化学部分)参考答案及评分标准
一、选择题(本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一个选项正确,选对的得6分,选错的得0分。
)
7
8
9
10
11
12
13
D
C
A
D
C
D
C
26.(10分)
(1)—COO-(酯基)(2分)
(2)氧化反应(2分)(3)6:
3:
2(2分)
(4)
(2分)
(5)向待提纯混合物中加入足量的饱和Na2CO3溶液,振荡、静止、分液,然后水洗、干燥。
(2分)
27.(18分)
(1)C12+2OH-=ClO-+H2O(2分)
(2)N4(g)====2N2(g);△H=-882kJ/mol(2分)
(3)Cl
Cl-N-Cl(2分)NCl3+3H2O====NH3+3HClO(2分)
(4)H2B-BH+3+OH-(或B2H+5+OH-)(2分)
(5)NaNH2中H元素为+1价,具有氧化性,可以氧化Na,故可以生成。
(2分)
(6)2NaNH2+N2O=NaN3+NH3+NaOH(2分)
(7)铁(2分)Fe4N(2分)
28、(15分)
⑴<(2分),低温(2分)
⑵②③⑤(2分)⑶BD(2分)(4)AD(2分)
(5)升高温度或者充入水蒸气(答出其一得2分)(3分)
29.(15分)
(1)4Cu+10H++NO3-=4Cu2++NH4++3H2O(2分)
(2)(NH4)2SO4(2分)
(3)过滤(2分)
(4)酒精易挥发,快速得到干燥CuCl产品,防止被氧化。
(2分)
取少量最后一次洗出液于试管中,加入适量NaOH固体并加热,产生能使湿润红色石蕊试纸变蓝的气体,则样品未洗干净;否则洗干净。
(3分)
(5)①BC(2分)②99.5%(2分)