届高考化学第一轮总复习全程训练课练28电解池金属的电化学腐蚀与防护有解析.docx
《届高考化学第一轮总复习全程训练课练28电解池金属的电化学腐蚀与防护有解析.docx》由会员分享,可在线阅读,更多相关《届高考化学第一轮总复习全程训练课练28电解池金属的电化学腐蚀与防护有解析.docx(16页珍藏版)》请在冰豆网上搜索。
届高考化学第一轮总复习全程训练课练28电解池金属的电化学腐蚀与防护有解析
课练28 电解池金属的电化学腐蚀与防护
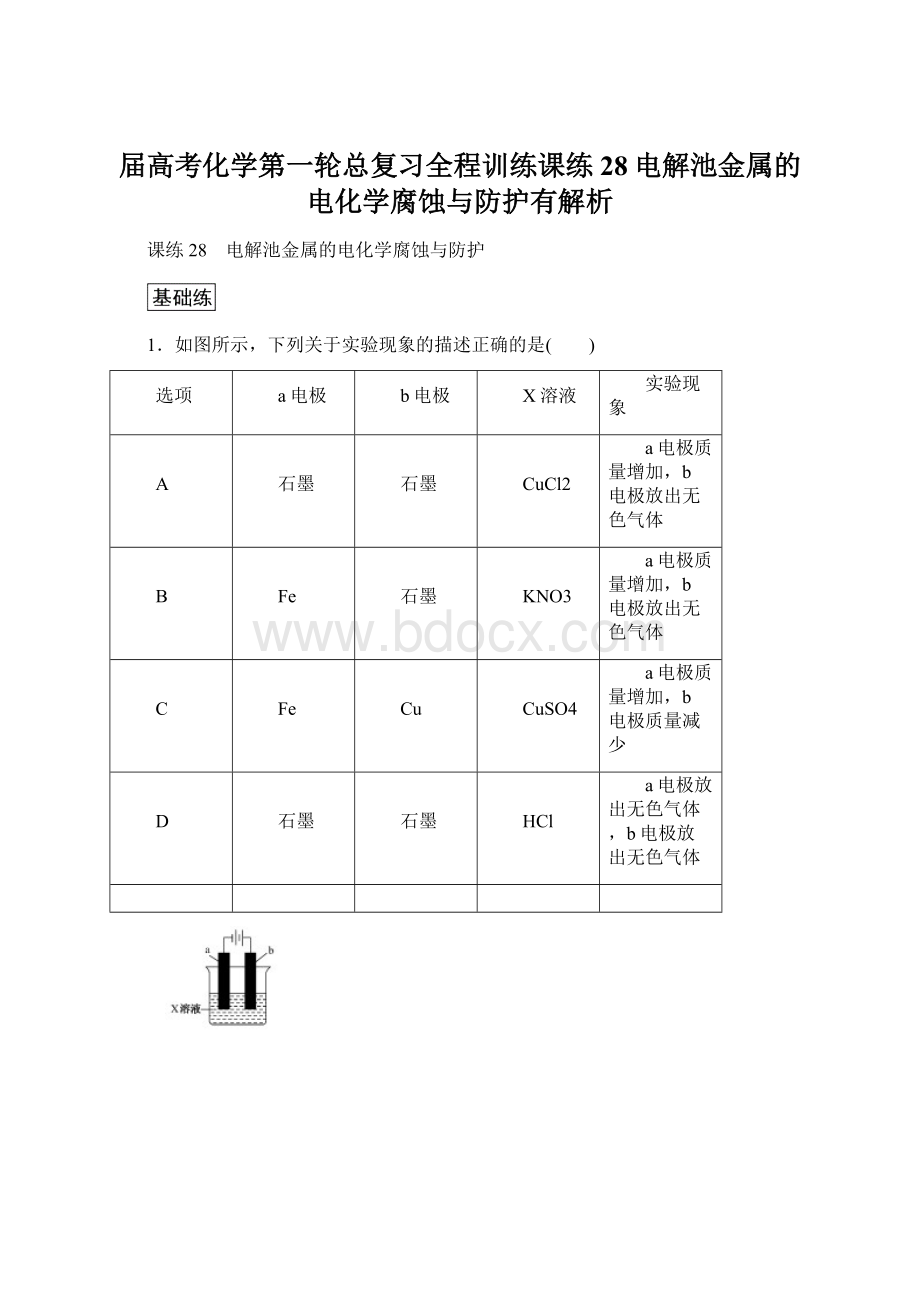
1.如图所示,下列关于实验现象的描述正确的是( )
选项
a电极
b电极
X溶液
实验现象
A
石墨
石墨
CuCl2
a电极质量增加,b电极放出无色气体
B
Fe
石墨
KNO3
a电极质量增加,b电极放出无色气体
C
Fe
Cu
CuSO4
a电极质量增加,b电极质量减少
D
石墨
石墨
HCl
a电极放出无色气体,b电极放出无色气体
2.某研究性学习小组用如图装置研究不同能量之间的转化问题。
下列说法正确的是( )
A.断开开关S1,按下开关S2,化学能转化为电能,电能转化为光能等
B.断开开关S1,按下开关S2,此时构成的装置属于电解池
C.断开开关S2,按下开关S1,此时构成的装置属于原电池
D.断开开关S2,按下开关S1,化学能转化为电能
3.关于下列各装置图的叙述中,不正确的是( )
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:
Cu+2Fe3+===Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
4.下列防止金属腐蚀的做法不可行的是( )
A.军事演习期间给坦克的履带上刷上油漆以防止生锈
B.地下钢管道每隔一段距离就连接一定数量镁块
C.在轮船外壳水线以下部分装上一定数量的锌块
D.洗衣机的滚筒采用不锈钢材料,既耐磨又耐腐蚀
5.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。
则电解过程中转移电子的物质的量为( )
A.0.4molB.0.5molC.0.6molD.0.8mol
6.分别放置在如图所示装置(都盛有0.1mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是( )
7.甲装置中所含的是物质的量之比为12的CuSO4和NaCl的混合溶液,电解过程中溶液的pH随时间t变化的示意图如乙所示(不考虑电解产物与水的反应)。
试分析下列叙述中正确的是( )
A.该混合溶液中的SO
导致A点溶液的pH小于B点
B.AB段与BC段在阴极上发生的反应是相同的,即:
Cu2++2e-===Cu
C.BC段阴极产物和阳极产物的体积之比为21
D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀
8.
(2017·南京模拟)如图所示烧杯中试管内有一枚铁钉,放置数天观察(假设水不蒸发)。
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于________(填“化学”或“电化学”)腐蚀。
(2)若试管内液面上升,发生的是________腐蚀,则正极反应式为______________________________,负极反应式为________________________________________________________________________。
要顺利完成此实验,所用的电解质溶液可以是________________________________________________________________________。
(3)若试管内液面下降,发生的是________腐蚀,正极反应式为________________________________________________________________________。
负极反应式为________________________________________________________________________。
要顺利完成此实验,所用的电解质溶液可以是________________________________________________________________________。
9.
(1)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为________________________________________________________________________
________________________________________________________________________
(2)草酸(HOOC—COOH)是一种有机二元酸,用惰性电极电解饱和草酸溶液可制得乙醛酸(OHC—COOH),阴极的电极反应式为________________________________________________________________________
________________________________________________________________________。
(3)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2===2N2+6H2O。
该电池负极的电极反应式为________________________________________________________________________;
用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是________。
a.电能全部转化为化学能
b.SO
的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA
10.已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
2PbSO4+2H2O,现设计如图所示进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减小11.2g。
请回答下列问题:
(1)A是铅蓄电池的________(填“正”或“负”)极,铅蓄电池的正极反应式为________。
(2)Ag电极上的电极反应式为________,析出的物质共________g。
(3)Cu电极上的电极反应式为________,CuSO4溶液的浓度________(填“减小”、“增大”或“不变”)。
(4)如图表示电解时某个量(纵坐标x)随时间变化的曲线,这个量x最有可能表示的是________(填序号)。
a.两个U形管中析出的气体体积
b.两个U形管中阳极质量的减少量
c.两个U形管中阴极质量的增加量
1.(2016·新课标全国卷Ⅰ)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是( )
A.通电后中间隔室的SO
离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
2.(2013·全国大纲卷)电解法处理酸性含铬废水(主要含有Cr2O
)时,以铁板作阴、阳极,处理过程中存在反应Cr2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。
下列说法不正确的是( )
A.阳极反应为Fe-2e-===Fe2+
B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12mol电子,最多有1molCr2O
被还原
3.(2015·上海卷)
研究电化学腐蚀及防护的装置如图所示。
下列有关说法错误的是( )
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为O2+2H2O+4e-===4OH-
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为2H++2e-===H2↑
4.(2013·北京卷)下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A.水中的钢闸门连接电源的负极
B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜
D.地下钢管连接镁块
5.(2015·四川卷)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式:
Cl-+2OH--2e-===ClO-+H2O
C.阴极的电极反应式:
2H2O+2e-===H2↑+2OH-
D.除去CN-的反应:
2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O
6.
(1)(2014·新课标全国卷Ⅰ,节选)H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式:
________________________________________________________________________。
②分析产品室可得到H3PO2的原因:
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:
将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。
其缺点是产品中混有________杂质,该杂质产生的原因是________________________________________________________________________。
(2)(2014·新课标全国卷Ⅱ,节选)PbO2可由PbO与次氯钠溶液反应制得,反应的离子方程式为________________________________________________________________________
____________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。
阳极发生的电极反应式为____________,阴极上观察到的现象是____________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为____________,这样做的主要缺点是________________。
7.(2017·长春检测)下列装置的线路接通后,经过一段时间,溶液的pH明显减小的是( )
8.(2017·日照模拟)纳米级Cu2O由于具有优良的催化性能而受到关注。
采用离子交换膜控制电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,发生的反应为:
2Cu+H2O
Cu2O+H2↑。
下列说法正确的是( )
A.钛电极发生氧化反应
B.阳极附近溶液的pH逐渐增大
C.离子交换膜应采用阳离子交换膜
D.阳极反应式是:
2Cu+2OH--2e-===Cu2O+H2O
9.(2017·罗山模拟)某学生为探究铜生锈的过程设计如图所示装置,下列选项正确的是( )
A.一段时间后C棒上有气泡冒出,附近的溶液变为红色
B.一段时间后溶液中会有蓝色沉淀产生
C.Cu棒为正极,电极反应式:
Cu-2e-===Cu2+
D.C棒为正极,电极反应式:
2H++2e-===H2↑
10.(2017·衡水模拟)1L某溶液中含有的离子如下表:
离子
Cu2+
Al3+
NO
Cl-
物质的量浓度(mol·L-1)
1
1
a
1
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是( )
A.电解质溶液pH=0B.阳极生成1.5molCl2
C.a=3D.阴极析出的金属是铜与铝
11.(2017·郑州一模)下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。
下列叙述正确的是( )
A.装置Ⅰ在反应过程中只生成NO2气体
B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+
12.(2017·正定月考)
某种聚合物锂离子电池放电时的反应为Li1-xCoO2+LixC6===6C+LiCoO2,其电池装置如图所示。
下列说法不正确的是( )
A.放电时,LixC6发生氧化反应
B.充电时,Li+通过阳离子交换膜从左向右移动
C.充电时,将电池的负极与外接电源的负极相连
D.放电时,电池的正极反应为Li1-xCoO2+xLi++xe-===LiCoO2
13.电解原理在化学工业中有广泛应用。
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则:
①电解池中Y电极上的电极反应式为________________________________________________________________________,
在Y电极附近观察到的现象是________________________________________________________________________;
检验该电极反应产物的方法是________________________________________________________________________。
②X电极上的电极反应式为________________________________________________________________________。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:
①X电极的材料是________,电极反应式是________________。
②Y电极的材料是________,电极反应式是________________。
(说明:
杂质发生的电极反应不必写出)
课练28 电解池
金属的电化学腐蚀与防护
基础练
1.解析 A选项a电极质量增加,析出铜,b电极放出黄绿色气体氯气,错误;B选项两极均放出无色气体,a电极氢气,b电极氧气,错误;C选项正确,相当于铁上镀铜;D选项a电极放出无色气体,b电极放出黄绿色气体氯气,错误。
答案 C
2.解析 S1断开,S2按下,构成原电池;S1按下,S2断开,构成电解池。
答案 A
3.解析 A选项正确,精炼铜时,粗铜作阳极,与电源正极相连,电解质溶液为CuSO4溶液;B选项装置②的总反应是:
Fe+2Fe3+===3Fe2+,Cu是正极不反应;C选项正确,是牺牲阳极的阴极保护法;D选项正确。
答案 B
4.解析 油漆经不住高温,军事演习期间,坦克高速行驶履带会发热,故A项错;B、C项均属于牺牲阳极的阴极保护法,正确;D项滚筒采用的不锈钢材料既耐磨又耐腐蚀,正确。
答案 A
5.解析 电解硫酸铜时,开始电解硫酸铜和水生成铜、氧气和硫酸,后来电解水生成氢气和氧气。
如果只按照第一阶段电解,反应后只需要加入氧化铜或碳酸铜即可,但是现在加入的是Cu(OH)2,相当于加入了0.1molCuO和0.1molH2O,说明第二阶段反应消耗了0.1molH2O,该阶段转移了0.2mol电子,第一阶段转移了0.2mol电子,所以总共转移了0.4mol电子,选A。
答案 A
6.解析 A项,因锌与稀硫酸反应而腐蚀;B项,因镁比锌活泼锌得到保护;C项,锌比锡活泼,锌腐蚀得更快;D项,是外加电源,锌与电源的负极相连而得到保护,则腐蚀的最慢。
答案 D
7.解析 由题意,没有电解前,溶液中的铜离子水解,溶液显酸性,开始时电解CuCl2即AB段,当CuCl2电解完后,溶液是硫酸钠溶液,显中性,这时再电解就是电解水,即BC段,AB段阴极生成铜,BC段阴极生成氢气;BC段电解水,阴极产物氢气和阳极产物氧气的体积之比为21;在整个电解的过程中不会出现淡蓝色的Cu(OH)2沉淀,A、B、D错误,选C。
答案 C
8.解析
(1)根据原电池的构成条件:
有两种活性不同的材料(Fe为负极,碳为正极),有电解质溶液,形成闭合回路,可知铁钉的腐蚀属于电化学腐蚀。
(2)试管中的液面上升,表明内部压强减小,即发生吸氧腐蚀,故正极反应式为2H2O+O2+4e-===4OH-,负极反应式为Fe-2e-===Fe2+;吸氧腐蚀的电解质溶液是中性或弱酸性溶液,如氯化钠溶液。
(3)试管中的液面下降,表明发生了析氢腐蚀,则正极反应式为2H++2e-===H2↑,负极反应式为Fe-2e-===Fe2+;此时需要酸性电解质溶液,中稀硫酸等。
答案
(1)电化学
(2)吸氧 2H2O+O2+4e-===4OH- Fe-2e-===Fe2+ 氯化钠溶液(或其他合理答案)
(3)析氢 2H++2e-===H2↑ Fe-2e-===Fe2+ 稀硫酸(或其他合理答案)
9.解析
(1)CO
在阳极失电子,化合价升高的只能为氧,生成氧气,碳元素化合价不变,所以另外一种气体为CO2,配平即可。
(2)草酸在阴极放电,C由草酸(H2C2O4)中的+3价降到乙醛酸(H2C2O3)中的+2价,一个草酸分子得到2个电子,酸性条件下用H+配平电荷,最后补水配氢即可。
(3)SO
不参加反应,b正确;阳离子向阴极移动,c错误;Ag、Pt、Au等金属在阳极不参加反应,最终沉积于阳极泥中,d正确;阳极失电子的不仅有铜,还有Al、Zn等,故e错误。
答案
(1)2CO
-4e-===O2↑+2CO2↑
(2)HOOC—COOH+2e-+2H+===OHC—COOH+H2O
(3)2NH3-6e-+6OH-===N2+6H2O bd
10.解析 根据在电解过程中铁电极质量减小可判断A是铅蓄电池的负极,B是铅蓄电池的正极。
电解时Ag电极作阴极,电极反应式为2H++2e-===H2↑,Fe电极作阳极,电极反应式为Fe-2e-===Fe2+,左侧U形管中的总反应式为Fe+2H+===Fe2++H2↑。
Zn电极作阴极,电极反应式为Cu2++2e-===Cu,铜电极作阳极,电极反应式为Cu-2e-===Cu2+。
右侧U形管相当于电镀装置,电镀过程中CuSO4溶液的浓度保持不变,根据上述分析可得答案。
答案
(1)负 PbO2+4H++SO
+2e-===PbSO4+2H2O
(2)2H++2e-===H2↑ 0.4
(3)Cu-2e-===Cu2+ 不变 (4)b
加餐练
1.解析 在负极区发生的电极反应为4H2O+4e-===2H2↑+4OH-,在正极区发生的电极反应为2H2O-4e-===O2↑+4H+,故正极区pH减小,A选项错误;Na+移向负极区,生成NaOH,SO
移向正极区,生成H2SO4,B选项正确;根据负极区电极反应可知C选项错误;每通过1mol电子,有0.25molO2生成,D选项错误。
答案 B
2.解析 铁板作阳极,则阳极上Fe失电子,A正确;阴极2H++2e-===H2↑,所以pH变大,B错;生成的OH-会与Fe3+结合生成Fe(OH)3,C正确;电路中每转移12mol电子,生成6molFe2+,则有1molCr2O
被还原,D正确。
答案 B
3.解析 d为石墨,则铁-碳-海水通过吸氧腐蚀形成原电池,加快铁片腐蚀,A项正确;d为正极,电极反应为O2+2H2O+4e-===4OH-,B项正确;d为锌块,则Zn、Fe和海水构成原电池,由于金属活动性Zn>Fe,则锌作负极,铁片不易被腐蚀,C项正确;d为锌块时,铁片上的反应为O2+2H2O+4e-===4OH-,D项错误。
答案 D
4.解析 水中的钢闸门连接电源的负极,钢闸门作电解池的阴极被保护起来,所以采用的是外加电流的阴极保护法;金属护栏表面涂漆、汽车底盘喷涂高分子膜均使用的是覆盖保护层的保护措施;地下钢管连接镁块,镁作负极被腐蚀,从而起到保护钢管的作用,所以使用的是牺牲阳极的阴极保护法。
答案 A
5.解析 A.若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极,正确;B.阳极Cl-放电生成ClO-,Cl的化合价升高,故在阳极发生氧化反应,又已知该溶液呈碱性,正确;C.阳离子在电解池的阴极得电子发生还原反应,在碱性条件下,H2O提供阳离子(H+),正确;D.由于溶液是碱性条件,故除去CN-发生的反应为2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-,错误。
答案 D
6.解析
(1)①阳极为水电离出的OH-放电,其反应式为2H2O-4e-===O2↑+4H+;②阳极室中的H+穿过阳膜进入产品室,原料室的H2PO
穿过阴膜扩散至产品室,二者反应生成H3PO2;③阳极区可能有部分H2PO
或H3PO2失电子发生氧化反应,导致生成物中混有PO
。
(2)依题意给信息知,反应物PbO与次氯酸钠反应,生成PbO2,由于铅元素化合价升高,故另一生成物为氯元素化合价降低得到Cl-;阳极发生氧化反应,即Pb2+失去电子被氧化生成PbO2,同时考虑盐溶液水解得到的酸性环境;阴极发生还原反应,即氧化性强的Cu2+得到电子生成铜;若电解液中不加入Cu(NO3)2,阴极发生的则是Pb2+得电子变为Pb,这样就不能有效利用Pb2+。
答案
(1)①2H2O-4e-===O2↑+4H+ ②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO
穿过阴膜扩散至产品室,二者反应生成H3PO2 ③PO
H2PO
或H3PO2被氧化
(2)PbO+ClO-===PbO2+Cl- Pb2++2H2O-2e-===PbO2↓+4H+ 石墨上包上铜镀层 Pb2++2e-===Pb↓ 不能有效利用Pb2+
7.解析 A项,该装置是原电池装置,H+放电生成氢气,溶液的pH增大,A项错误;B项,阳极:
Cu-2e-+2OH-===Cu(OH)2↓,阴极:
2H2O+2e-===H2↑+2OH-,总反应为:
Cu+2H2O
Cu(OH)2+H2↑,pH增大,B项错误;电解食盐水,总反应为:
2NaCl+2H2O
2NaOH+H2↑+Cl2↑,生成氢氧化钠使溶液的pH增大,C项错误;电解硫酸铜溶液的总反应为:
2CuSO4+2H2O
2Cu+O2↑+2H2SO4,溶液的pH减小,D项正确。
答案 D
8.解析 钛电极为阴极,发生还原反应,A项错误;铜作阳极,阳极上铜发生失电子的氧化反应,阳极反应式为2Cu+2OH--2e-===Cu2O+H2O,OH-由阴极区迁移到阳极区参与反应,离子交换膜应为阴离子交换膜,C项错误,D项正确;由阴极区迁移过来的OH-在阳极全部参与反应,阳极附近溶液的pH不变,B项错误。
答案 D
9.解析 由于铜的金属活动性比氢弱,在电解质溶液中发生吸氧腐蚀,负极:
Cu-2e-===Cu2+,正极:
O2+4e-+2H2O===4OH-,溶液中,Cu2++2OH-===Cu(OH)2↓,所以B选项正确。
答案 B
10.解析 当电路中有3mole-通过时,阳极首先发生反应2Cl--2e-===Cl2↑,生成0