人教版九年级化学下册92溶解度和93溶液的浓度教案语文.docx
《人教版九年级化学下册92溶解度和93溶液的浓度教案语文.docx》由会员分享,可在线阅读,更多相关《人教版九年级化学下册92溶解度和93溶液的浓度教案语文.docx(12页珍藏版)》请在冰豆网上搜索。
人教版九年级化学下册92溶解度和93溶液的浓度教案语文
教师辅导教案
学员编号:
年级:
九年级课时数:
3课时
学员姓名:
辅导科目:
化学学科教师:
授课主题
溶解度和溶质质量分数
教学目的
1.掌握饱和溶液、不饱和溶液、溶解度等概念及相互关系;掌握溶解度曲线的意义及应用。
2.认识一种溶液组成的表示方法——溶质的质量分数;掌握溶质质量分数的有关计算。
3.初步学会配制一定溶质质量分数的溶液。
教学重难点
溶解度和溶质质量分数
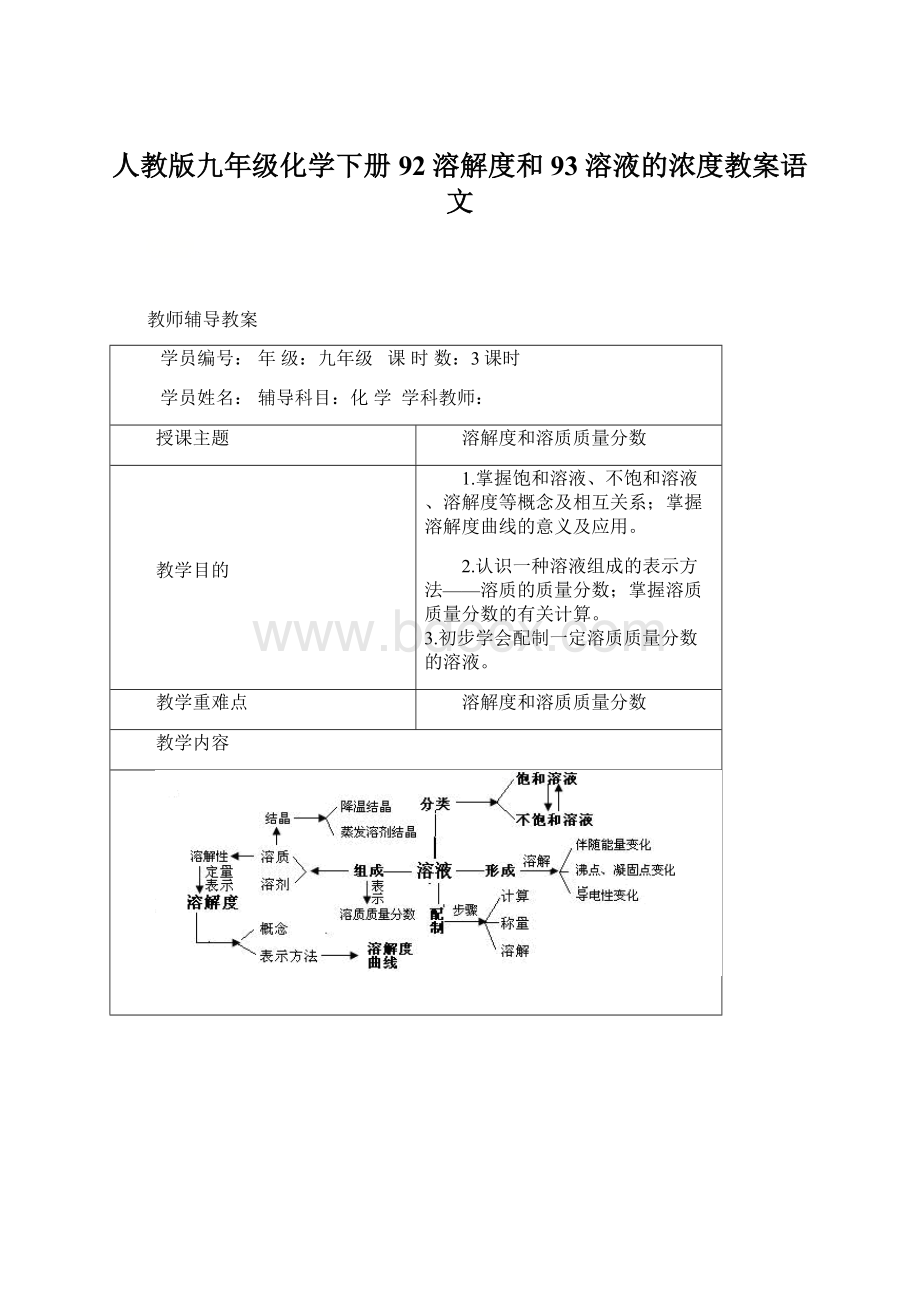
教学内容
要点一、结晶
1.结晶:
溶质从溶液中以晶体的形式析出的过程,叫做结晶。
结晶通常有两种方法:
一是蒸发溶剂,如将氯化钠溶液蒸发水分,就可以析出氯化钠晶体。
二是改变饱和溶液温度,如将硝酸钾溶液降温,也可以析出硝酸钾晶体。
【要点诠释】
1.温度是影响固体物质溶解度的唯一外界因素,振荡、搅拌只能加快固体物质的溶解速率,而不能改变固体的溶解度。
2.溶解度曲线既能定性地反映固体的溶解度受温度影响而变化的趋势,也能表示某固态物质在某温度下的溶解度,还能用于比较同一温度不同溶质的溶解度的大小。
比较溶解度大小必须指明温度,否则无法比较。
要点二、溶质的质量分数、配制一定溶质质量分数的溶液
1.溶质的质量分数:
是溶质质量与溶液质量之比。
(1)溶质的质量分数=溶质质量/溶液质量×100%
(2)饱和溶液中溶质的质量分数=溶解度÷(100g+溶解度)×100%
2.配制50g溶质质量分数为5%的蔗糖溶液:
(1)实验用品:
托盘天平、烧杯、玻璃棒、药匙、量筒(10mL、100mL)蔗糖。
(2)实验步骤:
①计算:
配制50g溶质质量分数为5%的蔗糖溶液所需要的溶质质量为50g×5%=2.5g,水的质量为50g-2.5g=47.5g。
②称量(量取):
用托盘天平称量2.5g蔗糖倒入烧杯中,把水的密度近似地看作1g/cm3,用量筒量取47.5mL水。
(思考:
为什么不选用10mL的量筒呢?
如果选用10mL的量筒,需要量取5次才能量取到所需的水,这样将会导致误差偏大。
)
③溶解:
把量好的水倒入盛有蔗糖的烧杯中,用玻璃棒搅拌,加速蔗糖的溶解。
④贮存:
把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,放到试剂柜中。
【要点诠释】
1.溶质的质量分数一般用百分数表示;是溶质质量占溶液质量的百分比,而不是体积关系。
2.溶质的质量分数数学表示式中,溶质的质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质的质量不能计算在内。
3.称量蔗糖时,要注意左物右码,规范使用托盘天平。
如果砝码跟蔗糖左右颠倒(1g以下用游码),所配溶液就会变稀;量取水时,使用量筒要规范,读数要正确。
如果俯视读数,所配溶液就会变浓。
要点三、溶液的稀释、浓缩
1.关于溶液稀释的计算:
(1)溶液稀释前后,溶质的质量不变。
(2)若设浓溶液质量为Ag,溶质的质量分数为a%,加水稀释成溶质的质量分数为b%的稀溶液Bg,则
Ag×a%=Bg×b%(其中B=A+m水)
2.关于溶液浓缩(无溶质析出)的计算:
(1)向原溶液中添加溶质:
溶液增加溶质前后,溶剂的质量不变。
增加溶质后,溶液中溶质的质量=原溶液中溶质的质量+增加的溶质的质量,而溶液的质量=原溶液的质量+增加的溶质的质量。
若设原溶液质量为Ag,溶质的质量分数为a%,加溶质Bg后变成溶质的质量分数为b%的溶液,则
Ag×a%+Bg=(Ag+Bg)×b%。
(2)将原溶液蒸发掉部分溶剂:
溶液蒸发溶剂前后,溶质的质量不变。
若设原溶液质量为Ag,溶质的质量分数为a%,蒸发Bg水后变成溶质的质量分数为b%的溶液,则
Ag×a%=(Ag一Bg)×b%。
(3)与浓溶液混合:
混合后溶液的总质量等于两混合溶液的质量之和,混合后溶液中溶质质量等于两混合溶液的溶质质量之和。
若设原溶液质量为Ag,溶质的质量分数为a%,浓溶液质量为Bg,溶质的质量分数为b%,两溶液混合后得到溶质的质量分数为c%的溶液,则
Ag×a%+Bg×b%=(Ag+Bg)×c%。
【要点诠释】
1.关于溶液稀释的计算一定要抓住:
溶液稀释前后,溶质的质量不变。
然后根据所给信息列方程求解。
2.关于溶液浓缩(无溶质析出)的计算,要根据浓缩的具体类型来具体分析找出等量关系来解决。
类型一、考查饱和溶液、不饱和溶液、溶解度及溶解度曲线的应用
1.t℃时有一杯接近饱和的澄清石灰水,下列做法不能使其变为饱和溶液的是( )
A.往溶液中加入少量CaO B.将溶液升温
C.将溶液降温 D.恒温蒸发部分溶剂
【答案】C
【解析】生石灰和水反应生成熟石灰,往接近饱和的石灰水中加入少量CaO可以增加溶质,减少溶剂,因此可以使接近饱和的溶液变为饱和溶液。
熟石灰的溶解度随着温度的升高而减小,将溶液升温,可以使接近饱和的石灰水变为饱和溶液;降温不可以。
恒温蒸发溶剂,同样可以使接近饱和的溶液变成饱和。
【总结升华】要注意熟石灰的溶解度随着温度的升高而减小。
2.请根据图中A、B两种固体物质的溶解度曲线,回答
下列问题。
(l)在____℃时,A、B两种物质溶解度相同。
(2)t2℃时,100g水中溶解_gA物质恰好达到饱和。
【答案】
(1)t1
(2)25
【解析】
(1)t1℃时,A、B两种物质的溶解度相同;
(2)t2℃时,
A物质的溶解度是25g,100g水中溶解25gA刚好饱和。
【总结升华】根据溶解度曲线可以判断:
①溶解度的大小,②溶液是否饱和,③溶解度与温度的关系,④溶液结晶等。
3.下图表示A、B两种固体物质的溶解度曲线。
在t2℃时,当A、B两种物质的溶液接近饱和时,下列哪种方法使两溶液都能达到饱和( )
A.降低温度 B.加入溶剂C.加入溶质 D.倒出一部分溶液
【答案】C
【解析】根据溶解度曲线可以看出,A、B的溶解度随温度变化的趋势不同,因此改变温度一定不能同时使A、B变为饱和;加入溶剂只能使溶液更不饱和;加入溶质可以使A、B都变得饱和;倒出溶液,溶液的不饱和状态不会改变。
故选C。
【总结升华】加溶质可以使任何不饱和溶液变为饱和溶液。
而改变温度、蒸发溶剂等方法还得具体物质具体分析。
4.下图是a、b、c三种物质的溶解度曲线。
请回答:
(1)P点的含义是_____________________。
(2)t2℃时30ga物质加入到50g水中不断搅拌,形成的溶液质量是______g。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是________(填写物质序号)。
(4)在t2℃时,将等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是,所得溶液中溶质质量分数最小的是_______。
【答案】
(1)t1℃时a和c的溶解度均为20g
(2)75(3)cba(4)ac
【解析】溶解度曲线上的点表示一定温度下该物质的溶解度。
由溶解度曲线可知,t2℃时a的溶解度为50g,因此a在50g水中最多可溶解25g,则30ga加入到50g水中形成溶液的质量为75g。
t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是c、b、a。
a物质的溶解度随温度升高变化较大,因此降温时析出晶体最多;t2℃时C的溶解度最小,饱和溶液的溶质质量分数最小,降温到t1℃时其溶质质量分数不变,还是最小。
【总结升华】认真分析溶解度曲线,弄清各物质溶解度随温度的变化趋势是解题的关键。
类型二、考查溶液的配制、溶质质量分数和溶液的稀释等有关计算
5.20℃时,KNO3的溶解度为31.6g,将20gKNO3投进50g水中,充分搅拌,制成20℃时的溶液,求该溶液中溶质的质量分数。
【答案】24%
【解析】首先要考虑所给溶质能否完全溶解在50g水中。
20℃时,100g水中最多能溶解KNO331.6g。
则50g水中最多只能溶解15.8gKNO3,即20gKNO3中只有15.8gKNO3溶解,溶液就已饱和,还有4.2g不能溶解(不是溶质)。
所以该溶液中溶质质量分数=[15.8g/(15.8g+50g)]×100%=24%
【总结升华】解本题的关键在于明确认识溶液是由已溶物(溶质)与溶剂组成的,没有溶解的物质不是溶液的组成部分。
6.实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液。
配制步骤为:
⑴计算:
需氢氧化钠固体_______g,水______mL(水的密度是1g/cm3)
⑵称量:
在托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在________盘。
⑶溶解:
将氢氧化钠固体溶于水,用_________搅拌,使氢氧化钠全部溶解,冷却至室温。
⑷把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。
【答案】
(1)40 960
(2)左
(3)玻璃棒
【解析】
(1)氢氧化钠的质量为1000g×4%=40g,需水的质量是1000g-40g=960g,即960mL。
(2)用托盘天平称量要“左物右码”。
(3)溶解时用玻璃棒搅拌加快溶解。
【总结升华】本题考查的是配制一定质量分数溶液的有关知识,解题关键是了解溶质和溶剂的计算方法以及托盘天平的使用技巧等。
类型一、考查饱和溶液、不饱和溶液、溶解度及溶解度曲线的应用
1、可以证明某种硝酸钾溶液是20℃时的饱和溶液的事实是( )
A.降温到10℃时,有硝酸钾晶体析出
B.蒸发掉10g水,有硝酸钾晶体析出
C.20℃时,向原溶液中加入少量硝酸钾晶体,溶液中硝酸钾的溶质的质量分数不变
D.加热到30℃后,在加入硝酸钾晶体能继续溶解
【答案】C
【解析】A选项中降温后有晶体析出,只能说明降温到10℃时是饱和溶液;B选项也只能说明是蒸发10g水后是饱和溶液;D选项说明加热到30℃后是不饱和溶液,都不能确定20℃时溶液的情况,因此都是错误的;C选项是在20℃时加硝酸钾没有溶解,可以说明该溶液是20℃时的硝酸钾的饱和溶液。
2、
右图是甲、乙两种物质的溶解度曲线。
在t2℃时往盛有100g水的烧杯中先后加入wg甲和wg乙(两种物质溶解时互不影响,且溶质仍是甲、乙),充分搅拌。
将混合物的温度降低到t1℃。
下列说法正确的是( )
A.甲物质的溶解度随温度升高而减小
B.乙物质的溶解度随温度升高而增大
C.温度降低到t1℃时,甲、乙的溶质质量分数相等,得到甲、乙的不饱和溶液
D.t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液
【答案】C
【解析】由所给溶解度曲线图知:
甲物质的溶解度随温度升高而增大,乙物质的溶解度随温度升高而减小,因此A、B选项都是错误的。
C选项中要想判断得出t1℃时的溶液情况,得先分析开始t2℃时的溶液。
根据溶解度曲线t2℃时乙的溶解度正好为Wg,甲的大于Wg,把等量的Wg甲乙加入到100g水中,可得到乙的饱和溶液,甲的不饱和溶解,但溶质的质量分数是相等的(溶液中甲乙的溶质质量、溶剂质量、溶液质量都是相等的)。
降温到t1℃时甲的溶解度降低但仍然高于Wg,仍是不饱和溶液,而乙溶解度升高,乙由饱和溶液变成了不饱和溶液,降温过程中溶液中甲乙溶质质量、溶剂质量都没有改变,因此溶质质量分数都不变还是相等的,因此C选项是正确的。
D选项中t2℃时,甲的溶解度大于Wg,乙的溶解度等于Wg,甲物质的溶液为不饱和溶液,乙物质的溶液为饱和溶液,故D不正确。
类型二、考查溶液的配制、溶质质量分数和溶液的稀释等有关计算
3、配制90g10%的硝酸钠溶液,需要硝酸钠的质量为。
【答案】9g
4、用氯化钠配制lOOg溶质质量分数为20%的氯化钠溶液,现有下列操作:
①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。
正确的操作顺序是( )
A.①②③④ B.⑤②④① C.①③⑤②④① D.①③⑥⑤②④①
【答案】B
【解析】配制一定溶质质量分数的溶液需要的步骤是:
计算、称量、量取、溶解等。
5.双氧水(H2O2)既是工业上的重要的绿色氧化剂,又是常用的医药消毒剂。
小明从试剂商店购得一瓶质量分数为30%的双氧水,用于制取氧气。
若要配制5%的双氧水600g,需要30%的双氧水的质量为___________。
需加水的体积是___________。
【答案】100g 500mL
【解析】用浓溶液配置稀溶液的过程中溶质质量不变。
根据溶质质量分数的定义可知:
溶质的质量=溶液质量×溶质的质量分数。
设需要30%的双氧水的质量为X,根据题意可列等式
30%X=600g×5%
解得X=100g
则水的质量为600g-100g=500g,即需加水的体积为500mL。
【总结升华】此题的解题关键是记住溶液稀释前后溶质的质量不变。
1.下图表示A、B两种固体物质的溶解度曲线。
在t2℃时,当A、B两种物质的溶液接近饱和时,下列哪种方法使两溶液都能达到饱和( )
A.降低温度 B.加入溶剂C.加入溶质 D.倒出一部分溶液
【答案】C
【解析】根据溶解度曲线可以看出,A、B的溶解度随温度变化的趋势不同,因此改变温度一定不能同时使A、B变为饱和;加入溶剂只能使溶液更不饱和;加入溶质可以使A、B都变得饱和;倒出溶液,溶液的不饱和状态不会改变。
故选C。
【总结升华】加溶质可以使任何不饱和溶液变为饱和溶液。
而改变温度、蒸发溶剂等方法还得具体物质具体分析。
2.对“20℃时,硝酸钾溶解度为31.6g”这句话解释正确的是( )
A.20℃时,100g硝酸钾溶液中含有31.6g硝酸钾
B.在100g水中溶解31.6g硝酸钾就达到饱和状态
C.20℃时,100g水中溶解31.6g硝酸钾就达到饱和状态
D.20℃时,31.6g硝酸钾被131.6g水溶解就达到饱和状态
【答案】C
【解析】20℃时,硝酸钾溶解度为31.6g,是表示20℃时100g水中溶解31.6g硝酸钾就达到饱和状态。
A应该是131.6g硝酸钾溶液中含31.6g的硝酸钾;B没有指明温度;D没说明达到饱和状态。
C是正确的。
3.取70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体,则剩余溶液中所含溶质质量为()
A.16gB.20gC.40gD.56g
【答案】A
【解析】该溶液恒温蒸发10g水,析出4g氯化钾固体,则该温度下氯化钾的溶解度为40g。
设70g饱和溶液中氯化钾的质量为X,列式140g:
40g=70g:
X,可得X=20g,则剩余溶液中所含溶质质量为20g-4g=16g。
4.下图是a、b两种固体物质的溶解度曲线,以下判断正确的是( )
A.溶解度:
a>b
B.t℃时的溶解度:
a=b
C.30℃时100g溶液中溶质的质量:
a>b
D.将等质量的饱和溶液由40℃降至10℃时,析出晶体的质量:
a=b
【答案】B
【解析】t℃时,两条溶解度曲线相交,所以,该温度下的溶解度:
a=b。
如果是30℃时100g的饱和溶液,则溶质的质量:
a>b;C选项没有明确溶液是否饱和,故不能确定溶质的质量是a>b。
5.下图是甲、乙两种固体物质的溶解度曲线。
下列说法正确的是()
A.甲物质的溶解度为60g
B.t℃时,甲、乙两物质的溶解度相等
C.升高温度可使不饱和的甲溶液变为饱和溶液
D.t℃乙物质的饱和溶液降到20℃时,溶液中溶质质量分数增大
【答案】B
【解析】t℃时所对应的点是两曲线的交点,所以溶解度相等。
6.有40g质量分数为5%的氯化钙溶液,若将其质量分数增加到10%,应采用的方法是()
A.把溶剂蒸发掉一半B.加入40g质量分数为20%的氯化钙溶液
C.把溶剂蒸发掉20gD.加入2g氯化钙固体
【答案】C
【解析】关于溶液稀释或浓缩(无溶质析出)的计算一定要抓住:
溶液稀释或浓缩(无溶质析出)前后,溶质的质量不变。
关于溶液浓缩(无溶质析出)的计算,要根据浓缩的具体类型来具体分析找出等量关系来解决。
7.20℃时,食盐的溶解度为36g。
该温度下将20g食盐投入50g水中,溶液的溶质质量分数为。
若将15g食盐投入50g水中,所得溶液的溶质质量分数为。
【答案】26.5%23.1%
1、将80g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为()
A.80gB.100gC.200gD.280g
2、
如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
A.
甲的溶解度等于乙的溶解度
B.
升高温度可将甲的不饱和溶液变为饱和溶液
C.
20℃时,100g乙的饱和溶液中溶质质量是30g
D.
40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
3、现欲将粗盐提纯,并用制得的精盐配制质量分数一定的氯化钠溶液。
下列说法不正确的是( )
A.粗盐溶解时,可边加粗盐边用玻璃棒搅拌加速溶解
B.过滤滤液时,可以直接把溶有粗盐的液体直接倒入漏斗
C.配制溶液需要经过计算、称量、溶解、装液等步骤
D.配制溶液时必备的仪器有托盘天平、量筒、烧杯、玻璃棒等
【答案】B
【解析】粗盐提纯需要先溶解,用玻璃棒搅拌可以加速溶解;过滤时不能直接把液体倒入漏斗,必须用玻璃棒引流。
A、C、D三个选项的说法都是正确的。
4、甲、乙两物质的溶解度曲线如图所示,下列说法正确的是()A.甲和乙的饱和溶液,从t1℃升温到t2℃,仍是饱和溶液
B.t1℃时,甲和乙的溶解度相等
C.t1℃时,甲和乙各30g分别加入80g水中,均能恰好完全溶解
D.t2℃时,在100g水中放入60g甲,形成不饱和溶液
5、(双选)配制10%的氯化钠溶液时,会引起溶液中氯化钠的质量分数偏小的是()
A.用量筒量取水时俯视读数B.配制溶液的烧杯用少量蒸馏水润洗
C.氯化钠晶体不纯D.转移已配好的溶液时,有少量溶液溅出
【答案】BC