73物质的分离和提纯.docx
《73物质的分离和提纯.docx》由会员分享,可在线阅读,更多相关《73物质的分离和提纯.docx(19页珍藏版)》请在冰豆网上搜索。
73物质的分离和提纯
第七单元化学实验探究
7.3物质的分离和提纯
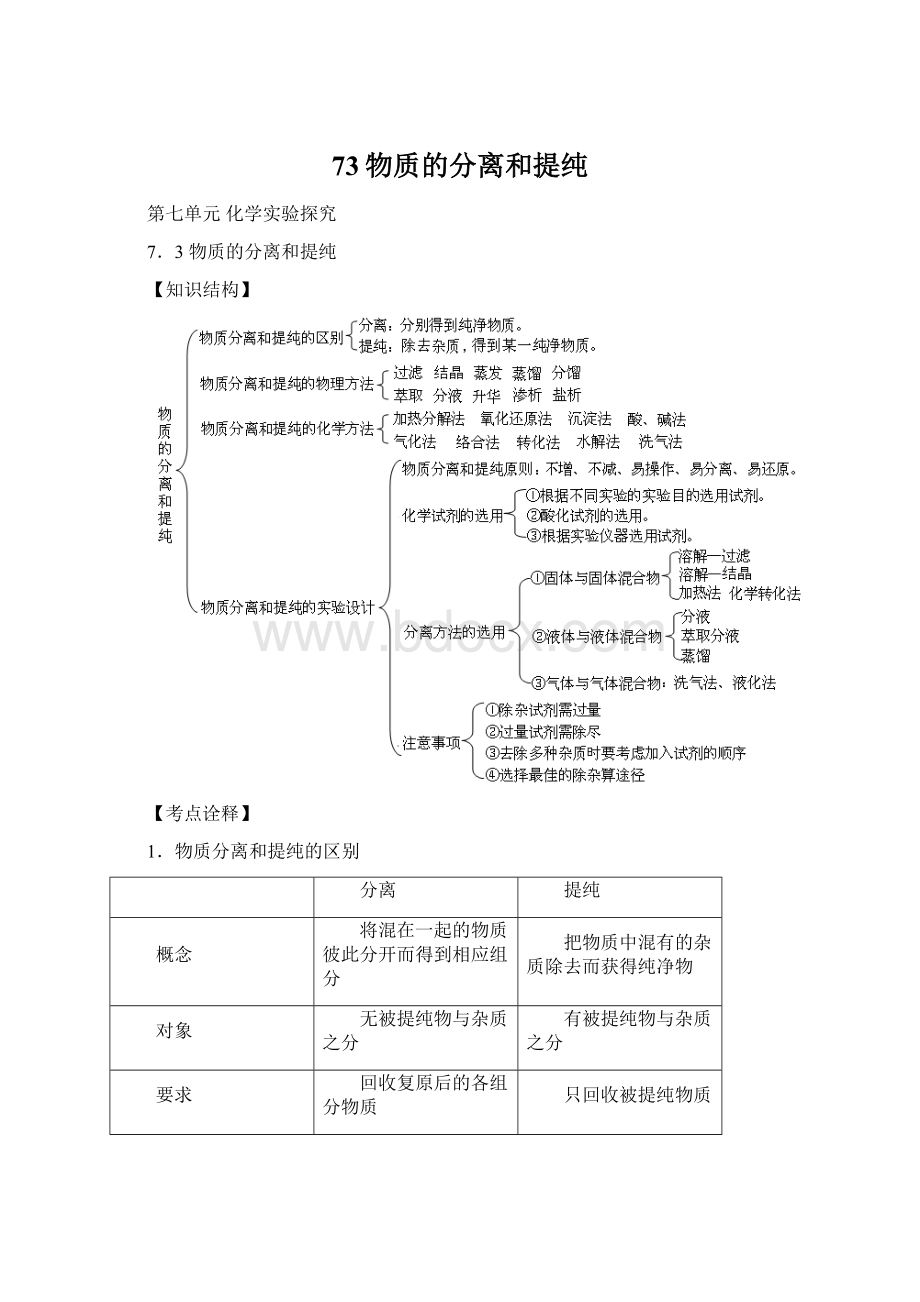
【知识结构】
【考点诠释】
1.物质分离和提纯的区别
分离
提纯
概念
将混在一起的物质彼此分开而得到相应组分
把物质中混有的杂质除去而获得纯净物
对象
无被提纯物与杂质之分
有被提纯物与杂质之分
要求
回收复原后的各组分物质
只回收被提纯物质
原则
步骤简单;现象明显;易于操作。
“不增、不减、易分”:
不引入新的杂质;不减少被提纯物质;杂质或反应后的杂质易分离
2.物质分离和提纯的物理方法
分离方法
适用范围
装置
举例
注意事项
①
溶解
和
过滤
分离溶于水和不溶于水的两种固体。
分离NaNO3和AgCl
①要“一贴二低三靠”。
②要洗涤沉淀:
在过滤器中加水至刚浸没沉淀,使水滤出后,重复2-3次。
②
结晶
和
重结晶
一种物质溶解度随温度变化较大,另一种物质溶解度随温度变化较小。
同蒸发(在烧杯中直接加热)、过滤装置。
KNO3的溶解度随温度变化较大,而NaCl的溶解度随温度变化较小。
冷却二者浓溶液时,KNO3易析出,经重结晶,可将二者分离。
①要先配制较高温度下的浓溶液,然后,冷却结晶。
②结晶后过滤,分离出晶体。
③需重结晶若干次才能较彻底分离。
③
蒸发
使溶解度随温度变化不大的物质从溶液中析出。
从食盐溶液中提取食盐晶体。
①溶质需对热稳定,受热不分解、不水解、不被氧气氧化。
②蒸发时要不断搅拌。
③待大量晶体析出时停止加热,利用余热蒸干。
④
蒸馏
和
分馏
液态混合物各组分沸点不同。
制蒸馏水
分馏石油
①温度计水银球在蒸馏烧瓶支管口处。
②加碎瓷片防暴沸。
③冷凝水从冷凝管的下口进,上口出。
⑤
分液
分离两种不相混溶的液体(密度不同)
见下
水与四氯化碳
下层液体从下口放出,上层液体从上口倒出。
⑥
萃取
利用溶质在两种不相溶的溶剂中的溶解度不同,从溶液中提取溶质。
用CCl4从溴水中提出溴单质。
萃取剂应满足的条件:
①与原溶剂不互溶。
与原溶剂和溶质不反应。
②溶质在其中的溶解度比原溶剂中大。
③萃取后要分液分离。
⑦
升华
分离易升华和不挥发固体。
分离碘单质与KCl
⑧
渗析
精制胶体
除去淀粉胶体中的Na+、Cl-。
要不断更换烧杯中的水或用流水,以提高分离效果。
⑨
盐析
利用某些物质加入无机盐时溶解度降低而析出的性质为分离物质。
同过滤
分离肥皂与甘油
蛋白质的盐析
⑩
溶解
吸收
用洗液将气体中的杂质溶解吸收而除去。
用饱和食盐水除去Cl2中的HCl,
用浓H2SO4除去H2O。
气体从洗气的长管进短管出。
注:
蒸馏、分馏、分液有什么区别?
答:
三者都是物理变化。
三者的区别是:
①蒸馏和分馏都是分离液态混合物的方法,而分液是将两种互不相溶的已分层的液体分开;②蒸馏、分馏利用的是液态混合物各成分的沸点不同,通过控制加热温度,使部分物质汽化、冷凝液化后收集,其余部分保留原装置中,分液一般无需加热;③蒸馏只进行一次汽化和冷凝,分离出的物质一般较纯;分馏是连续进行多次汽化和冷凝,分离出的物质一般是混合物;分液通常是和萃取组合,并多次交替进行。
3.物质分离和提纯的化学方法
分离方法
操作举例
①
加热分解法
如NaCl中混有少量NH4HCO3,加热使NH4HCO3分解。
如Na2CO3固体中含有少量NaHCO3杂质,可用加热分解法除去杂质
②
氧化还原法
利用氧化还原反应将杂质或氧化或还原,转化为易分离物质。
如除去苯中的少量甲苯,先用酸性高锰酸钾将甲苯氧化成苯甲酸,再加碱生成水溶性苯甲酸钠,从而与苯分离;又如,除去CO2中的少量O2,可将气体通过热的铜网;FeCl2溶液中含有少量FeCl3加入适量的铁粉除去。
③
沉淀法
将杂质转变为沉淀除去的方法。
如除去CO2中的H2S气体,可将混合气体通入到CuSO4溶液中,除去H2S气体。
④
气化法
将杂质转变为气体使之除去的方法。
如除去NaCl固体中的Na2CO3固体,可加入HCl将其中的转变为CO2气体。
⑤
酸、碱法
利用杂质和酸或碱反应,将不溶物转变成可溶物;将气体杂质也可转入酸、碱中吸收来进行提纯。
如除去CuS中的FeS就可采用加入盐酸,使之充分溶解,利用FeS和盐酸反应而不与CuS反应的特点来使两者分离。
⑥
络合法
有些物质可将其转化为络合物达到分离目的。
如BaSO4中的AgCl可通过加入浓氨水,使AgCl转化为可溶的[Ag(NH3)2]Cl除去。
⑦
转化法
利用某些化学反应原理,将杂质转化为所需物质,如NaHCO3溶液中含Na2CO3可通足量CO2转化,CaO中含CaCO3,可加热使之转化等。
有机物的分离一般不用此法,如除去乙酸乙酯中混有的乙酸,如果采用加入乙醇及催化剂(稀硫酸)并加热的方法,试图将乙酸转化为乙酸乙酯,这是适得其反的。
其一是加入的试剂难以除去;其二是有机反应缓慢、复杂,副反应多,该反应又是可逆反应,不可能反应到底将乙酸除尽。
⑧
水解法
当溶液中的杂质存在水解平衡,而用其他方法难以除之,可用加入合适试剂以破坏水解平衡,使杂质转化为沉淀或气体而除去。
如:
MgCl2中的FeCl3,可用加MgO、Mg(OH)2、MgCO3等,降低H+浓度,促进Fe3+水解为Fe(OH)3↓,而不能加NaOH和NH3·H2O等。
⑨
洗气法
此法适用于气体的除杂,将SO2、CO2的混合气体通过洗气瓶中的饱和NaHCO3溶液可除去SO2等等,常用的洗气瓶为自制简易洗气瓶。
⑩
其他
如AlCl3溶液中混有的FeCl3,可利用Al(OH)3的两性,先加过量氢氧化钠溶液,过滤,在滤液中通足量CO2,再过滤,在滤渣[Al(OH)3]中加盐酸使其溶解。
此外还有电解法精炼铜;离子交换法软化硬水等。
4.物质分离和提纯的实验设计
(1)物质分离和提纯原则
①不引入新的杂质;
②不能损耗或减少被提纯物质的质量;
③实验操作要简便,不能繁杂;
④杂质要易于分离;
⑤转化的物质易于还原。
即不增、不减、易操作、易分离、易还原。
(2)化学试剂的选用
①根据不同实验的实验目的选用试剂。
如除去CH2=CH2中混有的SO2气体,通常用NaOH溶液;CO2气体中含有杂质SO2气体,通常用饱和碳酸氢钠溶液除去;若要在除去SO2后检验原混合气体中CO2的存在时,则必须选用高锰酸钾酸性溶液或溴水。
②酸化试剂的选用。
某些溶液的配制或某些反应的发生需要酸性环境,即需要酸化。
例如,KMnO4溶液的酸化应该用稀硫酸,不能用盐酸或硝酸;检验C2H5Br中Br元素,水解结束后应用硝酸酸化,而不能用盐酸或硫酸;配制FeCl3溶液只能用盐酸酸化,用其他酸会引入杂质。
③根据实验仪器选用试剂。
若选用U形管或干燥管干燥气体,则要选用固体干燥剂;若选用洗气瓶,一般选用液体干燥剂。
(3)分离方法的选用
除杂时,要充分考虑杂质与被提纯物质的物理、化学性质的差异,采用先物理方法后化学方法的原则,选择合适的提纯方法。
不能用物理方法直接分离或提纯的物质,先考虑化学方法,然后再结合物理方法进行分离。
①固体与固体混合物
A、一种易溶,一种难溶——溶解法(溶解——过滤——蒸发);
B、二者均易溶解,溶解度受温度影响不同——结晶和重结晶
C、杂质易分解或易升华——加热法
D、二者均易溶解,溶解度受温度影响差别不大,化学转化法
②液体与液体混合物
A、互不相溶——分液
B、互溶但在同一种溶剂中的溶解度差别较大——萃取分液
C、互溶而沸点差别大——蒸馏
③气体与气体混合物
A、气体与气体混合物方法
气+气
洗气
用液体吸收剂洗气
洗气瓶
长进短出
CO2(HCl)
用固体吸收剂不加热
干燥管、U型管
大口进小口出
用固体吸收剂/△
硬质玻璃管
N2(O2)
液化
沸点不同气分开
U形管
常用冰水
从O2、SO2中分离出SO3
B、常用气体吸收剂选择
被吸收气体
NH3、水蒸气
CO2、水蒸气
CO2、Cl2、SO2
C2H4、C2H2
H2S
吸收剂
浓H2SO4
碱石灰
NaOH溶液
溴水
NaOHCuSO4溶液
【例题精析】
【例1】依据硝酸钾、硫酸钾的溶解度随温度变化的差异,如何用结晶的方法分离出硝酸钾和硫酸钾?
硝酸钾和硫酸钾的溶解度(g/100g水)
t(℃)
0
10
20
40
60
80
90
KNO3
13.9
21.2
31.6
61.3
106
167
203
K2SO4
7.4
31.6
11.1
14.8
18.2
21.4
22.9
【考点分析】这是两种均易溶解,溶解度受温度影响不同的固体混和物的分离题。
【思维点悟】由于硝酸钾、硫酸钾都是易溶于水的固体物质,故应选用结晶法。
而应使哪种晶体先析出来?
由溶解度数据可知,K2SO4的溶解度受温度影响不大,KNO3的溶解度受温度影响较大,所以可取过量试样适量的水加热至90℃使至充分溶解,趁热过滤,将K2SO4滤出,然后再将滤液冷却,主要析出晶体KNO3(会含少量K2SO4),若要使得到的KNO3更纯,可进行重结晶。
【正确答案】
【例2】请设计实验除去氯化钠固体中的少量硫酸钠、氯化钙。
【考点分析】这是一个除杂题,杂质都易溶于水,且不能用物理方法进行除去,必须用化学方法进行除杂。
【思维点悟】这题与例1不同,它是物质的提纯,杂质含量少。
提纯题只须将杂质离子除去即可,此题只须将SO42-和Ca2+除去,但不能引入新的杂质离子,因此,除SO42-只能用BaCl2,除Ca2+和过量的Ba2+只能用Na2CO3,过量的CO32-用适量的HCl加以除去。
【正确答案】
【例3】请设计实验分离苯、苯酚和苯甲酸的混合物。
【考点分析】这是一道液体有机混和物的分离题,必须根据有机物的性质、特点进行分离。
【误区警示】①有的同学认为,苯酚和苯甲酸溶于热水,苯则不溶于水,所以先将他们加入热水中,溶解的为苯酚和苯甲酸,不溶解的为苯,苯在上层,水溶液在下层,即可将苯分离出来。
其实这是一个误区,根据相似者相溶原理,苯酚和苯甲酸肯定更易溶解在苯中而非水中。
②在常温下纯净的苯酚是无色晶体,所以同学们往往认为从水溶液中析出的苯酚也是晶体,用过滤的方法得到苯酚。
其实从水溶液中析出的苯酚含少量水,凝固点降低而呈液态,静止后在下层,可将其分液出来。
【思维点悟】苯酚和苯甲酸具有酸性,先加氢氧化钠溶液,使之转化为相应的、易溶于水的钠盐,从而与苯分层,静置,分层,上层为苯,分液得到苯。
根据酸性:
强酸>苯甲酸>碳酸>苯酚,再在钠盐溶液中通入过量的二氧化碳,得到苯酚,苯酚在水中溶解度比较小,从水中析出,呈液态,静止后在下层,可将其分液出来。
在上面的溶液液中,再加过量的盐酸,得到苯甲酸,苯甲酸在水中的溶解度小,从溶液中析出固体,可用过滤的方法得苯甲酸。
【正确答案】
【例4】除去下列各物质中的少量杂质,所选用的试剂及操作方法均正确的是()
选项
物质
杂质
试剂
除去杂质的方法
A
KNO3
MnO2
足量的水
溶解、过滤、蒸发
B
H2
水蒸气
NaOH溶液
洗气
C
硝酸
盐酸
过量的硝酸银溶液
过滤
D
CO
CO2
足量的氧化铁
加热
【考点分析】此题考查三种不同状态混和物的除杂方法及相关的元素化合物性质。
【思维点悟】除杂题要除去原有的杂质,但不能损耗或减少被提纯物质的质量,更不能引入新的杂质。
A、KNO3溶于水,MnO2不溶于水,难过溶解、过滤,就可将MnO2除去,得到KNO3溶液,再进行蒸发结晶就可得到KNO3晶体,A正确。
B、NaOH固体有很强的吸水性,才能吸水干燥,NaOH溶液不行。
C、在硝酸和盐酸的混和液中,加入过量的硝酸银溶液,可以将Cl-除去,但却引入了过量的Ag+,所以不正确。
D、足量的氧化铁加热,可以将CO转化为CO2,所以不正确。
【正确答案】A
【例5】有一CO和CO2混合气体,某同学经过下面的步骤将它们分离开:
①将混合气体通过盛有氢氧化钠溶液的洗气瓶中②收集气体A③向洗气瓶中滴加适量的稀盐酸,产生气泡④收集气体B,请分析一下:
(1)步骤①应打开,关闭(填字母);
(2)A和B分别是(填气体化学式);
(3)步骤③应打开,关闭(填字母);
(4)如何能确定在步骤②中收集的只有一种气体呢?
在老师的指导下,经过讨论后,在步骤②前加了一步,其操作是,目的是。
【考点分析】此题涉及到混合物的分离、二氧化碳的实验室制法、二氧化碳的化学性质等有关知识,考查同学们物质分离的操作和基础实验设计的能力。
【思维点悟】要分离一氧化碳和二氧化碳的混合物,可以依据物质的性质差异进行,首先将二氧化碳转化生成其他的物质,分离得到一氧化碳,再通过物质间的反应生成二氧化碳。
①一氧化碳不能和氢氧化钠溶液反应,打开活塞a,关闭活塞b,让混合气体从导管口进入,则二氧化碳能与氢氧化钠反应,一氧化碳从c逸出,所以②收集气体A为:
CO;②氢氧化钠能与二氧化碳反应生成碳酸钠,关闭活塞a,打开活塞b,则碳酸钠溶液和稀盐酸反应生成二氧化碳气体,从c导管逸出,④收集气体B为CO2。
为了确定A气体只有CO,没有CO2,在收集气体A前先将气体通过澄清石灰水,若不变浑浊,就表明CO2已完全吸收,收集的A只有CO。
【正确答案】
(1)打开活塞a,关闭活塞b;
(2)A-CO,B-CO2;(3)关闭活塞a,打开活塞b;(4)在收集气体A前先将气体通过澄清石灰水,目的是检验CO2气体是否完全吸收。
Na+
Mg2+
Ca2+
OH-
溶
难溶
微溶
Cl-
溶
溶
溶
CO32-
溶
微溶
难溶
【例6】已知某粗盐样品中含有少量MgCl2、CaCl2及不溶性杂质。
某研究性学习小组对该粗盐的提纯进行了探究,没汁如下实验流程,请根据图示回答下列问题:
(20℃时,部分物质的溶解性见右表)
(1)操作①中需要使用的玻璃仪器有:
烧杯、。
操作②的名称为。
若在操作②结束后发现溶液A仍浑浊,应采取的措施是。
(2)操作③是在加热条件下不断滴加稀盐酸至溶液的pH=7。
该操作的目的是。
(3)操作④是将溶液B倒入(填仪器名称)中,加热并不断搅拌,直到时(填现象),停止加热。
【考点分析】本题主要考查混合物分离过程中的溶解、过滤、蒸发等内容,难度不大,但需要同学们的细心分析.
【思维点悟】
(1)粗盐提纯首先要溶解,溶解要用到的仪器有烧杯、玻璃棒;当加入稍过量的氢氧化钠溶液和碳酸钠溶液后,可与杂质MgCl2、CaCl2生成不溶于水的氢氧化镁沉淀和碳酸钙沉淀,操作②是过滤掉这些沉淀;若在操作②结束后发现溶液A仍浑浊,应采取的措施是重新过滤。
(2)因为氢氧化钠溶液和碳酸钠溶液过量,所以应设法除去,加热条件下不断滴加稀盐酸至溶液的pH=7,就是除去过量和氢氧化钠溶液和碳酸钠溶液。
(3)操作④是蒸发结晶,蒸发时,将溶液B倒入蒸发皿中,如果蒸发皿中出现较多固体时,应停止加热,靠余热把水蒸干.加热过程中,应不断用玻璃棒搅拌,防止液滴飞溅。
【正确答案】
(1)玻璃棒;过滤;再过滤;
(2)除去过量的Na2CO3和NaOH;(3)蒸发皿;蒸发皿中出现较多固体。
【拓展训练】
1.在实验室中从苯酚中分离出苯,可选用下列装置中的
半透膜
A.B.C.D.
2.现有三组实验:
①除去混在植物油中的水②回收碘的CCl4溶液中的CCl4
③用食用酒精浸泡中草药提取其中的有效成份。
以上各混合体系的正确分离方法依次是
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
3.下列分离或提纯物质的方法错误的是
A.用渗析的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
4.下列各组液体①硝基苯和稀硫酸②苯酚和乙醇③甘油和水④溴苯和苯⑤氯丙烷和盐酸⑥谷氨酸和乙醚⑦丙酸和丙醇可以用分液漏斗分离的是
A.①②④B.⑤⑥⑦C.①⑤⑥D.①④⑦
5.现有甲和乙的混合物一瓶。
甲、乙性质如下:
欲将甲、乙两物质分离开,应选用的最佳方法是
A.蒸馏B.分液C.降温D.以上均可
6.为了从H2、CO、H2O和N2的混合气体中获得纯净的N2,下列净化方法正确的是
A.使混合气体燃烧除去H2、CO后,再通过浓硫酸
B.使混合气体通过灼热的CuO后,再通过五氧化二磷
C.使混合气体先通过碱石灰,再通过浓硫酸
D.先使混合气体通过灼热的CuO,再通过固体氢氧化钠
7.二氧化碳气体中,含有少量二氧化硫,要得到干燥纯净的二氧化碳,现将气体通过洗气瓶①②,①②两瓶中所装试剂正确的是
A.①NaOH溶液②浓H2SO4B.①浓H2SO4②NaOH溶液
C.①NaHCO3溶液②浓H2SO4D.①浓H2SO4②Na2CO3溶液
8.溶液中存在Mg2+、Ag+、Ba2+等离子,用化学试剂HCl、NaCl、Na2CO3等溶液,分别沉淀出来,加入试剂的顺序是
A.NaOH、HCl、Na2CO3B.Na2CO3、HCl、NaOH
C.HCl、Na2CO3、NaOHD.HCl、NaOH、Na2CO3
9.为除去混在氯化钾中的少量硫酸钾和氯化钙杂质,需进行下列六项操作:
①加水溶解,②加热蒸发结晶,③加入过量氯化钡溶液,④加入过量盐酸,⑤加入过量碳酸钾溶液,⑥过滤,下列操作顺序正确的是
A.①③⑤⑥④②B.①⑤③④⑥②C.①③④⑥⑤②D.①⑤③⑥④②
10.要除掉NaCl溶液中混入的少量Na2SO4和NH4HCO3,其正确操作顺序是①加热②过滤去掉沉淀物③滴加BaCl2溶液至无沉淀生成④滴加NaOH溶液呈碱性⑤滴加盐酸至无气体放出⑥调pH至中性
A.③②⑤②④⑥①B.⑤③②④①⑥②C.③②④①②⑤⑥D.④①③②⑤⑥
11.把混合液中的Al3+、Fe3+、Ba2+、Ag+逐一沉淀出来加以分离,加入试剂的正确顺序是
A.Cl-,SO42-,OH-,CO2B.OH-,CO32-,Cl-,SO42-
C.SO42-,Cl-,OH-,CO2D.Cl-,CO32-,OH-,SO42-
12.某KNO3溶液含杂质KBr和Ca(H2PO4)2、K2SO4,欲除去杂质,溶液最后只允许含K+、NO3-、H+和OH-,则加入试剂的顺序正确的是
A.Ba(NO3)2、K2CO3、KOH、HNO3
B.KOH、AgNO3、Ba(NO3)2、K2CO3、HNO3
C.AgNO3、KOH、K2CO3、Ba(NO3)2、HNO3
D.KOH、Ba(NO3)2、K2CO3、AgNO3、HNO3
13.下列实验方法:
①用渗析法分离蛋白质和葡萄糖的混合液,②用盐析法分离油脂皂化反应的产物,③用升华法分离碘和砂子的混合物,④用结晶法分离硝酸钾和氯化钠的混合物,⑤用分液法分离水和溴乙烷的混合物,⑥用蒸馏法分离酒精与苯酚(沸点为182℃)的混合物。
你认为这些方法
A.只有①不正确B.②⑤⑥不正确C.只有③④⑥正确D.全部正确
14.工业上用铝土矿(主要成份为Al2O3·xH2O,Fe2O3,SiO2等)提取纯Al2O3做冶炼铝的原料,提取时操作过程如图所示。
指出图中操作错误的是
A.④⑤B.③④C.②⑤D.①②
15.醛可以跟亚硫酸氢钠的饱和溶液发生加成反应,生成a-羟基磺酸钠水溶液(RCHO+
NaHSO3
R—CH(OH)—SO3Na),此反应是可逆的,在通常情况下醛有70%~90%的转
化率。
醛在强碱性条件下转化成醇和羧酸盐。
若溴苯中混有杂质甲醛,欲除去此杂质,
应采用的方法是
A.用饱和的NaHSO3溶液处理,并过滤B.用饱和的NaHSO3溶液处理,并分液
C.用NaOH溶液处理,并过滤D.用NaOH溶液处理,并蒸馏
16.在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂。
某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
试简要说明:
(1)加入过量的BaCl2溶液的原因。
(2)判断BaCl2已过量的方法是。
(3)加入过量的Na2CO3溶液的原因。
(4)滴加稀盐酸直至pH=7的目的是。
17.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。
实验室里从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关的实验操作名称:
①②;
写出实验②中有关反应的离子方程式
。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A.甲苯,酒精B.四氯化碳,苯
C.汽油,乙酸D.汽油,甘油
(3)为使海藻灰中碘离子转为碘的有机溶液,实验室准备了烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。
如下图所示,还缺少的玻璃仪器是___________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处:
①②③。
(5)进行上述蒸馏操作时,使用水浴的原因是_______________________________;最后,晶态碘在_________里聚集。
18.某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2·2H2O晶体的工艺流程如下:
已知:
①焙烧过程中发生的主要反应为:
CuS+2NaCl+2O2→CuCl2+Na2SO4
氢氧化物开始沉淀时的pH
氢氧化物沉淀完全时的pH
Fe3+
1.9
3.2
Fe2+
7.0
9.0
Cu2+
4.7
6.7
②
请参照表中给出的数据回答:
(1)焙烧时还有废气产生,其中一种是主要的大气污染物。
若在实验室中以碱液吸收处理之,下列A、B、C装置中。
可行的是________(填字母)。
(2)H2O2的作用是:
(3)调节溶液pH的范围是__________,试剂B可以选择__________(填写选项字母)。
a.KOHb.氨水c.Cu2(OH)2CO3d.CuO
(4)为了获得CuCl2·2H2O晶体,对滤液B进行的操作是:
,趁热过滤,滤液经冷却结晶,过滤得到产品。
分析有关物质的溶解度曲线(如上图),“趁热过滤”得到的固体是_______________,(填化学式)。
(5)滤液B中除OH—外阴离子还有________;
(6)请描述检验滤液B中上述阴离子(除OH—外)的实验操作___________________________
【近五年上海高考试题】
1.(09-6)下列实验装置不适用于物质分离的是
2.(10-15)除去下列括号内杂质的试剂或方法错误的是
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
3.(12-