化学反应速率与化学平衡填空题练习.docx
《化学反应速率与化学平衡填空题练习.docx》由会员分享,可在线阅读,更多相关《化学反应速率与化学平衡填空题练习.docx(30页珍藏版)》请在冰豆网上搜索。
化学反应速率与化学平衡填空题练习
科技部理科复习班化学反应速率与化学平衡填空题练习2014-1-3
1.某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
姓名
(1)已知:
2H2O2(aq)=2H2O(l)+O2(g)的
<0,则该反应的逆反应能否自发进行?
(填“能”或“不能”),判断依据是。
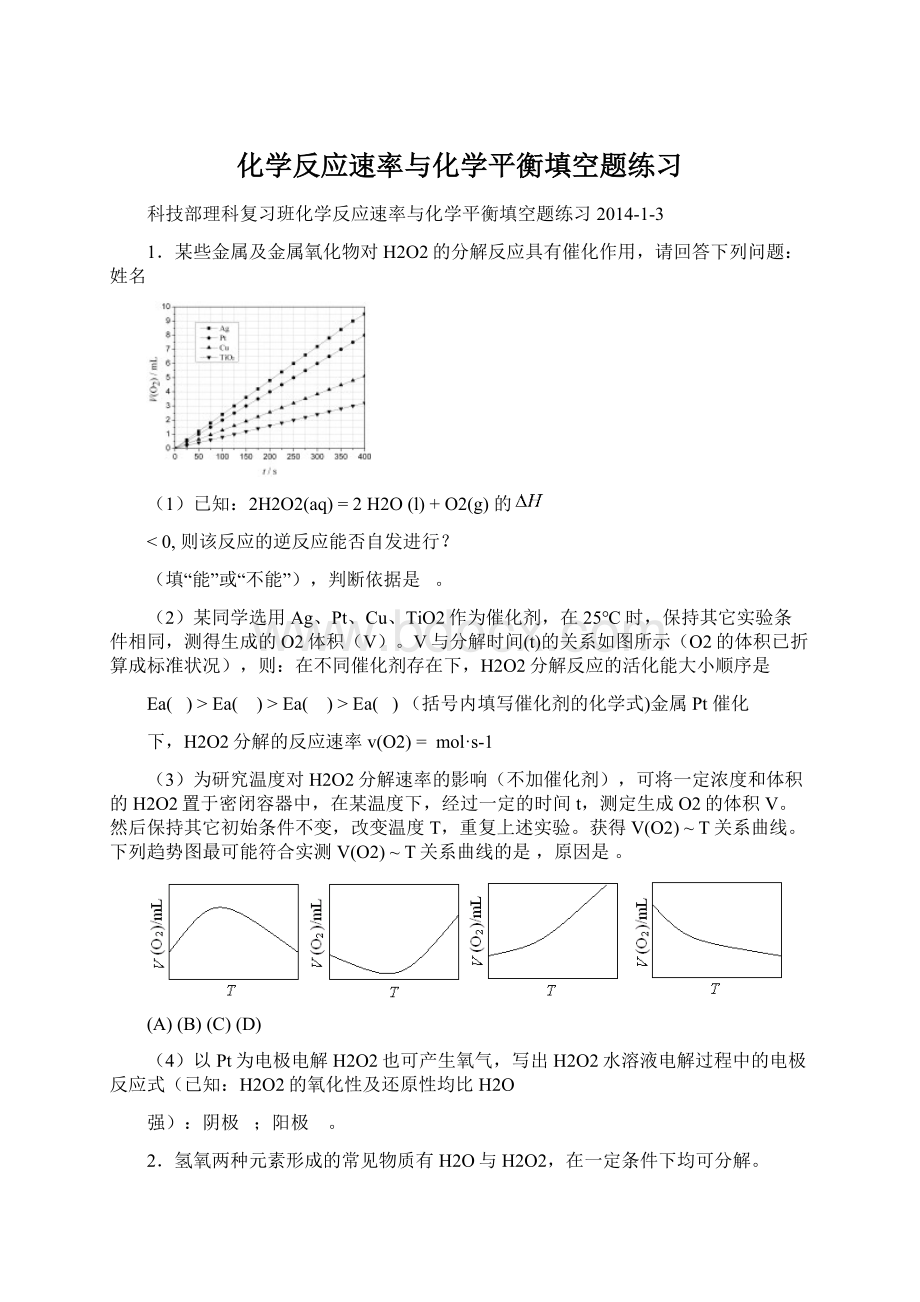
(2)某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃时,保持其它实验条件相同,测得生成的O2体积(V)。
V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况),则:
在不同催化剂存在下,H2O2分解反应的活化能大小顺序是
Ea()>Ea()>Ea()>Ea()(括号内填写催化剂的化学式)金属Pt催化
下,H2O2分解的反应速率v(O2)=mol·s-1
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。
然后保持其它初始条件不变,改变温度T,重复上述实验。
获得V(O2)~T关系曲线。
下列趋势图最可能符合实测V(O2)~T关系曲线的是,原因是。
(A)(B)(C)(D)
(4)以Pt为电极电解H2O2也可产生氧气,写出H2O2水溶液电解过程中的电极反应式(已知:
H2O2的氧化性及还原性均比H2O
强):
阴极;阳极。
2.氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
化学键
断开1mol化学键所需的能量(kJ)
H—H
436
O—H
463
O=O
498
①H2O的电子式是。
②H2O(g)分解的热化学方程式是。
③11.2L(标准状况)的H2完全燃烧,生成气态水,放出kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。
常温下,按照如表所示的方案完成实验。
实验编号
反应物
催化剂
a
50mL5%H2O2溶液
1mL0.1mol·L-1FeCl3溶液
b
50mL5%H2O2溶液
少量浓盐酸
1mL0.1mol·L-1FeCl3溶液
c
50mL5%H2O2溶液
少量浓NaOH溶液
1mL0.1mol·L-1FeCl3溶液
d
50mL5%H2O2溶液
MnO2
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。
图1图2
由该图能够得出的实验结论是____。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。
解释反应速率变化的原因:
。
3.以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g)-Q(Q>0)
在密闭容器中,按H2与CO2的物质的量之比为3:
1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。
完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是_______(选填序号)
(2)在一定温度下反应达到平衡的标志是_______(选填编号)
a.平衡常数K不再增大b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变 d.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)a.降低温度b.充入更多的H2c.移去乙醇d.增大容器体积
(4)图中曲线II和III的交点a对应的体积分数ya=_______%
4.某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。
将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)
2NH3(g)+CO2(g)△H=akJ/mol
实验测得不同温度下的平衡数据列于下表:
温度/℃
15.0
20.0
25.0
30.0
35.0
平衡总压强/kPa
5.7
8.3
12.0
17.1
24.0
平衡气体总浓度/mol·L-1
2.4×10-3
3.4×10-3
4.8×10-3
6.8×10-3
9.4×10-3
①取一定量的氨基甲酸铵固体放在一个100L的密闭真空容器中,在25.0℃达到分解平衡。
则反应热(填“吸”或“放”)kJ/mol(用含a字母表示)。
若将温度降到15.0℃,再次达平衡后氨基甲酸铵固体改变g
②根据表中数据,列式计算25.0℃时的分解平衡常数:
.
5.在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应应:
A(g)
B(g)+C(g)△H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h
0
1
2
4
8
16
20
25
30
总压强p/100kPa
4.91
5.58
6.32
7.31
8.54
9.50
9.52
9.53
9.53
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为。
平衡时A的转化率为,列式并计算反应的平衡常数K。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=mol,n(A)=mol。
②下表为反应物A浓度与反应时间的数据,计算a=
反应时间t/h
0
4
8
16
c(A)/(mol·L-1)
0.10
a
0.026
0.0065
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是,由此规律推出反应在12h时反应物的浓度c(A)为mol·L-1
6.Ⅰ.恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:
2SO2(g)+O2(g)
2SO3(g)ΔH=-196.6kJ·mol-1),请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:
______________________。
(2)ΔH2=__________kJ·mol-1。
Ⅱ.工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l)
CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。
在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
(1)该研究小组的实验目的是___________________________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________________________________(写出两条)。
Ⅲ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:
CO(g)+H2O(g)
H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃
400
500
800
平衡常数K
9.94
9
1
试回答下列问题:
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填“A、B、C、D、E”)。
n(CO)
n(H2O)
n(H2)
n(CO2)
A
1
5
2
3
B
2
2
1
1
C
3
3
0
0
D
0.5
2
1
1
E
3
1
2
1
(2)已知在一定温度下,C(s)+CO2(g)
2CO(g)平衡常数为K;
①C(s)+H2O(g)
CO(g)+H2(g)平衡常数为K1;
②CO(g)+H2O(g)
H2(g)+CO2(g)平衡常数为K2;
则K、K1、K2之间的关系是______________________________________。
7.
(1)已知:
2NO2(g)
N2O4(g);△H<0。
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
①a、b、c、d四个点中,表示化学反应处于平衡状态的点是。
②前10min内用NO2表示的化学反应速率v(NO2)=mol·L-1·min-1。
反应在第一个平衡点的平衡常数K
(1)=(可用分数表示)。
反应在第二个平衡点的平衡常数K
(2)与第一个平衡点的平衡常数K
(1)的关系:
K
(2)K
(1)(填“>”、“=”或“<”)。
③请在右图坐标中画出1molN2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(2)右图中a、b、c、d分别代表氧族元素(ⅥA族):
Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图。
试回答下列问题:
①请你归纳:
非金属元素氢化物的稳定性与形成氢化物的反应热△H的关系。
②写出硒化氢发生分解反应的热化学反应方程式:
。
8.在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)
2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是(填写名称)
该反应450℃的平衡常数500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是
A.3V正(H2)=2V逆(NH3)B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化D.容器中气体的分子总数不随时间而变化
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率v(N2)为______________mol/(L▪min)。
(4)下列研究目的和示意图相符的是。
A
B
C
D
研究目的
压强对反应的影响(P1>P2)
温度对反应的影响
平衡体系增加N2对反应的影响
催化剂对反应的影响
图示
9.CO2的固定和利用在降低温室气体排放中具有重要作用,从CO2加氢合成甲醇不仅可以有效缓解减排压力,还是其综合利用的一条新途径。
CO2和H2在催化剂作用下能发生反应CO2+3H2
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。
请回答下列问题:
(1)提高甲醇产率的措施是。
(2)分析图中数据可知,在220℃、5MPa时,CO2的转化率为,再将温度降低至
140℃,压强减小至2MPa,化学反应速率将(填“增大、减小或不变“下同),CO2的转化率将。
(3)200℃时,将0.100molCO2和0.275molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。
若CO2的转化率为25%,则此温度下该反应的平衡常数K=。
(要求写出算式和计算结果)
(4)已知已知:
CO的燃烧热△H=-283.0KJ/mol、2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol、
CO(g)+2H2(g)=CH3OH(g)△H=-90.1KJ/mol,写出CO2与H2合成甲醇的热化学方程式。
10.氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是。
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4kJ。
③已知:
1molN-H键断裂吸收的能量约等于kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
T/℃
165
175
185
195
K
111.9
74.1
50.6
34.8
①焓变ΔH(填“>”、“<”或“=”)_______0。
(3)已知:
①N2(g)+O2(g)=2NO(g)ΔH1=+180kJ·mol-1
②N2(g)+3H2(g)
2NH3(g)ΔH2=-92.4kJ·mol-1
③2H2(g)+O2(g)=2H2O(g)ΔH3=-483.6kJ·mol-1
氨的催化氧化反应的热化学方程式为
11.已知A(g)+B(g)
2C(g)反应的平衡常数和温度的关系如下:
温度/℃
700
800
830
1000
1200
平衡常数
1.70
1.10
1.00
0.60
0.40
回答下列问题:
(1)该反应的平衡常数表达式K=______,△H_____0(填“<”“>”“=”);
(2)容积固定,判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.气体的密度不随时间改变b.c(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变d.压强不随时间改变
(3)1200℃时反应2C(g)
A(g)+B(g)的平衡常数的值为。
(4)830℃时,向一个10.00L的密闭容器中充入0.40mol的A和1.60mol的B,如果反应初始2s内生成C的物质的量为0.40mol,则2s内A的平均反应速率v(A)=____mol·L-1·s-1;2s时c(B)=____mol·L-1;2s时A的转化率为____;2s时C的体积分数为____。
12.在一定体积的密闭容器中,进行如下反应:
A(g)B(g)+C(g),其化学平衡常数K和温度t的关系如下表所示:
toC
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
回答下列问题:
(1)该反应化学平衡常数的表达式:
K=。
(2)在下图中用实线画出该反应的能量变化曲线,同时在此基础上用虚线画出加入催化剂后的能量变化曲线。
(3)一定温度和体积下,下列说法中能说明该反应达平衡状态的是。
①容器内压强不变②混合气体中c(C)不变③混合气体的密度不变④v(A)=v(B)
⑤化学平衡常数K不变⑥混合气体平均式量不变
(4)反应时间(t)与容器内气体A的浓度数据见下表
时间t/min
0
1
2
4
8
16
20
C(A)/(mol·L-1)
10.4
8.6
7.5
6.6
5.9
5.5
5.5
回答下列问题:
①2~4min内,B的平均速率为。
②反应达平衡时,A的转化率为。
③欲提高A韵平衡转化率,可以采取的措施有。
13.
(1)请完成该反应的离子方程式:
C+MnO4-+H+—CO2↑+Mn2++H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。
进行反应CO(g)+H2O(g)
CO2(g)+H2(g)得到如下两组数据:
实验编号
温度/℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
CO
H2O
H2
CO
1
650
4
2
1.6
2.4
6
2
900
2
1
0.4
1.6
3
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为。
(精确到0.01)
②该反应为(填“吸”或“放”)热反应,实验2中达平衡时CO的转化率为。
(3)在容积可变的密闭容器中发生反应:
mA(g)+nB(g)
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa
2×105
5×105
1×106
c(A)/mol·L-1
0.08
0.20
0.44
①当压强从2×105Pa增加到5×105Pa时,平衡移动(填:
向左,向右,不)
②当压强从5×105Pa增加到1×106Pa时,该反应平衡常数表达式为K=。
⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为5时,溶液中c(Fe3+)为mol/L。
(已知25℃时Ksp[Fe(OH)3]=4×10-38)
14.为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源。
(1)25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量363.3kJ,该反应的热化学方程式为。
(2)目前,工业上常用CO2来生产燃料甲醇。
现进行如下实验:
在体积为lL的密闭恒容容器中,充入lmolCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①该反应的平衡常数表达式K=;
②从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=(注明单位);H2的转化率=;
③下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1molCO2的同时生成1molCH3OHB.CO2、H2、CH3OH和H2O的物质的量的比为1∶3∶1∶1
C.容器中气体的压强不再改变D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度B.将CH3OH(g)从体系中分离
C.使用高效催化剂D.恒温恒容再充入1molCO2和3molH2
15.已知2A2(g)+B2(g)
2C(g);△H=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达平衡后C的浓度为wmol/L,放出热量bkJ。
请回答下列问题:
(1)比较a______b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(3)若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系__________________(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是(填序号,有一个或多个选项符合题意,下同)。
a、v(C)=2v(B2)b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2)d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体b、适当升高温度
c、增大B2的浓度d、选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<)。
16.在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)
2NH3(g)△H<0。
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
根据图,计算从反应开始到平衡时,平均反应速率v(NH3)=。
⑵下列描述中能说明上述反应已达平衡的是。
A.3v正(H2)=2v逆(NH3)B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化D.容器中气体的分子总数不随时间而变化
⑶第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡移动(填“向正反应方向”、“向逆反应方向”或“不”)。
17.汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:
N2(g)+O2(g)
2NO(g),是导致汽车尾气中含有NO的原因之一。
T℃时,向5L密闭容器中充入8molN2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:
N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。
右图是反应:
2NO(g)+2CO(g)
2CO2(g)+N2(g)中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H0(填“>”、“<”或“无法确定”)。
若催化剂的表面积S1>S2,在图中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件。
18.研究NOx(氮的氧化物)SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)下图是
反应过程中能量示意图。
该反应的焓变
(2)一定条件下,通过
可以实现燃煤烟气中硫的回收。
某研究小组向2L某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中通入CO和SO2,10分钟后测得容器CO2的物质的量为0.9mol。
①求以v(CO2)表示的反应速率为。
②该反应的平衡常数的表达式为:
K=。
③若想加快正反应速率的同时提高SO2的转化率,可以采用的方法是。
(3)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:
NO不能与Na2CO3溶液反应。
若用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为。
19.SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一。
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g)
2SO3(g)△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
①平衡状