第章镧系和锕系元素等习题参考答案.docx
《第章镧系和锕系元素等习题参考答案.docx》由会员分享,可在线阅读,更多相关《第章镧系和锕系元素等习题参考答案.docx(10页珍藏版)》请在冰豆网上搜索。
第章镧系和锕系元素等习题参考答案
第22章:
镧系和锕系元素习题参考答案(P1110-1111)
1.答:
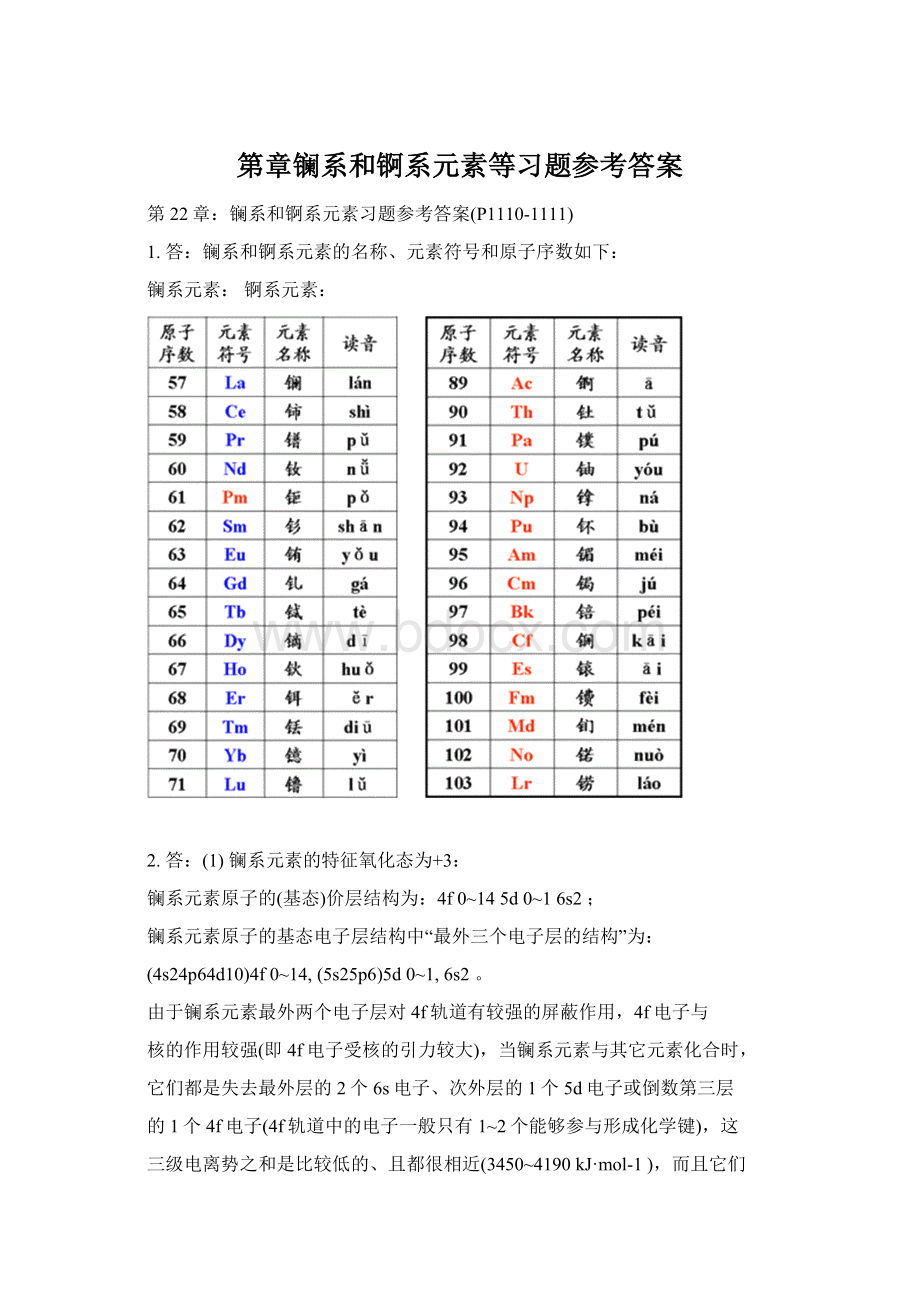
镧系和锕系元素的名称、元素符号和原子序数如下:
镧系元素:
锕系元素:
2.答:
(1)镧系元素的特征氧化态为+3:
镧系元素原子的(基态)价层结构为:
4f0~145d0~16s2;
镧系元素原子的基态电子层结构中“最外三个电子层的结构”为:
(4s24p64d10)4f0~14,(5s25p6)5d0~1,6s2。
由于镧系元素最外两个电子层对4f轨道有较强的屏蔽作用,4f电子与
核的作用较强(即4f电子受核的引力较大),当镧系元素与其它元素化合时,
它们都是失去最外层的2个6s电子、次外层的1个5d电子或倒数第三层
的1个4f电子(4f轨道中的电子一般只有1~2个能够参与形成化学键),这
三级电离势之和是比较低的、且都很相近(3450~4190kJ·mol-1),而且它们
的Ln3+离子半径很相近,Ln3+的水合能相近。
因此,镧系元素的特征氧化
态为+3。
(2)Ce(铈)、Pr(镨)、Tb(铽)、Dy(镝)还常呈现+4氧化态:
Ce4+(4f0)、Pr4+(4f1)、Tb4+(4f7)、Ce4+(4f8),是因为它们的4f能级具有全
空或接近全空、半满或接近半满的结构,这符合Hund规则。
(3)Sm(钐)、Eu(铕)、Tm(铥)、Yb(镱)能呈现+2氧化态:
凡是具有相对稳定电子层结构的镧系元素Ln2+的离子,都是可以形成的。
镧系元素中几乎有一半的元素都能形成+2氧化态的离子,特别是:
Sm2+(4f6)、Eu2+(4f7)、Tm2+(4f13)、Yb2+(4f14)。
3.解释镧系元素在化学性质上的相似性。
答:
镧系元素在化学性质上都十分相似,尤其是下列两组的元素:
铈组稀土(轻稀土):
La、Ce、Pr、Nd、Pm、Sm、Eu;
钇组稀土(重稀土):
Gd、Tb、Dy、Ho、Er、Tm、Yb、Lu(Sc)、Y。
镧系元素原子的基态电子层结构中“最外三个电子层的结构”为:
(4s24p64d10)4f0~14,(5s25p6)5d0~1,6s2,倒数一、二两个电子层结构几乎相同,
仅是倒数第三电子层中的4f能级中电子数不同,即:
镧系元素原子的价层
结构(4f0~145d0~16s2)十分相似。
由于镧系元素最外两个电子层对4f轨道有
较强的屏蔽作用,4f电子与核的作用又较强(即4f电子受核的引力较大),
尽管4f能级中电子数不同,它们的化学性质受4f电子数的影响很小,所以
它们的化学性质都十分相似。
(*注:
镧系元素4f能级中的电子,一般只有1~2个能够参与形成化学键)
例如:
镧系元素都有特征+3氧化态,镧系金属在水溶液中都容易形成+3价离子;
镧系金属都是较强的还原剂,其还原性强弱仅次于碱土金属,ϕθ(Ln3+/Ln)
在(-2.5V)~(-2.3V)之间、ϕθ[Ln(OH)3/Ln]在(-2.9V)~(-2.7V)之间,都比较接近;
镧系元素的电负性(1.10~1.27)都相近,(I1+I2+I3)三级电离势之和是比较低的、
且都很相近(3450~4190kJ·mol-1),而I4(3600~4800kJ·mol-1)都较大;
镧系金属的Ln3+离子半径很相近,Ln3+的水合能相近;…等。
4.什么叫做“镧系收缩”?
讨论“镧系收缩”的原因,并回答“镧系收缩”
对周期表中其它元素的性质所造成的影响。
答:
La系元素的原子半径和离子半径“随原子序数的增大而逐渐减小”,这种
现象叫“镧系收缩”(LanthanideContraction)。
镧系收缩有两个特点:
(1)相邻元素原子半径之差仅1pm左右,即在镧系内“原子半径呈缓慢减
小的趋势”,但是经过从La→Lu14种元素的原子半径递减的累积却减小了约
14pm之多。
(2)离子半径收缩的幅度比原子半径大得多。
镧系收缩的原因→与4f电子的屏蔽效应强弱有关:
镧系元素的4f电子在倒数第三层,4f电子比6s和5s5p电子对核电荷的
屏蔽作用大,因此随着原子序数的增加,最外层电子受核的引力只是缓慢增加,从而导致“原子半径呈缓慢减小的趋势”。
离子半径收缩的幅度比原子半径要大,是因为:
在离子的电子层结构中,
4f电子在倒数第二层,它对5s5p电子的屏蔽作用(根据Slaterrule,σ=0.85)
比原子中的要小,因此,离子半径收缩的幅度要远大些。
而在原子中,4f电子→6s2电子的屏蔽作用大(σ=1.00)。
“镧系收缩”造成原子的累积核电荷(有效核电荷)增加,原子半径减小(其效
应相当于抵消了一个电子层的增加)。
而Z*、r原是影响元素性质的重要物理量,
因此镧系收缩必将对周期表中其它元素的性质产生重大影响。
镧系收缩对周期表中其它元素的性质所造成的主要影响如下:
(1)导致Y的原子半径和离子半径落入La系(Y的原子半径接近Gd,
Y3+离子半径接近Er3+),使Y成为稀土元素的成员,矿物共生。
(2)导致第三过渡系元素的性质与第二过渡系元素的相近。
特别是ⅣB的
Zr/Hf、ⅤB的Nb/Ta、ⅥB的Mo/W的r原、r离相近,化学性质非常相似,
矿物共生,难于分离;其次是第Ⅷ族的Ru/Os、Rh/Ir,Pd/Pt的化学性质
相似,造成各对元素在分离上的困难。
(3)导致第三过渡系金属的密度远大于第二过渡系金属,以致重Pt系的
Os、Ir、Pt密度最大。
“镧系收缩”累积的核电荷使原子半径的减小相当于抵消掉了一个电子层
的增加,因此第三过渡系金属的原子体积对比第二过渡系金属没有增大。
而
相对原子质量在增大,因此密度增大很多。
(4)导致第六周期镧系以后元素(特别是后半部分的)的6s1~2电子难于
成键→6s1~2电子成为惰性电子(累积核电荷的影响),第三过渡系金属单质中
绝大多数化学性质不活泼、呈惰性。
事实上,周期系中的“惰性电子对效应”
→6s2电子成键能力弱,就与“镧系收缩”有关。
[补充题]周期表中的元素,在化学性质上的相似性主要有哪几种?
并解释
每一种相似性产生的原因,排出各种相似性的顺序。
答:
周期表中的元素,在化学性质上的相似性主要有下列几种:
(1)同族元素的相似性。
如:
ⅠA的Li、Na、K、Rb、Cs,
ⅦA的F、Cl、Br、I,ⅠB的Cu、Ag、Au,ⅢB的Sc、Y、La,…等。
同族元素的化学性质相似的原因是:
价电子构型相似,但电子层数不同。
如:
Li(2s1)、Na(3s1)、K(4s1)、Rb(5s1)、Cs(6s1);
Cu(3d104s1)、Ag(4d105s1)、Au(5d106s1);…等。
(2)对角线相似→Li-Mg、Be-Al、B-Si…等,处于左上和右下对角线
上的元素。
它们的化学性质相似的主要原因是:
它们的离子势相近。
(3)稀土元素(RE)化学性质的相似性:
镧系元素及Y、(Sc)共17种元素,总称为“稀土元素”。
镧系元素的化学性质“十分相似”的原因是:
它们的价层结构(4f0~145d0~16s2)十分相似,虽然它们的4f能级上的电子
数不同,但4f电子仅有1~2个能参与形成化学键,它们的化学性质受4f电子
数的影响很小,所以它们的化学性质都十分相似。
(4)d区第三过渡系金属元素与第二过渡系金属元素化学性质的相似性→
第ⅣB的Zr/Hf、ⅤB的Nb/Ta、ⅥB的Mo/W,这三对元素的化学性质
非常相似,矿物共生,难于分离;其次是第Ⅷ族的Ru/Os、Rh/Ir、Pd/Pt
这三对元素的化学性质相似,造成各对元素在分离上的困难。
造成这种相似性的原因是:
“镧系收缩”的影响。
(5)第一过渡系(或第二、三过渡系)元素中各元素间性质的相似性:
它们的化学性质相似的原因是:
价层结构(3d1~104s1~2)相似。
但因它们的3d
能级上的电子数不同,所以化学性质存在一定的差异。
价电子中,3d电子与4f电子的一个重要不同点是:
3d能级中的电子数
少于或等于5的,都能参与形成化学键,而4f电子仅有1~2个能参与形成
化学键。
因此,3d能级中电子数的多少影响元素的化学性质。
第(5)点可概括为同区元素的某些相似性,如S、P、卤素单质在碱中的歧化。
从以上分析看:
镧系元素及稀土元素在化学性质上是最相似的;
其次是:
Zr/Hf、Nb/Ta、Mo/W这三对元素,以及第Ⅷ族的Ru/Os、
Rh/Ir、Pd/Pt三对元素;
再后是:
对角线相似的Li-Mg、Be-Al、B-Si;
排最后的是:
“同族元素的相似性”和外过渡元素中“同一过渡系元素间
的相似性”。
5.为什么镧系元素彼此之间在化学性质上的差别比锕系元素彼此之间要
小得多?
答:
镧系元素最外两个电子层对4f轨道有较强的屏蔽作用,4f电子与核的
作用又较强(即4f电子受核的引力较大),4f轨道对比5s5p轨道在空间的伸长
不多,4f电子难以都用于成键,尽管4f能级中电子数不同,它们的化学性质
受4f电子数的影响很小,所以镧系元素主要呈现特征+3氧化态,无论是它们
单质还是化合物,在化学性质上都十分相似。
而锕系前半部元素中的5f轨道与核的作用相对4f而言要弱些,5f轨道对
比6s6p轨道在空间的伸长较大,因而95号Am(镅)及以前的锕系元素不仅可
以把6d和7s轨道上的电子作为价电子给出,而且也可以把5f轨道上的电子
作为价电子参与成键,形成高价稳定态。
导致锕系元素之间的差别无论在单质
或化合态都比较大。
6.为什么镧系元素形成的配合物多半是离子型的?
试讨论镧系配合物稳定性
规律及其原因。
答:
Ln3+离子的壳层结构皆属Xe型→8e壳层(因4f电子不易参与成键),
因此Ln3+离子都是硬酸,易同硬碱O2-、OH-、X-(F-,Cl-)等结合,形成
离子型配合物。
Ln3+离子与配体形成配合物时,动用的是外层高能轨道(5d6s6p)成键,
Ln3+离子与配体间的化学键主要是电价配键,配位场稳定化能较小,因此
镧系配合物的稳定性不大。
镧系配合物之间的稳定性大小因镧系收缩,Ln3+离子与配体间的静电
引力从La→Lu逐渐增强,所以镧系配合物的稳定性从La→Lu依次递增。
7.解:
0.4000g的U3O8的物质的量n为:
0.4000/842.2=4.750⨯10-4(mol)
则该铀矿中所含U的质量m是:
m=4.750⨯10-4⨯3⨯238.1(g)
质量分数为:
(m/1.6000)⨯100%=21.2%
8.答:
因可溶性Ln3+盐(硫酸盐、硝酸盐、盐酸盐)是强酸弱碱盐,易发生
水解。
水合稀土氯化物所带的结晶水若采用加热方法脱水,高温下更易发生
水解生成碱式盐,从而得不到无水氯化物。
为防止水合稀土氯化物脱水时的
水解,除可采用干燥HCl气流中加热脱水外,还可在一定真空度(减压)下脱
水:
这样,不仅可降低脱水温度,加快脱水过程的进行,而且能及时将水蒸
气抽出,抑制水解。
这点和BeCl2·4H2O、AlCl3·6H2O、MgCl2·6H2O等的
脱水情况非常相似。
9.完成并配平下列反应方程式
(1)EuCl2+FeCl3→EuCl3+FeCl2
(2)2CeO2(s)+8HCl→2CeCl3+Cl2↑+4H2O
(3)
(4)
(5)
(6)
(7)2UO3(s)+2NaOH(aq)+5H2O→Na2U2O7·6H2O(重铀酸钠,黄色)
(8)
10.略
11.简述从独居石中提取混合稀土氯化物的原理。
答:
独居石是稀土(含钍Th等)的磷酸盐矿,可采用酸法(浓H2SO4)和
碱法(浓NaOH)分解矿石,提取混合稀土。
酸法原理如下:
先用浓H2SO4加热分解独居石精矿,用水浸取出混合稀土盐(初步除杂):
2REPO4+3H2SO4→RE2(SO4)3+2H3PO4
向混合稀土盐中加入NaOH(aq),沉淀出混合稀土,分离Th4+:
RE2(SO4)3+6NaOH(aq)→2RE(OH)3↓+3Na2SO4
用HCl溶解RE(OH)3,得混合稀土氯化物:
RE(OH)3+3HCl→RECl3+3H2O
12.为什么用电解法制备稀土金属时,不能在水溶液中进行?
答:
因为稀土金属还原性强,能与水反应,置换出H2。
因此在水溶液中
电解,不能得到它们的单质。
用电解法制备稀土金属,电解的是精制混合熔盐(无水RECl3和KCl)。
13.答:
如12题,稀土金属的制备一般用精制混合熔盐(无水RECl3和KCl)
电解法。
加入一定量的KCl,是为了降低混合稀土的熔点,使电解在较低的
温度(1173±20K)下进行。
14.锕系元素和镧系元素同处于一个副族(ⅢB),为什么锕系元素的氧化态种类
较镧系多?
答:
这是由锕系元素的电子壳层结构决定的,锕系元素的5f轨道对比6s6p轨
道在空间的伸长较大,锕系前半部元素中的5f轨道与核的作用相对4f而言要
弱些,因而95号Am(镅)及以前的锕系元素不仅可以把6d和7s轨道上的电子
作为价电子给出,而且也可以把5f轨道上的电子作为价电子参与成键,形成
高价稳定态(89号锕Ac除外)。
而镧系元素由于其原子核对4f轨道的作用强,4f轨道上的电子最多只有
1~2个能够参与形成化学键,因此镧系元素能呈现的氧化态较少。
15.钍的卤化物有什么特点?
答:
钍的卤化物都是高熔点的白色晶体。
除ThF4外,都可在真空中于
773~873K升华,都易溶于水,且发生水解生成ThOX2。
第23章:
原子核化学部分习题参考答案(P1145-1146)
1.核聚变为什么只能在非常高的温度下才能发生?
答:
轻原子核相遇时聚合为较重的原子核并放出巨大能量的过程称为核聚变。
由于原子核都带正电,轻原子核相遇时在微小的空间里因静电斥力巨大,相互
排斥而不能结合。
只有在非常高的温度下,轻核才有足够动能克服斥力,而能
自动发生持续的聚变。
2.答:
α粒子→He2+,因α粒子质量大、带正电,未被加速的α粒子能量低,
用它去轰击其它核会被排斥而不能引发核反应。
而中子不带电,中子撞击
原子核时不会受到静电斥力,因此,一定能量的中子撞击原子核时易引发
核反应。
3.答:
锂核的核电荷比氢核大,锂核与氢核间的排斥力比氢核与氢核间的
大,所以锂和氢核间聚变温度H2比H2和核间聚变温度高。
4.答:
铀矿中U-235和U-238混合在一起,当铀矿受到中子打击时,能量
大于0.025eV的绝大部分中子被U-238捕获,而这种能量的中子不能引发
U-238的链反应。
5.Th-232转变为Pb-208要放射出多少个α粒子和多少个β粒子?
答:
6个α粒子和4个β粒子。
(见P1129)
6.确定在下面各种情况下产生的核?
11.答:
12.写出下列转变过程的核平衡方程式:
13.完成并配平下列核反应式
14.答:
15.解:
t=3.32τlg(N0/N)
设有放射性核素N0=100,5年内衰变了75%,还剩下的核素为N=25,则:
5=3.32τlg(100/25)
该射性核素的τ(半衰期)=2.5(年)。
第22、23章:
f区元素学习要点
1.La系金属都是活泼金属,第ⅢB元素的金属活泼性变化规律与其它副族
相同吗?
2.什么叫镧系收缩?
说明镧系收缩的原因。
La系收缩对周期表中其它元素的性质有何影响?
3.La系元素的化学性质为什么十分相似?
4.La系元素+3氧化态的氢氧化物Ln(OH)3的碱性、溶解性与哪些主族金属
的氢氧化物相近?
La系元素+3氧化态的盐的溶解性有何规律?
5.La系金属及其合金有哪些特殊性能的材料?
6.什么是锕系理论?
7.放射性元素的移位定律——α—衰变和β—衰变。
8.什么是β—稳定半岛和超重核稳定岛假说?
典型习题:
P1110习题2、3、4、6、9、12
P1145习题1、2、4、5、6、11、12、13