实验室常用溶剂极性表格.docx
《实验室常用溶剂极性表格.docx》由会员分享,可在线阅读,更多相关《实验室常用溶剂极性表格.docx(27页珍藏版)》请在冰豆网上搜索。
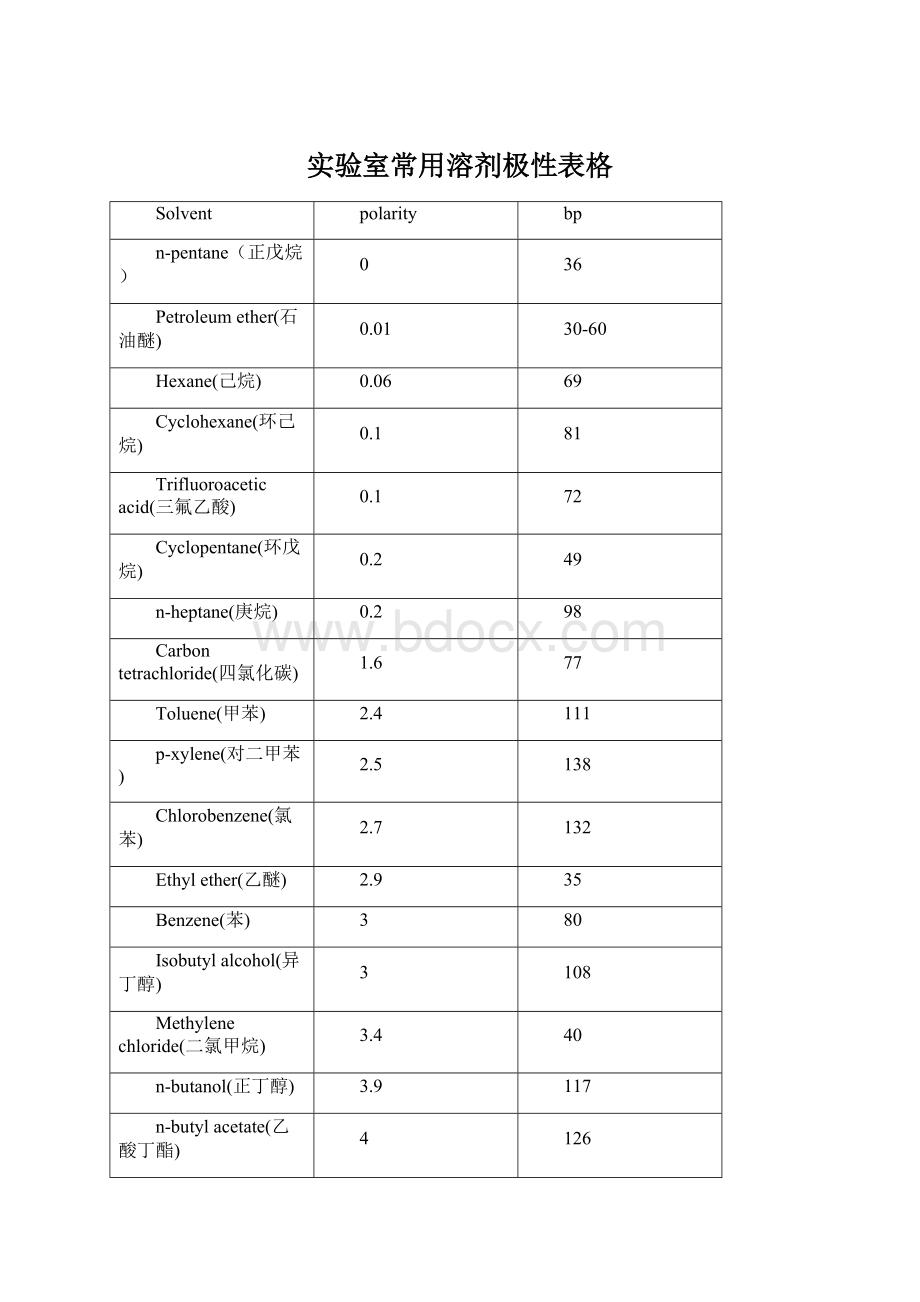
实验室常用溶剂极性表格
Solvent
polarity
bp
n-pentane(正戊烷)
0
36
Petroleumether(石油醚)
0.01
30-60
Hexane(己烷)
0.06
69
Cyclohexane(环己烷)
0.1
81
Trifluoroaceticacid(三氟乙酸)
0.1
72
Cyclopentane(环戊烷)
0.2
49
n-heptane(庚烷)
0.2
98
Carbontetrachloride(四氯化碳)
1.6
77
Toluene(甲苯)
2.4
111
p-xylene(对二甲苯)
2.5
138
Chlorobenzene(氯苯)
2.7
132
Ethylether(乙醚)
2.9
35
Benzene(苯)
3
80
Isobutylalcohol(异丁醇)
3
108
Methylenechloride(二氯甲烷)
3.4
40
n-butanol(正丁醇)
3.9
117
n-butylacetate(乙酸丁酯)
4
126
n-propanol(正丙醇)
4
98
Tetrahydrofuran(四氢呋喃)
4.2
66
Ethanol(乙醇)
4.3
79
Ethylacetate(乙酸乙酯)
4.3
77
i-propanol(异丙醇)
4.3
82
Chloroform(氯仿)
4.4
61
Methylethylketone(甲基乙基酮)
4.5
80
Dioxane(二氧六环)
4.8
102
Pyridine(吡啶)
5.3
115
Acetone(丙酮)
5.4
57
Nitromethane(硝基甲烷)
6
101
Aceticacid(乙酸)
6.2
118
Acetonitrile(乙腈)
6.2
82
Aniline(苯胺)
6.3
184
Dimethylformamide(DMF)
6.4
153
Methanol(甲醇)
6.6
65
Ethyleneglycol(乙二醇)
6.9
197
Dimethylsulfoxide(二甲亚砜)
7.2
189
Water(水)
10.2
100
常用溶剂极性表
出自:
Hexane(己烷) 0.06 0.33 69 210
Cyclohexane(环己烷) 0.10 1.00 81 210
Isooctane(异辛烷) 0.10 0.53 99 210
Trifluoroacetic acid(三氟乙酸)0.10 -- 72 --
Trimethylpentane(三甲基戊烷)0.10 0.47 99 215
Cyclopentane(环戊烷) 0.20 0.47 49 210
n-heptane(庚烷) 0.20 0.41 98 200
Butyl chloride(丁基氯; 丁酰氯) 1.00 0.46 78 220
Trichloroethylene(三氯乙烯; 乙炔化三氯)1.00 0.57 87 273
Carbon tetrachloride(四氯化碳) 1.60 0.97 77 265
Trichlorotrifluoroethane(三氯三氟代乙烷)1.90 0.71 48 231
i-propyl ether(丙基醚; 丙醚) 2.40 0.37 68 220
Toluene(甲苯) 2.40 0.59 111 285
p-xylene(对二甲苯) 2.50 0.65 138 290
Chlorobenzene(氯苯) 2.70 0.80 132 --
o-dichlorobenzene(领二氯苯) 2.70 1.33 180 295
Ethyl ether(二乙醚; 醚) 2.90 0.23 35 220
Benzene(苯) 3.00 0.65 80 280
Isobutyl alcohol(异丁醇) 3.00 4.70 108 220
Methylene chloride(二氯甲烷) 3.40 0.44 40 245
Ethylene dichloride(二氯化乙烯) 3.50 0.79 84 228
n-butanol(丁醇) 3.90 2.95 117 210
n-butyl acetate(醋酸丁酯; 乙酸丁酯)4.00 --- 126 254
n-propanol(丙醇) 4.00 2.27 98 210
Methyl isobutyl ketone 4.20 -- 119 330
Tetrahydrofuran( 四氢呋喃)4.20 0.55 66 220
ethanol 4.30 1.20 79 210
Ethyl acetate 4.30 0.45 77 260
i-propanol(丙醇) 4.30 2.37 82 210
Chloroform(氯仿) 4.40 0.57 61 245
Methyl ethyl ketone(甲基乙基酮) 4.50 0.43 80 330
Dioxane(二恶烷; 二氧六环; 二氧杂环己烷)4.80 1.54 102 220
Pyridine(吡啶) 5.30 0.97 115 305
Acetone(丙酮) 5.40 0.32 57 330
Nitromethane(硝基甲烷)6.00 0.67 101 380
Acetic acid(乙酸)6.20 1.28 118 230
Acetonitrile(乙腈) 6.20 0.37 82 210
Aniline(苯胺) 6.30 4.40 184 --
Dimethyl formamide(二甲基甲酰胺) 6.40 0.92 153 270
Methanol6.60 0.60 65 210
Ethylene glycol(乙二醇)6.90 19.90 197 210
Dimethyl sulfoxide() 7.20 2.24 189 268
water 10.20 1.00 100 268
展开剂
出自:
PE(60-90)
EtAc/PE=1:
2
EtAc/PE/AcOH=15:
5:
1
EtAc/AcOH/n-Butanol/H2O=2:
1:
1:
1
我一直在用的是乙酸乙酯:
环已烷,不断调节比例,直到有满意的Rf值,有拖尾时可能要加酸或碱,我一般乙酸和三乙胺。
详细柱层析技巧
出自:
常说的过柱子应该叫柱层析分离,也叫柱色谱。
我们常用的是以硅胶或氧化铝作固定相的吸附柱。
由于柱分的经验成分太多,所以下面我就几年来过柱的体会写些心得,希望能有所帮助。
柱子可以分为:
加压,常压,减压。
压力可以增加淋洗剂的流动速度,减少产品收集的时间,但是会减低柱子的塔板数。
所以其他条件相同的时候,常压柱是效率最高的,但是时间也最长,比如天然化合物的分离,一个柱子几个月也是有的。
减压柱能够减少硅胶的使用量,感觉能够节省一半甚至更多,但是由于大量的空气通过硅胶会使溶剂挥发(有时在柱子外面有水汽凝结),以及有些比较易分解的东西可能得不到,而且还必须同时使用水泵抽气(很大的噪音,而且时间长)。
以前曾经大量的过减压柱,对它有比较深厚的感情,但是自从尝试了加压后,就几乎再也没动过减压的念头了。
加压柱是一种比较好的方法,与常压柱类似,只不过外加压力使淋洗剂走的快些。
压力的提供可以是压缩空气,双连球或者小气泵(给鱼缸供气的就行)。
特别是在容易分解的样品的分离中适用。
压力不可过大,不然溶剂走的太快就会减低分离效果。
个人觉得加压柱在普通的有机化合物的分离中是比较适用的。
关于柱子的尺寸,应该是粗长的最好。
柱子长了,相应的塔板数就高。
柱子粗了,上样后样品的原点就小(反映在柱子上就是样品层比较薄),这样相对的减小了分离的难度。
试想如果柱子十厘米,而样品就有二厘米,那么分离的难度可想而知,恐怕要用很低极性的溶剂慢慢冲了。
而如果样品层只有0.5厘米,那么各组分就比较容易得到完全分离了。
当然采用粗大的柱子要牺牲比较多的硅胶和溶剂了,不过这些成本相对于产品来说也许就不算什么了(有些不环保的说,不过溶剂回收重蒸后也就减小了部分浪费)。
现在见到的柱子径高比一般在1:
5~10,书中写硅胶量是样品量的30~40倍,具体择要具体分析。
如果所需组分和杂质分的比较开(是指在所需组分rf在0.2~0.4,杂质相差0.1以上),就可以少用硅胶,用小柱子(例如200毫克的样品,用2cm×20cm的柱子);如果相差不到0.1,就要加大柱子,我觉得可以增加柱子的直径,比如用3cm的,也可以减小淋洗剂的极性等等。
关于无水无氧柱,适用于对氧,水敏感,易分解的产品。
可以湿柱,也可以干柱。
不过在样品之前至少要用溶剂把柱子饱和一次,因为溶剂和硅胶饱和时放出的热量有可能是产品分解,毕竟要分离的是敏感的东东,小心不为过。
也是因为分离的东西比较敏感,所以接收瓶一定要用可密封的,遵循schlenk操作。
至于是加压、常压、减压,随需而定。
因为是schlenk操作,所以点板是个问题,如果样品是显色的,恭喜了,不用点板,直接看柱子上的色带就行了。
如果样品无色,只好准备几十个schlenk瓶,一瓶一瓶的点,不过几次之后就知道样品在哪,也就可以省些了。
像我以无水无氧柱中用的比较多的是用氧化铝作固定相。
因为硅胶中有大量的羟基裸露在外,很容易使样品分解,特别是金属有机化合物和含磷化合物。
而氧化铝可以做成碱性、中性和酸性的,选择余地比较大,但是比硅胶要贵些。
听说有个方法,就是用石英做柱子,然后用HF254做固定相,这样在柱子外面用紫外灯一照就知道产品在哪里了,没有验证过。
哪位做过可以提出来大家参详参详。
关于湿法、干法上样。
湿法省事,一般用淋洗剂溶解样品,也可以用二氯甲烷、乙酸乙酯等,但溶剂越少越好,不然溶剂就成了淋洗剂了。
很多样品在上柱前是粘乎乎的,一般没关系。
可是有的上样后在硅胶上又会析出,这一般都是比较大量的样品才会出现,是因为硅胶对样品的吸附饱和,而样品本身又是比较好的固体才会发生,这就应该先重结晶,得到大部分的产品后再柱分,如果不能重结晶那就不管它了,直接过就是了,样品随着淋洗剂流动会溶解的。
有些样品溶解性差,能溶解的溶剂又不能上柱(比如DMF,DMSO等,会随着溶剂一起显色是一个很长的脱尾),这时就必须用干法上柱了。
样品和硅胶的量有一种说法是1:
1,我觉得是越少越好,但是要保证在旋干后,不能看到明显的固体颗粒(那说明有的样品没有吸附在硅胶上)。
溶剂的选择。
当然是最便宜,最安全,最环保的了。
所以大多选用石油醚,乙酸乙酯。
文献中有写用正己烷的,太贵了,除非特别需要不要用不然银子哗哗的,流的比淋洗剂还快,不过因为极性很小,有时还是非它不可。
乙醚也可以用,但是就是容易睡觉,注意保持清醒别让溶剂流干了,那样柱子也就不爽了。
二氯甲烷也有用的,但是要知道,它和硅胶的吸附是一个放热过程,所以夏天的时候经常会在柱子里产生气泡,天气冷的时候会好一些。
甲醇,据说能溶解部分的硅胶,所以产品如果想过元素分析的话要留神,应该经过后继处理,比如说重结晶等。
其他的溶剂用的相对较少,要依个人的不同需要选择了
由于某些原因,用到的淋洗剂多是大包装的(便宜嘛),我们这里是用10升或25升的塑料桶装的,就要注意这些工业品的纯度是较低的。
经常能够从送来的大桶底部看见有色的杂质,其他的杂质就可想而知了,所以在比较严格的柱分时就要对溶剂重蒸。
当然过原料时就可以免去这一步了,反正下面还有提纯的方法。
另外溶剂在过柱子后最好也回收使用,一方面环保,另一方面也能节省部分经费,缺点是要消耗一定的人工。
这里要注意的是,一般在过柱同时进行的是减压旋蒸,石油醚和乙酸乙酯的比例由于挥发度的不同会导致极性的变化,一般会使得极性变大,在梯度淋洗时比较合适,正好极性越来越大了。
在过完柱子后,溶剂最后回收要采用常压,因为在减压旋蒸时会有部分低沸点的杂质一起出来,常压时就会减少这种现象,如果杂质和你下面要过的样品有反应那就惨了。
关于操作问题。
1 装柱。
柱子下面的活塞一定不要涂润滑剂,会被淋洗剂带到产品中的,可以采用四氟节门的。
干法和湿法装柱觉得没什么区别,只要能把柱子装实就行。
装完的柱子应该要适度的紧密(太密了淋洗剂走的太慢),一定要均匀(不然样品就会从一侧斜着下来)。
书中写的都是不能见到气泡,我觉得在大多数情况下有些小气泡没太大的影响,一加压气泡就全下来了。
当然如果你装的柱子总是有气泡就说明需要多练习了。
但是柱子更忌讳的是开裂,甭管竖的还是横的,都会影响分离效果,甚至作废!
2 加样。
用少量的溶剂溶样品加样,加完后将下面的活塞打开,待溶剂层下降至石英砂面时,再加少量的低极性溶剂,然后再打开活塞,如此两三次,一般石英砂就基本是白色的了。
加入淋洗剂,一开始不要加压,等溶样品的溶剂和样品层有一段距离(2~4cm就够了),再加压,这样避免了溶剂(如二氯甲烷等)夹带样品快速下行。
3 淋洗剂的选择。
感觉上要使所需点在rf0.2~0.3左右的比较好。
不要认为在板上爬高了分的比较开,过柱子就用那种极性,如果rf在0.6,即使相差0.2也不容易在柱子上分开,因为柱子是一个多次爬板的状态,可以通过公式的比较:
0.6/0.8一次的分离度,肯定不如(0.2/0.3)的三次方或四次方大。
4 样品的收集。
用硅胶作固定相过柱子的原理是一个吸附与解吸的平衡。
所以如果样品与硅胶的吸附比较强的话,就不容易流出。
这样就会发生,后面的点先出,而前面的点后出。
这时可以采用氧化铝作固定相。
另外,收集的试管大小要以样品量而定,特别是小量样品,如果用大试管,可能一根就收到了三个样品,wuwu。
如果都用小试管那工作量又太大。
5 最后的处理。
柱分后的产品,由于使用了大量的溶剂,其中的杂质也会累积到产品中,所以如果想送分析,最好用少量的溶剂洗涤一下,因为大部分的杂质是溶在溶剂里的,一洗基本了,必要时进行重结晶。
补充
自然沉降法制备常压色谱柱
常压柱色谱,又称柱层析,是色谱法中最常见的一种。
它的突出优点是,分离效率比经典的化学分离方法高的多,与其他色谱法相比,不需要昂贵的仪器设备,更换流动相和吸附剂方便,消耗材料少,成本低,适合分离取样量从克到微克级范围很宽的各种样品,因此在化学实验室中至今仍被广泛应用。
为了保证色谱柱良好的分离效果,色谱柱应装填得尽可能紧密和均匀,在柱中没有气泡、裂缝或沟槽,也不发生柱的径向或轴向固定相的粒度不均匀分布。
传统常压色谱柱的填装分为干法装柱和湿法装柱(也称浆法装柱)两种,这两种方法均存在操作不易掌握、易出现气泡和裂缝,装柱时间长等不足之处。
本文提出的新的装柱方法介入干装法和湿装法之间,称之为自然沉降法。
自然沉降法通过对固定相和溶剂的选择,并辅以新的色谱柱,可对常压色谱柱进行简便、高效的填装。
用所述装柱技术制备的色谱柱对多种未知组成样品进行分离[1],分离效果明显优于传统装柱法。
此外,该法装柱快速,易掌握,不会出现断层和气泡等常见问题,装柱成功率高,具有很好的实际应用价值
关于重结晶的总结
出自:
c:
\iknow\docshare\data\cur_work\_blank
一、重结晶技术
溶剂的选择原则和经验
1、常用溶剂:
DMF、氯苯、二甲苯、甲苯、乙腈、乙醇、THF、氯仿、乙酸乙酯、环己烷、丁酮、丙酮、石油醚。
2、比较常用溶剂:
DMSO、六甲基磷酰胺、N-甲基吡咯烷酮、苯、环己酮、丁酮、环己酮、二氯苯、吡啶、乙酸、二氧六环、乙二醇单甲醚、1,2-二氯乙烷、乙醚、正辛烷。
3、一个好的溶剂在沸点附近对待结晶物质溶解度高而在低温下溶解度又很小。
DMF、苯、二氧六环、环己烷在低温下接近凝固点,溶解能力很差,是理想溶剂。
乙腈、氯苯、二甲苯、甲苯、丁酮、乙醇也是理想溶剂。
4、溶剂的沸点最好比被结晶物质的熔点低50℃。
否则易产生溶质液化分层现象。
4、溶剂的沸点越高,沸腾时溶解力越强,对于高熔点物质,最好选高沸点溶剂。
5、含有羟基、氨基而且熔点不太高的物质尽量不选择含氧溶剂。
因为溶质与溶剂形成分子间氢键后很难析出。
6、含有氧、氮的物质尽量不选择醇做溶剂,原因同上。
7、溶质和溶剂极性不要相差太悬殊。
水>甲酸>甲醇>乙酸>乙醇>异丙醇>乙腈>DMSO>DMF>丙酮>HMPA>CH2Cl2>吡啶>氯仿>氯苯>THF>二氧六环>乙醚>苯>甲苯>CCl4>正辛烷>环己烷>石油醚。
二、重结晶操作
1、 筛选溶剂:
在试管中加入少量(麦粒大小)待结晶物,加入0.5 mL根据上述规律所选择溶剂,加热沸腾几分钟,看溶质是否溶解。
若溶解,用自来水冲试管外测,看是否有晶体析出。
初学者常把不溶杂质当成待结晶物!
如果长时间加热仍有不溶物,可以静置试管片刻并用冷水冷却试管(勿摇动)。
如果有物质在上层清液中析出,表示还可以增加一些溶解。
若稍微浑浊,表示溶剂溶解度太小;若没有任何变化,说明不溶的固体是一种东西,已溶物质又非常易溶,不易析出。
2、 常规操作:
在锥形瓶或圆底烧瓶中52A0入溶质和一定溶剂,装上球冷,加热10分钟,若仍有不溶物,继续从冷凝管上口补加溶剂至完全溶解再补加过量30%溶剂。
用折叠滤纸(折叠滤纸和三角漏斗要提前预热)趁热过滤入锥形瓶。
滤液自然冷却后用布氏漏斗抽滤(用滤液反过来冲洗锥形瓶!
)。
如果物质在室温溶解度很小,滤饼可以用少量冷的溶剂淋洗(先撤掉减压,加少量溶剂润湿滤饼,再减压抽干。
注意:
用玻璃塞把滤饼压实有助于除掉更多溶剂!
)。
如果所用溶剂不易挥发,可以在常压下加入少量易挥发溶剂淋洗滤饼,如DMF可用乙醇洗,二氯苯、氯苯、二甲苯、环己酮可以用甲苯洗。
初学者常遇到问题:
大量结晶在滤纸上析出,原因是漏斗和滤纸预热不好、溶剂过量太少、过滤时间太长。
如产品贵重,可将三角漏斗和滤纸置于锥形瓶上用蒸气预热,边过滤边用已经过滤的滤液蒸气保温,但上述操作比较危险,甲苯、醚类、石油醚、环己烷等易燃溶剂慎用此法。
注意:
用热的重结晶母液淋洗滤纸和所有黏附溶质器具并冷却可减少结晶损失。
3、 反常规操作热抽滤:
吸滤瓶不能预热,布氏漏斗和滤纸放在溶解溶质的锥形瓶上面利用上升蒸气润湿,放在吸滤瓶上立即趁热抽滤。
注意抽气压力不能太大以防止吸滤瓶中母液爆沸!
初学者常犯错误:
滤纸没有贴紧(可用双层的)、动作迟缓导致结晶在布氏漏斗中析出、抽气压力太大导致滤液被吸入泵中、过滤完毕没有立即卸压导致大量溶剂被抽进泵中。
总之,与“相似相溶“背道而驰就对了,大极性的东西,用中等极性的溶剂结晶;小极性的东西,用大极性的溶剂。
这样,有一半以上的情况是适合的。
1.先试:
石油醚(正己烷)、乙醚、乙酸乙酯、乙醇、水,再试:
丙酮、甲醇、乙腈、苯、氯仿、乙酸、吡啶等。
如果还不行,就只好混合了。
乙醚可以利用其
(1)挥发性;
(2)延玻璃向上爬而使固体析出的特性。
丙酮如不与水配伍,应加以干燥。
2.混合溶剂法:
用过量热的良溶剂溶解,过滤,加热,缓慢加入不良溶剂至有浑浊,加热至澄清。
静置等待...
3.用分级结晶法。
积累的母液过柱。
1)过柱预纯化,粗分离后再结晶;
2)石油醚热提-冷析法;
3)选低沸点的溶剂如乙醚;
4)晶种的取得,用玻璃棒沾一滴溶液,挥干。
5)不要轻易冷冻,用让溶剂自然挥发的方法。
关于用乙醚结晶。
回流乙醚时,要加一冷凝管。
不断从上口加乙醚,直至混浊消失,有时是因为溶解的较慢,而不是不能溶,所以要有耐心。
如果加入很多乙醚还有少量沉淀不溶,则将其滤去,滤液浓缩至有固体析出,再加热,加入少量乙醚使澄清。
自然放冷,可得晶型较好的结晶。
过滤。
用少量乙醚洗晶体。
洗涤液合并入母液,在盛母液的瓶口蒙一层滤纸,或塞一团卫生纸,让乙醚自然挥发,而不能落入灰尘。
每天早晨看一眼,直到有满意数量的晶体出来,别太贪了,挥发干了就又要重来了:
) 我曾经用此法成功拆分了左旋和右旋的生物碱。
。
“石油醚热提-冷却法”也是我用来对付油状物的方法,加入石油醚,沸腾,倾出上清液,底部油继续加入石油醚热提取,直至石油醚层无色,则基本提取完全。
冷却后一般会析出晶体。
另外成油的一个原因是降温太快。
结晶心得
1.制备结晶,要注意选择合宜的溶剂和应用适量的溶剂。
合宜的溶剂,最好是在冷时对所需要的成分溶解度较小,而热时溶解度较大。
溶剂的沸点亦不宜太高。
一般常用甲醇、丙酮、氯仿、乙醇、乙酸乙醋等。
但有些化合物在一般溶剂中不易形成结晶,而在某些溶剂中则易于形成结晶。
2.制备结晶的溶液,需要成为过饱和的溶液。
一般是应用适量的溶剂在加温的情况下,将化合物溶解再放置冷处。
如果在室温中可以析出结晶,就不一定放置于冰箱中,以免伴随结晶析出更多的杂质。
“新生态”的物质即新游离的物质或无定形的粉未状物质,远较晶体物质的溶解度大,易于形成过饱和溶液。
一般经过精制的化合物,在蒸去溶剂抽松为无定形粉未时就是如此,有时只要加入少量溶剂,往往立即可以溶解,稍稍放置即能析出结晶。
3.制备结晶溶液,除选用单一溶剂外,也常采用混合溶剂。
一般是先将化合物溶于易溶的溶剂中,再在室温下滴加适量的难溶的溶剂,直至溶液微呈浑浊,并将此溶液微微加温,使溶液完全澄清后放置。
4.结晶过程中,一般是溶液浓度高,降温诀,析出结晶的速度也快些。
但是其结晶的颗粒较小,杂质也可能多些。
有时自溶液中析出的速度太快,超过化合物晶核的形成劝分子定向排列的速度,往往只能得到无定形粉未。
有时溶液太浓,粘度大反而不易结晶化。
如果溶液浓度适当,温度慢慢降低,有可能析出结晶较大而纯度较高的结晶。
有的化合物其结晶的形成需要较长的时间。
5.制备结晶除应注意以上各点外,在放置过程中,最好先塞紧瓶塞,避免液面先出现结晶,而致结晶纯度较低。
如果放置一段时间后没有结晶析出,可以加入极微量的种晶,即同种化合物结晶的微小颗粒。
加种晶是诱导晶核形成常用而有效的手段。
一般地说,结晶化过程是有高度选择性的,当加入同种分子或离子,结晶多会立即长大。
而且溶液中如果是光学异构体的混合物,还可依种晶性质优先析出其同种光学异构体。
没有种晶时,可用玻璃棒蘸过饱和溶液一滴,在空气中任溶剂挥散,再用以磨擦容器内壁溶液边缘处,以诱导结晶的形成。
如仍无结晶析出,可打开瓶塞任溶液逐步挥散,慢慢析晶。
或另选适当溶剂处理,或再精制一次,尽可能除尽杂质后进行结晶操作。
6.在制备结晶时,最好在形成一批结晶后,立即倾出上层溶液,然后再放置以得到第二批结晶。
晶态物质可以用溶剂溶解再次结晶精制。
这种方法称为重结晶法。
结晶经重结晶后所得各部分母液,再经处理又可分别得到第二批、第三批结晶。
这种方法则称为分步结晶法或分级结晶法。
晶态物质在一再结晶过程中,结晶的析出总是越来越快,纯度也越来越高。
分步结晶法各部分所得结晶,其纯度往往有较大的差异,但常可获得一种以上的结晶成分,在未加检查前不要贸然混在一起。
7.化合物的结晶都有一定的结晶形状、色泽、熔点和熔距,一可以作为鉴定的初步依据。
这是非结晶物质所没有的物理性质。
化合物结晶的形状和熔点往往因所用溶剂不同而有差异。
原托品碱在氯仿中形成棱往状结晶,熔点207℃;在丙酮中则形成半球状结晶,熔点203℃;在氯仿和丙酮混合溶剂中则形成以上两种晶形的结晶。
所以文献中常在化合物的晶形、熔点之后注明所用溶剂。
一般单体纯化合物结晶的熔距较窄,有时要求在0.5℃左右,如果熔距较长则表示化合物不纯
重结晶资料
结晶、重结晶和分步结晶法:
鉴定中草药化学成分,研究其化学结构,必须首先将中草药成分制备成单体纯品。
在常温下,物质本身性质是液体的化台物,可分别用分馏法或层析法进行分离精制。