化工生产.docx
《化工生产.docx》由会员分享,可在线阅读,更多相关《化工生产.docx(24页珍藏版)》请在冰豆网上搜索。
化工生产
化学高考中的重要考点—化工生产
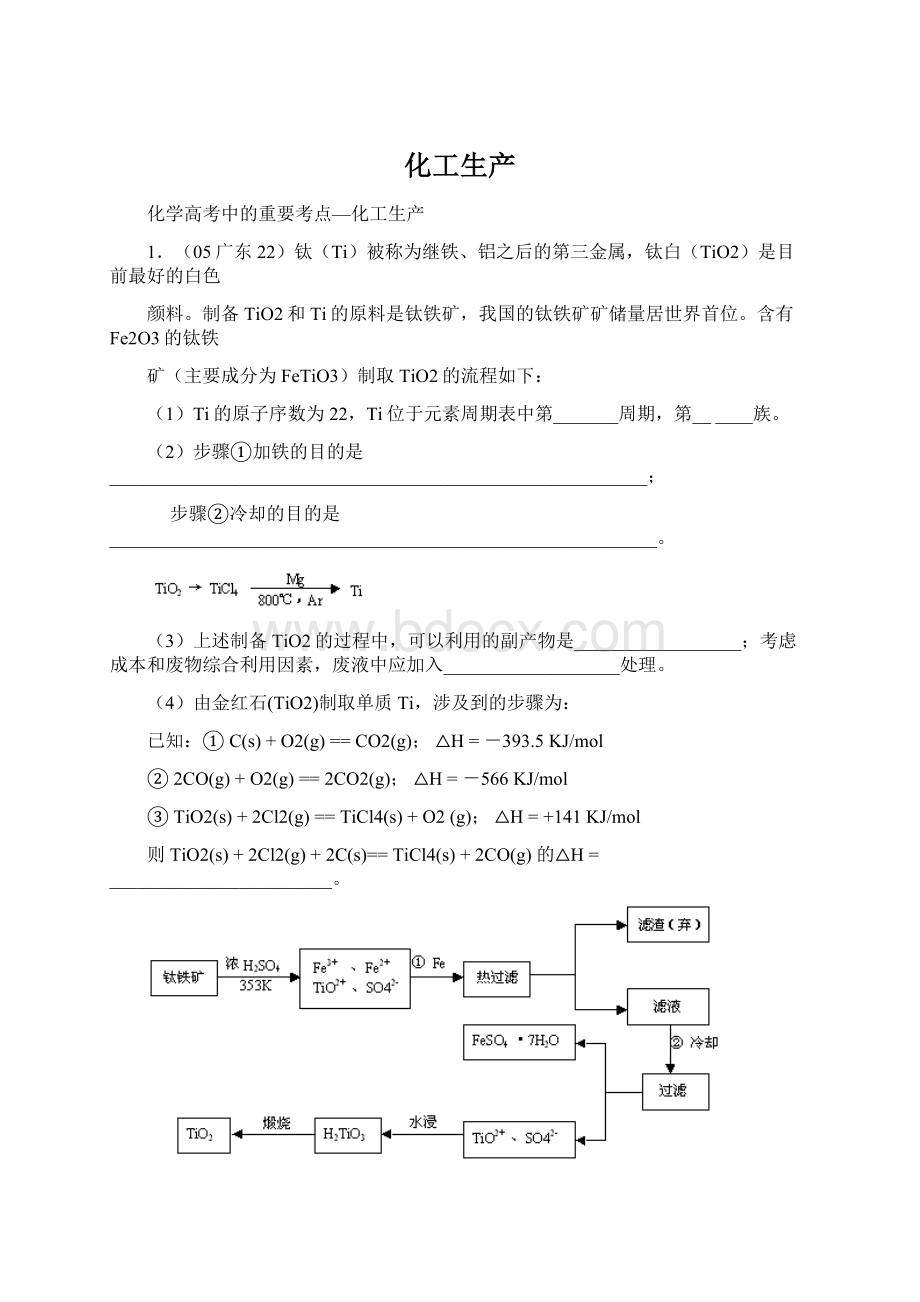
1.(05广东22)钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色
颜料。
制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿矿储量居世界首位。
含有Fe2O3的钛铁
矿(主要成分为FeTiO3)制取TiO2的流程如下:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)步骤①加铁的目的是__________________________________________________________;
步骤②冷却的目的是___________________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是__________________;考虑成本和废物综合利用因素,废液中应加入___________________处理。
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
已知:
①C(s)+O2(g)==CO2(g);△H=-393.5KJ/mol
②2CO(g)+O2(g)==2CO2(g);△H=-566KJ/mol
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H=+141KJ/mol
则TiO2(s)+2Cl2(g)+2C(s)==TiCl4(s)+2CO(g)的△H=________________________。
反应TiCl4+2Mg==2MgCl2+Ti在Ar气氛中进行的理由是_______________________。
2.(06广东22)(13分)往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应
用范围。
例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可
燃性大大降低。
该Mg(OH)2的生产工艺如下:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],反应
的化学方程为。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:
[Mg(OH)2-xClx·mH2O]==(1-
)Mg(OH)2+
MgCl2+mH2O
水热处理后,过滤、水洗。
水洗的目的是。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。
上述工艺流程
中与此有关的步骤是。
(4)已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g);△H1=+81.5kJ·mol-1
Al(OH)3(s)=
Al2O3(s)+
H2O(g);△H2=+87.7kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是,
原因是。
(5)常用阻燃剂主要有三类:
A、卤系,如四溴乙烷;B、磷系,如磷酸三苯酯;C、无机类,主要是Mg(OH)2和Al(OH)3。
从环保的角度考虑,应用时较理想的阻燃剂是(填代号),理由是。
4.(05上海27)硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。
用铁的氧化物为原料来制取聚合硫酸猴,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。
实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有。
(a)容量瓶(b)烧杯(c)烧瓶
(2)步骤
取样分析溶液中的Fe2+、Fe3+的含量,目的是。
(a)控制溶液中Fe2+与Fe3+含量比(b)确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量(d)确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+NO↑+4H2O
已知1molHNO3价格0.16元、1molNaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是,
弊是。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:
2。
根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂。
(a)NaOH(b)FeSO4(c)BaCl2(d)NaClO3
(5)需要测定和的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作(按操作先后顺序列出)。
(a)萃取、分液(b)过滤、洗涤(c)蒸发、结晶(d)冷却、称量(e)烘干或灼烧
5.高锰酸钾是锰的重要化合物和常用的氧化剂。
以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。
其消毒机理与下列物质相同的是______(填代号)。
a.84消毒液(NaClO溶液)b.双氧水c.苯酚d.75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a.浓硝酸b.硝酸银c.氯水d.烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1molMnO2可制得__________molKMnO4。
(5)该生产中需要纯净的CO2气体。
若实验室要制备纯净的CO2所需试剂最好选择_____(选填代号)。
a.石灰石b.稀HClc.稀H2SO4d.纯碱
所需气体发生装置是_____________(选填代号)。
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
6.现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题:
(1)本实验最适合的氧化剂X是_____A.K2Cr2O7B.NaClOC.H2O2D.KMnO4
(2)物质Y不可以是____A.CuOB.CuCl2C.Cu(OH)2D.CuCO3
(3)除去Fe3+的有关离子方程式是(物质Y在
(2)中选择合适的选项):
________________________________________________________________
(4)加入氧化剂的目的是____________________________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?
__________(填“能”或“不能”)。
如不能,应如何操作?
(如能,此空不填)________________________________________________。
7.氨是最重要的氮肥,是产量最大的化工产品之一。
课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g)
2NH3(g);△H=—92.4kJ/mol他因此获得了1918年诺贝尔化学奖。
试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是(填序号)
A、采用较高压强(20Mpa~50Mpa)B、采用500℃的高温C、用铁触媒作催化剂
D、将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(2)右图是实验室模拟工业法合成氨的简易装置。
简述检验有氨气生成的方法
。
(3)在298K时,将10molN2和30molH2放入合成塔中,为何放出的热量小于924kJ?
。
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。
其实验装置如图。
阴极的电极反应式。
8.空气吹出法工艺,是目前“海水提溴”的最主要方法之一。
其工艺流程如下:
(1)溴在周期表中位于_________周期,_________族。
(2)步骤
中用硫酸酸化可提高Cl2的利用率,为什么?
。
(3)步骤
的离子方程式:
________________________________________。
(4)步骤
的蒸馏过程中,溴出口温度为何要控制在80—900C。
温度过高或过低都不利于生
产,请解释原因:
___________________________
________________。
(5)步骤
中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特
点进行分离。
分离仪器的名称是______,分离时液溴从分离器的_____(填“上
口”或“下口”)排出。
(6)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯
化”:
。
强化训练
1.在硫酸工业中,通过下列反应使SO2转化为SO3:
2SO2+O2
2SO3,ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。
试回答:
(1)在生产中常用过量的空气是为了____________________________________。
(2)加热到400℃~500℃是由于_____________________________________。
(3)压强采用______________,原因是__________________________________。
(4)常用浓H2SO4来吸收SO3而不用水,因为___________________________。
2.下面是合成氨的简要流程示意图:
沿x路线回去的物质是()A.N2和H2B.催化剂C.NH3D.H2
3.利用天然气合成氨的工艺流程示意图如下:
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是_______________________________________。
(2)nmolCH4经一次转化后产生CO0.9nmol,产生H2___________________________mol
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是__________________
A.相似相溶原理B.勒夏特列原理C.酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于___________________________(写出一种用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图
中标出第三处循环(循环方向、循环物质)。
4.甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同,试解答下列问题:
(1)用化学方程式表示甲、乙、丙三个工厂合成尿素的原料气H2和CO2的生产过程。
①甲厂以焦炭、空气和水为原料;②乙厂以天然气、空气和水为原料;
③丙厂以石脑油(主要成分C5H12)、空气和水为原料。
(2)按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算为H2的物质的量)和CO2物质的量之比,则对原料的利用率最高。
据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?
5.氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上发生反应的化学方程式为________
与电源负极相连的电极附近,溶液的pH_________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为____________。
(3)如果粗盐中SO
含量较高,必须添加钡试剂除去SO
,该钡试剂可以是__________。
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO
,加入试剂的合理顺序为________________
A.先加入NaOH,后加入Na2CO3,再加入钡试剂
B.先加入NaOH,后加入钡试剂,再加入Na2CO3
C.先加入钡试剂,后加入NaOH,再加入Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________________、冷却、_______________________(填写操作名称)除去NaCl。
(6)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应;采用无隔膜电解冷的食盐水,Cl2和NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为____________________________。
6.制取硝酸铵的流程图如下,请回答下列问题:
(1)合成氨的原料通常各来自何处?
(2)已知N2(g)+3H2(g)
2NH3(g),ΔH=-92kJ·mol-1。
请解释:
①什么是可逆反应?
②为有效提高氨的产率,实际生产中宜采取哪些措施?
(3)写出氨催化氧化的化学方程式。
铂—铑合金网有何作用?
为什么铂铑合金网未预热也会
发热?
(4)生产硝酸的过程中常会产生一些氮的氧化物,如何消除它们对大气的污染?
写出反应式。
(5)举出硝酸铵的两种主要用途。
解释为什么该用途对现代社会非常重要?
(6)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为______________,平衡混合气体中NH3的体积分数为____________________________________。
7.蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。
由蛇纹石制取碱式碳酸镁的实验步骤如下:
氢氧化物
Fe(OH)3
Al(OH)3
Mg(OH)2
开始沉淀pH
1.5
3.3
9.4
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入(填入物质的化学式),然后__________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。
上述实验中,可以循环使用的物质是___________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:
浓硫酸、碱石灰):
①样品称量②高温分解③____________________________________
④____________________________________⑤MgO称量
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中:
a=_________b=_________C=_________
8.我国有丰富的天然气资源。
以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
请填写下列空白:
(1)已知0.5mol甲烷和0.5mol水蒸气在t℃,pkPa时,完全反应生成一氧化碳和氢气(合
成气),吸收了akJ热量。
该反应的热化学方程式是:
。
(2)在合成氨的实际生产过程中,常采取的措施之一是:
将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。
请应用化学反应速率和化学平衡的观点说明采取该措施的理由:
。
(3)当甲烷合成氨气的转化率为75%时,以5.60×107L甲烷为原料能够合成L氨气。
(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
①,②。
9.二氧化锰是制造锌锰干电池的基本材料。
工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。
部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
沉淀物
Al(OH)3
Fe(OH)3
Fe(OH)2
Mn(OH)2
Cu(OH)2
Zn(OH)2
CuS
ZnS
MnS
FeS
pH
5.2
3.2
9.7
10.4
6.7
8.0
≥–0.42
≥2.5
≥7
≥7
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为。
(2)滤渣A的主要成分是。
(3)加入MnS的目的是除去杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为。
(5)从废旧碱性锌锰电池中可以回收利用的物质有(写两种)。
10.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g)
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。
计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有(填字母)
A.升高温度B.降低温度C.增大压强D.减小压强E.加入催化剂G.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为:
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。
酸溶过程中需保持溶液足够酸性,其原因是。
11.羟基磷灰石[Ca5(PO4)3OH]是一种一种重要的生物无机材料。
其常用的制备方法有两种:
方法A:
用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:
剧烈搅拌下,将H3PO4溶液缓慢滴加到
Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如右图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=
Ca5(PO4)3OH↓++
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
。
(4)图中所示3种钙盐在人体中最稳定的存在形式是(填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。
结合化学平衡移动原理,分析其原因。
12.工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。
为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。
请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:
、。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。
已知该结晶水合物的相对分子质量为134,则其化学式为;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是。
(3)能用于测定硫酸尾气中SO2含量的是。
(填字母)
A.NaOH溶液、酚酞试液B.KMnO4溶液、稀H2SO4C.碘水、淀粉溶液D.氨水、酚酞
13.工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。
查表得
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=571.2kJ·mol-1①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=226.2kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。
Na2S水解的离子方程式为。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
=。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g)
2CO(g)的△H2=kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
,。
14.“温室效应”是全球关注的环境问题之一。
CO2是目前大气中含量最高的一种温室气体。
因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有:
。
(填字母)
a.减少化石燃料的使用b.植树造林,增大植被面积
c.采用节能技术d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。
CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
C6H12O6b.CO2+3H2
CH3OH+H2O
c.CO2+CH4
CH3COOHd.2CO2+6H2
CH2==CH2+4H2O
以上反应中,最节能的是,原子利用率最高的是。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。
CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体,
即:
CO2
HCOOH
CH4
①写出产生H2的反应方程式
。
②由