技术开发部表格册.docx
《技术开发部表格册.docx》由会员分享,可在线阅读,更多相关《技术开发部表格册.docx(28页珍藏版)》请在冰豆网上搜索。
技术开发部表格册
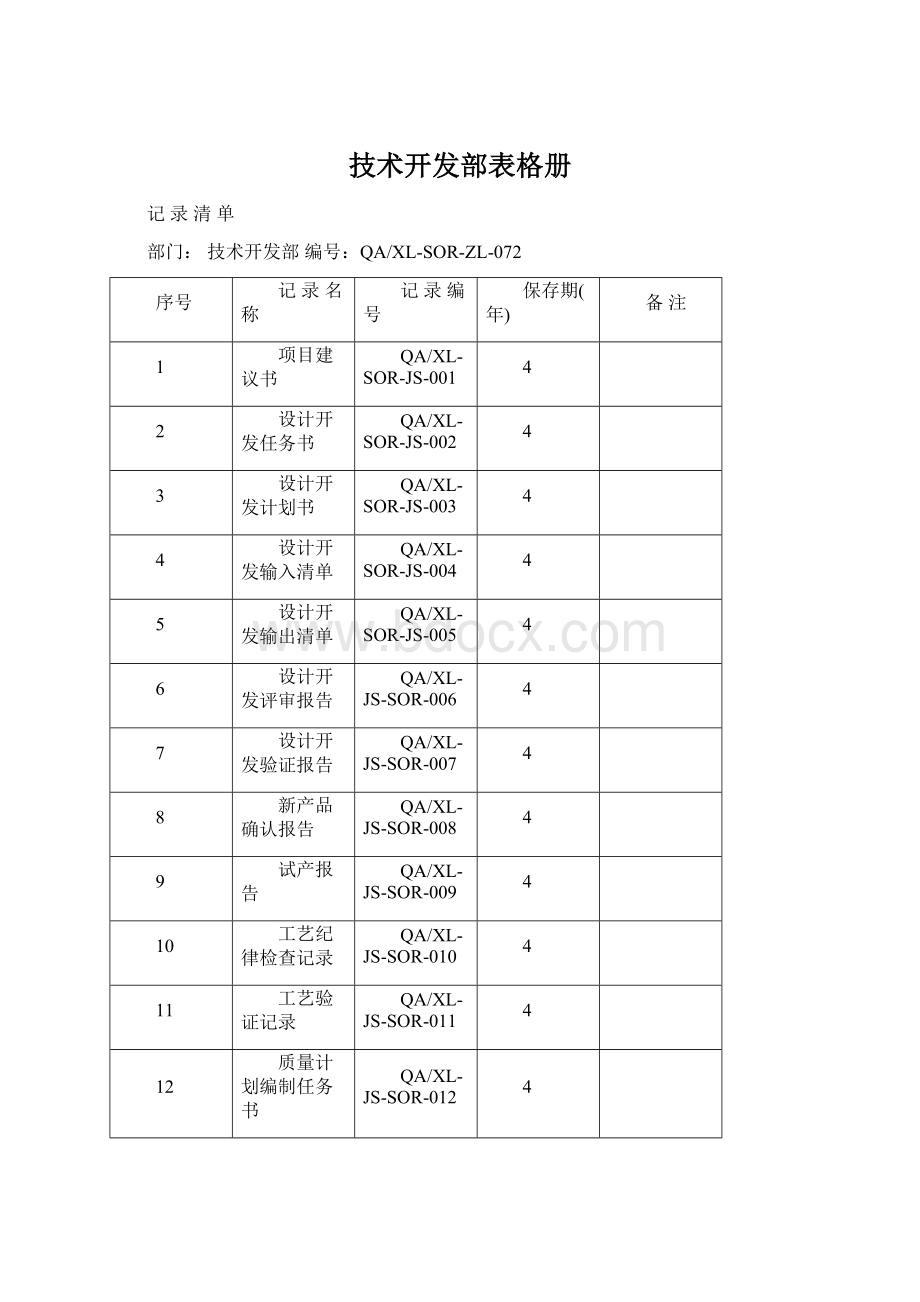
记录清单
部门:
技术开发部编号:
QA/XL-SOR-ZL-072
序号
记录名称
记录编号
保存期(年)
备注
1
项目建议书
QA/XL-SOR-JS-001
4
2
设计开发任务书
QA/XL-SOR-JS-002
4
3
设计开发计划书
QA/XL-SOR-JS-003
4
4
设计开发输入清单
QA/XL-SOR-JS-004
4
5
设计开发输出清单
QA/XL-SOR-JS-005
4
6
设计开发评审报告
QA/XL-JS-SOR-006
4
7
设计开发验证报告
QA/XL-JS-SOR-007
4
8
新产品确认报告
QA/XL-JS-SOR-008
4
9
试产报告
QA/XL-JS-SOR-009
4
10
工艺纪律检查记录
QA/XL-JS-SOR-010
4
11
工艺验证记录
QA/XL-JS-SOR-011
4
12
质量计划编制任务书
QA/XL-JS-SOR-012
4
13
产品安全特征问题清单
QA/XL-JS-SOR-013
4
14
初始危害判定、风险评价和风险控制措施评价记录表
QA/XL-JS-SOR-014
4
15
模具验收报告
QA/XL-JS-SOR-015
4
16
注塑工艺卡
QA/XL-JS-SOR-016
4
17
设计变更评审表
QA/XL-JS-SOR-017
4
18
19
20
21
22
23
24
25
项目建议书
编号:
QA/XL-SOR-JS-001
提出部门
建议人
项目名称
规格型号
销售对象
建议日期
基本要求(包括主要功能、性能、结构、外包装、技术参数说明等):
市场预测分析(包括市场需要、用户期望、竞争对手情况、产品质量现状、预期首批销量、交货期限、出厂价格等):
可引用的原技术:
可行性分析(包括技术、采购、工艺、成本等):
项目所需费用,参加人员:
主管领导审核:
签字:
年月日
总经理批示:
签字:
年月日
设计开发任务书
编号:
QA/XL-SOR-JS-002
项目名称
起止日期
规格型号
预算费用
依据的标准、法律法规及技术协议的主要内容:
产品功能描述:
技术参数及性能指标:
产品主要结构:
顾客的特殊要求:
备注:
项目负责人:
年月日
设计开发计划书
编号:
QA/XL-SOR-JS-003
项目名称
起止日期
项目来源
目标成本
规格型号
预算费用
职责
设计开发人员
职责
设计开发人员
资源配置(包括人员、生产及检测设备、设计经费预算分配及信息交流手段等)要求:
设计开发阶段的划分及主要内容
责任单位
责任人
配合部门
完成日期
备注:
编制:
批准:
日期:
日期:
设计开发输入清单
编号:
QA/XL-SOR-JS-004
项目名称
规格型号
设计开发输入清单(附相关资料份):
备注:
编制:
批准:
日期:
日期:
设计开发输出清单
编号:
QA/XL-SOR-JS-005
项目名称
规格型号
设计开发输出清单(附相关资料份):
备注:
编制:
批准:
日期:
日期:
设计开发评审报告
编号:
QA/XL-SOR-JS-006
项目名称
产品型号
设计开发阶段
负责人
评审人员
部门
职务或职称
评审人员
部门
职务或职称
评审内容:
(在“□”内打“√”表示评审通过,打“?
”表示有建议或疑问。
)
1.标准的符合性□2.采购可行性□3.加工可行性□
4.结构合理性□5.可检验性□6.环境影响性□
7.外观□8.□9.□
设计缺陷及改进建议(注明评审内容序号):
评审结论:
改进或纠正措施实施结果验证:
备注:
编制:
批准:
日期:
日期:
设计开发验证报告
编号:
QA/XL-SOR-JS-007
项目名称
规格型号
试验样编号
试验起止日期
验证单位及
参加验证人员
设计开发人综述(性能、功能、技术参数及依据的标准或法规等):
主要试验仪器和设备
序号
仪器设备名称
仪器设备编号
操作者
各专项试验/检验报告内容摘要及其结构:
设计开发验证结论:
备注:
可另附页叙述。
编制:
批准:
日期:
日期:
新产品确认报告
编号:
QA/XL-SOR-JS-008
项目名称
产品型号
评审时间
评审地点
评审方式
评审过程及主要内容:
评审结论及建议(如有函审,附参审人员函件):
评审人员姓名
所属部门
职称或职务
编制:
批准:
日期:
日期:
试产报告
编号:
QA/XL-SOR-JS-009
产品名称
试制数量
规格型号
试制日期
试制过程概况:
产品监视和测量报告内容摘要及其结论:
试制结论及建议:
编制:
年月日
审核:
年月日
总经理批示:
签名:
年月日
工艺纪律检查记录
编号:
QA/XL-SOR-JS-010
产品名称
工序名称
规格型号
检查时间
检查情况记录
检查人/日期:
结论:
□符合规定要求;□基本符合规定要求;□不符合规定要求
不合格情况处理
违规处理记录
需要其他部门配合
处理人/日期:
批准/日期:
工艺验证记录
编号:
QA/XL-SOR-JS-011
验证目的:
验证依据:
验证范围:
验证步骤:
验证人/日期:
部门会签:
部门
技术开发部
生产部
质量部
负责人
日期
审批:
管理者代表/日期:
验证结论:
部门负责人/日期:
备注:
质量计划编制任务书
编号:
QA/XL-SOR-JS-012
编制日期
策划时机
质量策划的内容:
编制/日期
审批/日期
产品安全特征问题清单
产品名称:
编号:
QA/XL-SOR-JS-013
C.2问题
特征判定
可能的危害
危害标识
C.2.1医疗器械的预期用途是什么和怎样使用医疗器械?
C.2.2医疗器械是否预期植入?
C.2.3医疗器械是否预期和患者或其他人员接触?
C.2.4在医疗器械中利用何种材料或组分,或与医疗器械共同使用或与其接触?
C.2.5是否有能量给予患者或从患者身上获取?
C.2.6是否有物质提供给患者或从患者身上提取?
C.2.7医疗器械是否处理生物材料用于随后的再次使用、输液/血或移植?
C.2.8医疗器械是否以无菌形式提供或预期由使用者灭菌,或用其它微生物学控制方法灭菌?
C.2.9医疗器械是否预期由用户进行常规清洁和消毒?
C.2.10医疗器械是否预期改善患者的环境?
C.2.11是否进行测量?
C.2.12医疗器械是否进行分析处理?
C.2.13医疗器械是否预期和其它医疗器械、医药或其它医疗技术联合使用?
C.2.14是否有不希望的能量或物质输出?
C.2.15医疗器械是否对环境影响敏感?
C.2.16医疗器械是否影响环境?
C.2.17医疗器械是否有基本的消耗品或附件?
C.2.18是否需要维护和校准?
C.2.19医疗器械是否有软件?
C.2.20医疗器械是否有储存寿命限制?
C.2.21是否有延时或长期使用效应?
C.2.22医疗器械承受何种机械力?
C.2.23什么决定医疗器械的寿命?
C.2.24医疗器械是否预期一次性使用?
C.2.25医疗器械是否需要安全地退出运行或处置?
C.2.26医疗器械的安装或使用是否要求专门的培训或专门的技能?
C.2.27如何提供安全使用信息?
C.2.28是否需要建立或引入新的制造过程?
C.2.29医疗器械的成功使用,是否关键取决于人为因素,例如用户界面?
C.2.29.1用户界面设计特性是否可能促成使用错误?
C.2.29.2医疗器械是否在因分散注意力而导致使用错误的环境中使用?
C.2.29.3医疗器械是否有连接部分或附件?
C.2.29.4医疗器械是否有控制接口?
C.2.29.5医疗器械是否显示信息?
C.2.29.6医疗器械是否由菜单控制?
C.2.29.7医疗器械是否由具有特殊需要的人使用?
C.2.29.8用户界面能否用于启动使用者动作?
C.2.30医疗器械是否使用报警系统?
C.2.31医疗器械可能以什么方式被故意地误用?
C.2.32医疗器械是否持有患者护理的关键数据?
C.2.33医疗器械是否预期为移动式或便携式?
C.2.34医疗器械的使用是否依赖于基本性能?
初始危害判定、风险评价和风险控制措施评价记录表
产品名称:
编号:
QA/XL-SOR-JS-014
危害类型
编号
可预见的事件及事件序列
危害处境
产生的后果或损害
风险估计和风险评价
采取的控制措施
采取新措施后风险估计
是否产生新的风险(若是,评定新风险)
备注
严重度
概率
风险水平
(初始)措施计划
实施验证
严重度
概率
风险水平
严重度
概率
风险水平
电磁能
H1
网电源
H2
漏电流
H3
电场
H4
磁场
辐射能
H5
电离辐射
H6
非电离辐射
热能
H7
高温
H8
低温
机械能
H9
坠落
H10
悬挂物
H11
振动
H12
贮存的能量
H13
运动零件
H14
扭转力、剪切力和张力
H15
患者的移动和定位
H16
声能
H17
高压
生物学危害(生物污染)
H18
细菌
H19
病毒
H20
其它介质(例如:
蛋白病毒)
H21
再次或交叉感染
初始危害判定、风险评价和风险控制措施评价记录表
产品名称:
编号:
QA/XL-SOR-JS-014
危害类型
编号
可预见的事件及事件序列
危害处境
产生的后果或损害
风险估计和风险评价
采取的控制措施
采取新措施后风险估计
是否产生新的风险(若是,评定新风险)
备注
严重度
概率
风险水平
(初始)措施计划
实施验证
严重度
概率
风险水平
严重度
概率
风险水平
不希望的物质
H22
不正确/不适当的配方
H23
酸或碱
H24
残留物
H25
添加剂或加工助剂
H26
清洁剂、消毒剂或试验试剂
H27
降解产物
H28
污染物
H29
微粒
H30
异物
H31
其它
生物相容性(化学成分毒性)
变态反应
H32
突变性
H33
致崎性
H34
致癌性
H35
刺激
H36
致热原
操作危害
功能
H37
不正确或不适当的输出或功能
H38
不正确的测量
H39
错误的数据转换
H40
功能的丧失或变坏
初始危害判定、风险评价和风险控制措施评价记录表
产品名称:
编号:
QA/XL-SOR-JS-014
危害类型
编号
可预见的事件及事件序列
危害处境
产生的后果或损害
风险估计和风险评价
采取的控制措施
采取新措施后风险估计
是否产生新的风险(若是,评定新风险)
备注
严重度
概率
风险水平
(初始)措施计划
实施验证
严重度
概率
风险水平
严重度
概率
风险水平
操作危害
使用错误
H41
缺乏注意力
H42
记忆力不良
H43
不遵守规则
H44
缺乏知识
H45
违反常规
标记
H46
不完整的使用说明书
H47
性能特征的不适当的描述
H48
不适当的预期使用规范
H49
限制未充分公示
操作说明书
H50
医疗器械所使用的附件的规范不适当
H51
使用前检查规范不适当
H52
过于复杂的操作说明
警告
H53
副作用的警告
H54
一次性使用医疗器械可能再次使用的危害
采取措施前风险分布
可忽略(S1)
中等(S2)
严重(S3)
高(P1)
R2
中(P2)
R5
R4
R1,R6
低(P3)
R3
最终决策:
1、R1、R2、R6不可以接受,必须采取控制措施。
2、R3、R4、可以接受,可以不采取措施,如果可行,也可以采取措施。
采取措施后风险分布
可忽略(S1)
中等(S2)
严重(S3)
高(P1)
中(P2)
R4R6
低(P3)
R5
R2R3
R1
最终决策:
1、R1、R2、R3、R4、R5、R6都可以接受
模具验收报告
编号:
QA/XL-SOR-JS-015
设备名称
设备编号
模具名称
模具编号
入厂时间
模腔数量
腔
模具制造单位
试模材料
验证日期
年月日
操作人
模具特性
1、模具与设备的配合情况:
□合格□不合格
2、模具的开模情况:
□合格□不合格
3、模具的闭模情况:
□合格□不合格
4、产品的脱模情况:
□合格□不合格
注塑工艺参数
温度(℃)
压力(Kpa)
时间(s)
一段
二段
三段
四段
注射压力
保压压力
冷却时间
参数判定
产品
质量
特性
1、产品的外观质量:
2、产品尺寸与图纸的符合性:
3、产品整体质量状况水平:
4、其它:
验证结论
参加验证人员情况
部门
职务
姓名
日期
注塑工艺卡
编号:
QA/XL-SOR-JS-016
山东XL医疗器械股份有限公司
产品名称
配件名称
设备编号
模具编号
温度(℃)
材质
一区
二区
三区
四区
注射压力
注射速度
保压压力
保压时间
冷却时间
审核/日期:
批准/日期:
注塑工艺卡
编号:
QA/XL-SOR-JS-016
山东XL医疗器械股份有限公司
产品名称
配件名称
设备编号
模具编号
温度(℃)
材质
一区
二区
三区
四区
注射压力
注射速度
保压压力
保压时间
冷却时间
审核/日期:
批准/日期: