第10讲B常见金属元素及其化合物B.docx
《第10讲B常见金属元素及其化合物B.docx》由会员分享,可在线阅读,更多相关《第10讲B常见金属元素及其化合物B.docx(11页珍藏版)》请在冰豆网上搜索。
第10讲B常见金属元素及其化合物B
第10讲 常见金属元素及其化合物(B)
时间:
45分钟 满分:
100分
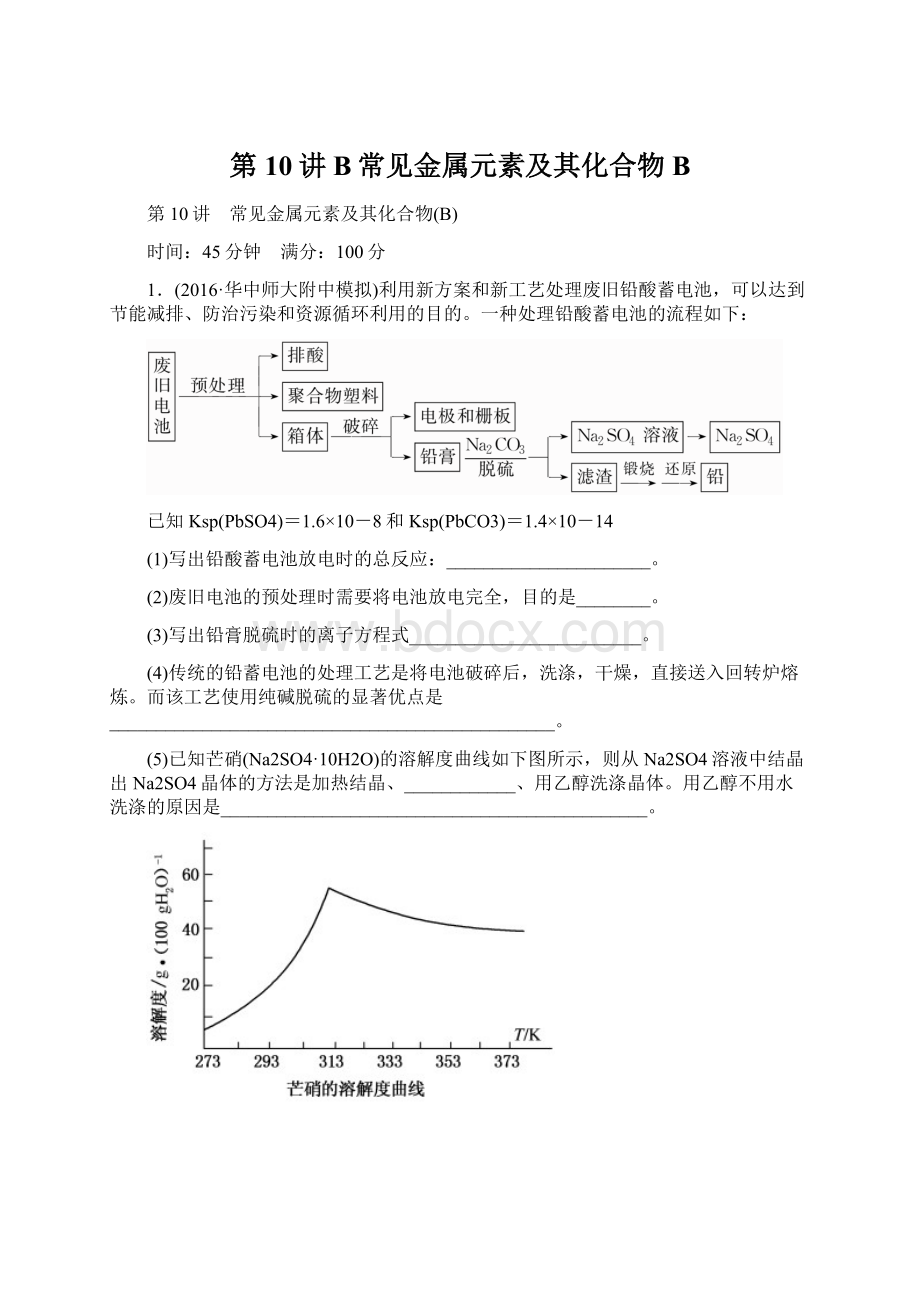
1.(2016·华中师大附中模拟)利用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。
一种处理铅酸蓄电池的流程如下:
已知Ksp(PbSO4)=1.6×10-8和Ksp(PbCO3)=1.4×10-14
(1)写出铅酸蓄电池放电时的总反应:
______________________。
(2)废旧电池的预处理时需要将电池放电完全,目的是________。
(3)写出铅膏脱硫时的离子方程式_________________________。
(4)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。
而该工艺使用纯碱脱硫的显著优点是________________________________________________。
(5)已知芒硝(Na2SO4·10H2O)的溶解度曲线如下图所示,则从Na2SO4溶液中结晶出Na2SO4晶体的方法是加热结晶、____________、用乙醇洗涤晶体。
用乙醇不用水洗涤的原因是______________________________________________。
(6)应用电化学原理,将铅膏转化为铅可以非常清洁处理蓄电池,其原理是先用细菌将铅膏转换为PbS,再用氟硼酸铁浸出PbS,化学方程式为:
PbS+2Fe[BF4]3===Pb[BF4]2+2Fe[BF4]2+S
最后通过电解浸出液得到金属铅,电解后的溶液可以循环使用,写出电解的总反应方程式___________________________________。
解析
(1)铅酸蓄电池放电时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
(2)废旧电池的预处理时需要将电池放电完全,目的是将电极材料全部转换为PbSO4。
(3)根据流程图,铅膏与碳酸钠反应生成了硫酸钠,根据反应原理,还有碳酸铅生成,反应的离子方程式为PbSO4+CO
PbCO3+SO
。
(4)与传统的铅蓄电池的处理工艺相比,传统工艺将电池破碎后,洗涤,干燥,直接送入回转炉熔炼,处理过程中会放出二氧化硫等污染物。
(5)根据芒硝(Na2SO4·10H2O)的溶解度曲线可知,芒硝的溶解度在313K之前随温度的变化较大,从Na2SO4溶液中结晶出Na2SO4晶体,加热结晶后需趁热过滤,用乙醇洗涤晶体可以防止生成芒硝晶体。
(6)将铅膏转化为铅可以非常清洁处理蓄电池,其原理是先用细菌将铅膏转换为PbS,再用氟硼酸铁浸出PbS,化学方程式为:
PbS+2Fe[BF4]3===Pb[BF4]2+2Fe[BF4]2+S,最后通过电解浸出液Pb[BF4]2+2Fe[BF4]2,得到金属铅,过程为上述过程的逆过程,同时得到Fe[BF4]3,电解后的溶液可以循环使用,因此电解的总反应方程式为Pb[BF4]2+2Fe[BF4]2
Pb+2Fe[BF4]3。
答案
(1)Pb+PbO2+2H2SO4===2PbSO4+2H2O
(2)将电极材料全部转换为PbSO4
(3)PbSO4+CO
PbCO3+SO
(4)可以减小污染,对环境友好
(5)趁热过滤 防止生成芒硝晶体
(6)Pb[BF4]2+2Fe[BF4]2
Pb+2Fe[BF4]3
2.(2016·云南上学期双基测试)以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。
工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
注:
铵黄铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12。
(1)在废渣溶解操作时,应选用____________溶解(填字母)。
A.氨水 B.氢氧化钠溶液
C.盐酸D.硫酸
(2)物质A是一种氧化剂,工业上最好选用____________(供选择使用的有:
空气、Cl2、MnO2),其理由是_________________________。
氧化过程中发生反应的离子方程式为________________________。
(3)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是________________________。
(4)铵黄铁矾中可能混有的杂质有Fe(OH)3、_________________。
铵黄铁矾与氨水反应的化学方程式为__________________。
解析
(1)该流程的目的是制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,不能引入杂质离子,所以不能用盐酸,而氨水和NaOH溶液能沉淀Fe3+和Fe2+,所以也不能用。
(2)空气中的氧气在酸性条件下可将Fe2+氧化为Fe3+,空气原料易得,成本低,不产生污染,不引入杂质。
(3)由图知,控制温度在80℃、pH为1.5,氧化时间为4小时,Fe2+的氧化率较高。
(4)废渣溶解经氧化后溶液中存在Ca2+、Mg2+、Fe3+,加氨水后,可能生成Mg(OH)2沉淀、Fe(OH)3沉淀,另外Ca(OH)2和CaSO4的溶解度较小,也可能析出。
由流程图可知,铵黄铁矾与氨水反应得到(NH4)2SO4和Fe(OH)3。
答案
(1)D
(2)空气 原料易得,成本低,不产生污染,不引入杂质 4Fe2++O2+4H+===4Fe3++2H2O
(3)溶液温度控制在80℃,pH控制在1.5,氧化时间为4小时左右
(4)Ca(OH)2、Mg(OH)2、CaSO4
(NH4)2Fe6(SO4)4(OH)12+6NH3·H2O===4(NH4)2SO4+
6Fe(OH)3↓
3.(2016·黑龙江六校模拟)硼及其化合物具有重要的工业用途。
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收镁和其中另一种金属单质A的工艺流程如图:
部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表:
沉淀物
Fe(OH)3
Al(OH)3
Mg(OH)2
pH
3.2
5.2
12.4
请回答下列问题:
(1)滤液Ⅰ所含阴离子主要是____________;可回收到的金属A的原子结构示意图为__________。
(2)试剂B为____________;“浸出”步骤中,为提高镁的浸出率,可采取的措施有____________(要求写出两条措施)。
(3)滤液Ⅱ所含金属离子为____________,调pH时需要调多次,第一次调pH主要是为了除去__________。
(4)Mg(ClO3)2在农业上有广泛的用途,可用NaClO3与MgCl2制备,已知四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
①写出反应的化学方程式:
______________。
②将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2,简述可制备Mg(ClO3)2的原因__________________________________。
解析
(1)MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3中只有氧化铝能与氢氧化钠反应;碱浸后的滤液Ⅰ中含有AlO
和OH-,最终制得的金属A是Al,Al有3个电子层,最外层电子数为3。
(2)浸出时,从化学反应速率和化学平衡的影响因素来分析判断。
(3)依据表格中pH得知,最先将pH调到3.2~5.2之间,析出氢氧化铁沉淀。
(4)①依据元素守恒以及复分解反应原理书写即可;②根据侯德榜制碱法制取NaHCO3的原理解答。
答案
(1)AlO
、OH-
(2)盐酸 升温、搅拌或适当增大酸的浓度
(3)Mg2+、Ca2+、Fe3+ Fe3+
(4)①2NaClO3+MgCl2===Mg(ClO3)2+2NaCl↓
②在相同温度下,NaCl的溶解度较小,最先析出,Mg(ClO3)2留在溶液中,通过蒸发结晶可得
4.(2016·四川六校诊断)污染物的有效去除和资源的充分利用是重要的研究课题。
某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属的化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
请回答下列问题:
(1)若将SO2气体通入下列溶液中,会褪色的是____________(填字母)。
A.品红溶液B.紫色石蕊试液
C.酸性KMnO4溶液D.溴水
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原因是_________。
(3)分别写出MnS除去溶液中的Cu2+和Ni2+的离子方程式________________________、__________________________。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中惰性电极作阳极,铁作阴极,请写出阳极的电极反应式__________________________________________________________。
(5)写出KMnO4和MnSO4溶液反应生成MnO2的化学方程式__________________________________________________________。
(6)若要制得硫酸锰晶体(MnSO4·H2O,相对分子质量为169),可以将除杂后得到的MnSO4溶液通过____________________(填操作名称)而制得。
解析
(1)SO2具有还原性,所以可以使酸性高锰酸钾和溴水褪色,SO2具有漂白性,所以可以使品红溶液褪色。
(2)铝离子、铁离子水解产生氢氧化铝、氢氧化铁和氢离子,加入的MnCO3能消耗氢离子,促使Al3+、Fe3+的水解平衡正向移动,从而使Al3+、Fe3+沉淀被除去。
(4)电解池中阳极发生氧化反应,元素的化合价升高,则MnO
被氧化为MnO
,所以阳极的电极反应式为MnO
-e-===MnO
。
(5)KMnO4与MnSO4发生归中反应生成MnO2,另外还有产物K2SO4,根据原子守恒和得失电子守恒得出化学方程式:
2KMnO4+3MnSO4+2H2O===5MnO2↓+K2SO4+2H2SO4。
(6)从溶液中得到晶体的操作是蒸发浓缩、冷却结晶、过滤。
答案
(1)ACD
(2)消耗溶液中的酸,使Fe3+和Al3+水解生成氢氧化物沉淀
(3)MnS+Cu2+===CuS+Mn2+ MnS+Ni2+===NiS+Mn2+
(4)MnO
-e-===MnO
(5)2KMnO4+3MnSO4+2H2O===5MnO2↓+K2SO4+2H2SO4
(6)蒸发浓缩、冷却结晶、过滤
5.(2016·武汉调研)废铅蓄电池的一种回收利用工艺流程如下图所示:
部分难溶电解质的性质如下表:
物质
Ksp(25℃)
颜色
PbSO4
1.8×10-8
白色
PbCO3
1.5×10-13
白色
PbCrO4
1.8×10-14
黄色
BaCrO4
1.2×10-10
黄色
Pb(OH)2
1.4×10-20
白色
回答下列问题:
(1)铅蓄电池在生产、生活中使用广泛,铅蓄电池的缺点有__________________________(写一条)。
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:
化学能→____________→____________→电能。
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混合液经____________、______________、____________等操作,可以析出十水硫酸钠晶体。
(4)利用铅泥中的PbSO4溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KClO在强碱性条件下反应制取PbO2,写出后一步生成PbO2的离子方程式__________________。
(5)25℃时,Na2CO3溶液浸出时发生的反应为:
CO
(aq)+PbSO4(s)PbCO3(s)+SO
(aq),计算该反应的平衡常数K=____________。
以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程________________________________________。
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物。
设计实验区别PbCrO4和BaCrO4__________________。
解析
(1)铅蓄电池的缺点有比能量低(或笨重、废弃电池污染环境);
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程,首先是化学能转化为热能,热能转化为机械能,机械能转化为电能;
(3)废硫酸和滤液按一定比例混合,再将混合液经蒸发浓缩、冷却结晶、过滤得到十水硫酸钠晶体;
(4)(CH3COO)2Pb溶液与KClO在强碱性条件下反应制取PbO2,Pb的化合价升高,被氧化,ClO-作氧化剂,Cl元素被还原为Cl-,结合电荷守恒、元素守恒写出反应的离子方程式为:
(CH3COO)2Pb+ClO-+2OH-===PbO2↓+Cl-+2CH3COO-+H2O;(5)反应CO
(aq)+PbSO4(s)PbCO3(s)+SO
(aq)的平衡常数K=
=
=
=1.2×105,滤渣PbCO3和焦炭为原料可制备金属铅,首先是PbCO3加热的条件下分解生成PbO,化学反应方程式为:
PbCO3
PbO+CO2↑,再用C还原PbO,反应的化学方程式为:
2PbO+C
2Pb+CO2↑;(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物,所以可以通过加入过量的KOH来区别PbCrO4和BaCrO4。
答案
(1)比能量低(或笨重、废弃电池污染环境)
(2)热能 机械能
(3)蒸发浓缩 冷却结晶 过滤
(4)(CH3COO)2Pb+ClO-+2OH-===PbO2↓+Cl-+
2CH3COO-+H2O
(5)1.2×105 PbCO3
PbO+CO2↑,2PbO+C
2Pb+CO2↑
(6)取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCrO4,不能溶解的是BaCrO4
6.(2016·烟台一模)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列方法回收钴、锂。
已知:
①Co(OH)2是两性氢氧化物。
氢氧化物
Al(OH)3
Fe(OH)2
Fe(OH)3
开始沉淀的pH
3.1
7.1
2.2
完全沉淀的pH
4.7
9.7
3.7
请回答下列问题:
(1)浸出过程中为加快浸出速率,可以采取的措施有_________(写出两点)。
(2)浸出过程中Na2S2O3被氧化为Na2SO4的化学方程式为________________________________。
该过程中可用盐酸代替H2SO4和Na2S2O3,但缺点是________________________。
(3)滤渣的成分为__________,充入空气的目的是____________。
(4)沉钴过程中不使用NaOH溶液的原因是_________________。
当溶液中c(Co2+)≤10-5mol·L-1时即认为沉淀完全,则需要控制x≥______(Ksp[Co(OH)2]=1.0×10-15)。
制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化成Co(OH)3,化学反应方程式为__________________________________________。
(5)碳酸锂的溶解度随温度的变化如下图所示,则洗涤碳酸锂沉淀时应选____________(填“热水”或“冷水”)。
解析
(1)根据影响化学反应速率的因素,增大所加溶液的浓度、提高温度、将正极材料试样粉碎(或减小正极材料试样粒径)、搅拌等措施可以加快浸出速率;
(2)根据流程图,浸出过程中Na2S2O3被LiCoO2氧化为Na2SO4,反应的化学方程式为8LiCoO2+Na2S2O3+11H2SO4===4Li2SO4+8CoSO4+Na2SO4+11H2O;如用盐酸代替H2SO4和Na2S2O3,盐酸被氧化为氯气,会污染环境;
(3)根据几种物质沉淀完全的pH数值可知,在pH=5时,生成的沉淀主要是Al(OH)3、Fe(OH)3;为了除去Fe2+,可以充入空气将Fe2+氧化为Fe3+,在pH=5时一并除去;(4)根据提示,Co(OH)2是两性氢氧化物,因此沉钴过程中不使用NaOH溶液,防止生成的Co(OH)2被NaOH溶液溶解;Ksp[Co(OH)2]=c(Co2+)c2(OH-)=10-5mol·L-1×c2(OH-)=1.0×10-15,解得:
c(OH-)=1.0×10-5,pH=9,Co(OH)2在空气中长期放置,被空气中的O2氧化成Co(OH)3,反应的化学方程式为4Co(OH)2+O2+2H2O===4Co(OH)3;
(5)碳酸锂的溶解度随温度的升高而降低,为了减少洗涤时碳酸锂的损失,应该选择热水进行洗涤。
答案
(1)增大所加溶液的浓度、提高温度、将正极材料试样粉碎(或减小正极材料试样粒径)、搅拌等
(2)8LiCoO2+Na2S2O3+11H2SO4===4Li2SO4+8CoSO4+Na2SO4+11H2O 易产生氯气,污染环境
(3)Al(OH)3、Fe(OH)3 将Fe2+氧化为Fe3+
(4)Co(OH)2是两性氢氧化物,能和强碱反应导致沉淀量减少 9 4Co(OH)2+O2+2H2O===4Co(OH)3
(5)热水