第二组阳离子分析.docx
《第二组阳离子分析.docx》由会员分享,可在线阅读,更多相关《第二组阳离子分析.docx(16页珍藏版)》请在冰豆网上搜索。
第二组阳离子分析
第三节第二组阳离子的分析(重点)
本组包括PtT、Bi3+、CiTcd+、Hg2+、aSmv)、sbmv)、Sn(吋)离子,称为铜锡组。
它们的共同特点是不被HCI溶液沉淀(PtT是很少量的(小于1mg-mL1),不能被HCI沉淀),但在0.3mol•L-1HCI溶液中,可与HS反应生成硫化物沉淀。
按照本组分出的顺序,称为第二组;按照所用的组试剂,称为硫化氢组。
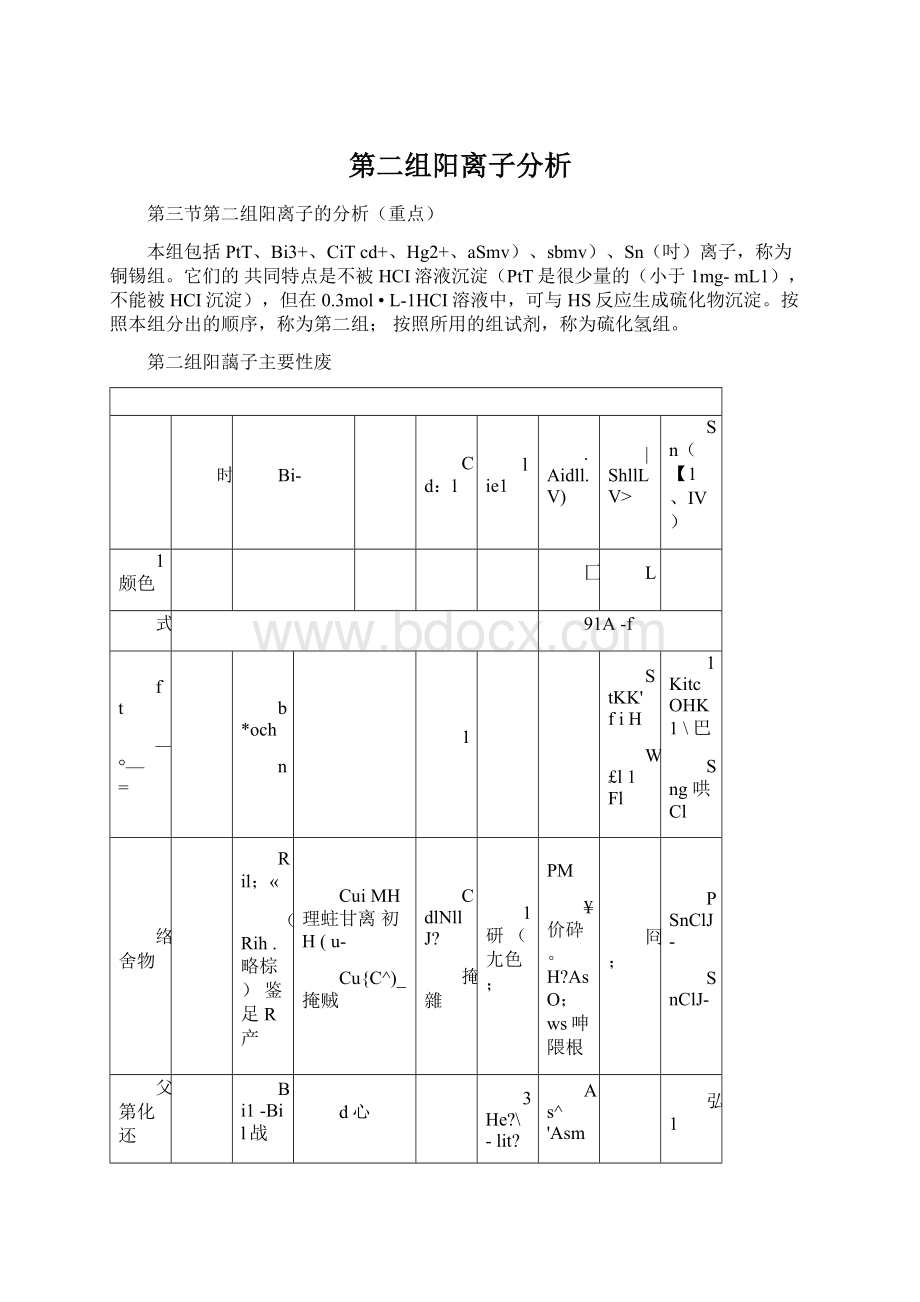
第二组阳藹子主要性废
时
Bi-
Cd:
l
lie1
.Aidll.V)
|ShllLV>
Sn(【1、IV)
1颇色
匚
L
式
91A-f
ft
—°—=
b*och
n
1
StKK'fiH
W£l1Fl
1KitcOHK1\巴
Sng哄Cl
络舍物
Ril;«
(Rih.略棕)鉴足R产
CuiMH理蛀甘离初H(u-
Cu{C^)_掩贼
CdlNllJ?
掩雜
1研(尢色;
PM
¥价砕。
H?
AsO;ws呻隈根
冏;
PSnClJ-
SnClJ-
父第化还
Kitt
Bi1-Bil战
鉴定Bi1
d心
3He?
\-lit?
*n»l蟹
As^'Asm
Z*J
弘1
&打H;S反闻
PbS1
*
■r
CuSJ
€dSI
Ad:
I谀苗1爲乂还販心70
SfcQ(ftflSh.S,•權红冋时T
Sh^Sb-'
5>n$117JAShS£1XUD.
SnUJKSna
•
畠破坏H)O,
7一机谨聖求的酸度
L曲辭解
状
剧成腔体
、本组离子的分析特性
1.离子的颜色
本组离子中,除CiT为蓝色外,其余均无色
2.离子的存在形式
铅、铋、铜、镉、汞具有显著的金属性质,在水溶液中主要以金属阳离子的形式存在;而砷、锑、锡三种元素则表现出不同程度的非金属性质,它们在溶液中的主要存在形式随酸碱环境而不同,主要以阴离子形式存在于溶液中。
但由于存在下述平衡
AsO33-+6H=As3++3HO
SbCI63=Sb3++6C1-
SnCI42-=SrT+4C「
溶液中也或多或少地存在着简单阳离子,并能生成相应的硫化物(如SnS、AS2S3等),所
以这些元素还是作为阳离子来研究。
鉴定时并不严格区分它们的存在形式,只是泛指该元素,书写时只标出其氧化数,而不
具体指明其存在形式。
3.加水稀释
Bi3+、sb"v)、Sn(n")离子(见前表)
4.络合物
本组离子一般都能生成多种络合物。
其中最常见的是氯络离子,因而大量CI-存在时可影响到各简单离子的浓度。
另外,CiT、CcT等能生成氨或氰络离子:
Cu(NH)42+、Cd(NH)42+、
Cu(CN》2+、Cd(CN》2+,它们在CiTCd+的分离和鉴定上有很多应用。
Bi3+与I-生成黄色的BiI4;用于铋的鉴定。
CiT、PtT和Bi3+能与甘油生成络离子;Hg2+与I-生成无色的Hg『,它与KOH一起的溶液,可用于NM的鉴定,称为奈氏试剂。
这些都具有一定的分析应用价值。
5.氧化还原性质
砷、锑、锡三元素的离子具有两种比较稳定的价态,它们在分析上都具有重要的意义。
例如,As(V)在冷而稀的HCI溶液中,与"S通过一系列的反应,最终得到的是AS2S4,但这个过程速率较慢,为了加速反应,先将As(V)还原为As(")。
通常使用NHI来还原。
另外,Sn(n)还原性较强,很容易被氧化为Sn(叫。
而且SnS不溶于NaS,而SnS能溶于NaS,这样在进一步分组时,把一种元素分在两个组中,将Sn(II)归于UA而Sn⑴)归于UB组,
将使操作不便,故一般在进行沉淀之前加入"Q将Sn(n)全部氧化成Sn("),并加热将剩余的"Q除去。
Bi
锑的罗丹明B试法只对sbv)有效,若溶液中的锑为三价则必须事先氧化。
此外,将还原为金属Bi是铋的重要鉴定反应之一
6.与HHS的反应及本组硫化物性质
PbS
Bi2S3
CuS
CdS
HgS
AS2S3
SbSa
SnS
SnS
颜色
黑
黑褐
黑
:
黄
黑
黄
桔红
棕
黄
稀硝酸
V
V
V
V
王水
V
V
V
V
浓盐酸
V
V
V
V
稀盐酸
V
(△)
V
NqS:
HgS2-
AsS3-
SbS3-
SnS2-
(NH4)2S:
V
V
V
NaOH
AsO3-+
3-
AsS
V
V
氨水
V
极微溶
(NH4)2CG
V
沉淀的性状:
易成胶体
沉淀的溶解度:
CdS最大。
二、组试剂与分离条件
本组与第三、四组离子分离的依据是其硫化物溶解度有显著的差异。
事实上,除本组能形成MS沉淀,第三组大多数离子也能沉淀为硫化物。
如何使本组沉淀完全,又不使第三组离子混入?
这就是要讨论的分离条件一一组试剂的作用条件。
通过对溶解度进行比较可以得出,第二组中溶解度最大的硫化物沉淀是CdS(Ksp=7.1x
10-28),第三组中溶解度最小的硫化物沉淀是ZnS(Ksp=1.2x10-23),比第二组大了大约五个数
量级,因此,按照沉淀规律,溶解度小的首先沉淀,溶解度大的不沉淀而留在溶液中,从而达到分离的目的。
也就是说:
当第二组中最难沉淀的CdS都沉淀完全时,第二组其它离子也
就沉淀完全,第三组中最容易沉淀的ZnS没有开始沉淀,第三组其它离子也就没开始沉淀。
由此可见,分离第二组、第三组的关键是使CdS沉淀完全,ZnS不沉淀。
从平衡关系
来看,这点可通过调整酸度、控制S来实现。
为了将本组比较完全地同第三组分开,我们需要讨论以下几个问题。
(1)沉淀要求的酸度
1.适宜的酸度范围
要达到这个目的,根据溶度积关系:
Ksp=[M2+][S2-],在金属离子浓度一定的情况下,是否发生沉淀反应,取决于溶液中[S2-],由于H2S是弱酸,[S2-]是随溶液酸度变化而变化,因此,可以通过调节酸度来控制溶液中S2-的浓度,从而达到分步沉淀的目的。
根据平衡:
H2S=H+hS-1.3x10-7
HS=H+扌7.1x10-15
KK2=[H+]2[S2-]/[H2S]=9.2x10-22
1
室温下,饱和H2S溶液中[H2S]〜0.1mol•L-
所以,[H+]2[S2-]=9.2x10-23
223+2
[S-]=9.2x10-/[H]
结论:
丄2丄2
1稍改变H,便可大幅度改变[S],如H改变10倍,[S]将改变100倍。
2直接控制[S2-]难办到,但改变{易办到。
3由[H+]2[S2-]=9.2x10-23和[M][S]=Ksp,可求出理论上的分离条件。
M]9.2
Ksp
10-23
[H+]=
关键1:
使第二组的CcT沉淀完全,即要求[Cd2+]=10-5mol•L-1,溶液中应达到
[H+]=
10-59.210
23
810
27
=0.34mol/L
意味着只要酸度小于0.34mol•L-1,就能使第二组离子沉淀完全。
若溶液的酸度过高,第二组中溶解度较大的CdSSnS和PbS将沉淀不完全或者不沉淀而进入第三组中。
关键2:
使第三组Zn2^沉淀,第三组中最容易沉淀的是ZnS在一般鉴定反应中,离子
的浓度在0.1mol•L-1左右,所以设定[Zn2+]=0.1mol•L-1
M.19.21023
[H+]=#~21022~=0.21mol/L
意味着只要酸度大于0.21mol•L-1,第三组离子就没有一个能沉淀。
如果酸度太低第三组溶解度最小的硫化物ZnS((p=1.2x10-23)则可能析出沉淀而进入第二组中。
结论:
①综合起来考虑,理论上酸度应控制在0.21〜0.34mol•L-1。
事实上,沉淀本组硫化物的最适宜的酸度,是通过实验方法测得的,实验证明,分离第二组与第三组最适宜的酸度是0.3mol•L-1HCI。
②实验中必须认真查对酸度。
2•酸度对砷、锑和锡的硫化物的影响
酸度过低对形成砷、锑和锡的硫化物很不利。
这是因为:
(1)它们只有在酸性环境中才能产生出生成硫化物所必需的简单阳离子。
以砷为例:
AsO33-+6H=AsT+3HO
锑盐和锡盐的情况与此类似。
(2)在中性或碱性溶液中,上述三种离子砷、锑和锡同S2-生成硫代酸盐,而不是生成硫化物沉淀。
3•沉淀的后期处理
需要指出的是,在硫化物沉淀的过程中会不断有H释放出来,例如
Cu2++fS=CuSj+2H
使得后期溶液的酸度有所增高。
为了抵消这个变化,在通HS的后期应将溶液适当地加以
稀释,稀释的程度与沉淀量有关,一般稀释1倍即可。
(2)五价砷的沉淀
在冷的稀HCI溶液中,三价砷可以很快地同H2S生成AS2S3沉淀,
2As3++HS=AS2SJ
而五价砷却并不直接与H2S生成AS2S5沉淀,而是通过下列三个步骤最后以AS2S3的形式析出:
H3AsO+HS=HAsQS+HO
H3AsOS=H3AsO+SJ
2H3AsO+3HS=As2Sa+6H>O
这个过程是很慢的。
为了加速反应,可以把溶液加热或在溶液中加入I-,先使五价砷还
原为三价砷:
3+3
AsO+21+2H=AsO+12+HO
I-转变为12后,与HS反应还可再生出来:
12+H2S=2I-+2H+SJ
可见,不需要加得太多。
一般使用NH,没有NHI时也可以用碘酒来代替,后者可被HS还原为I-。
若改用TAA就不必另NHI,TAA可还原五价砷。
(三)防止硫化物生成胶体(沉淀时的温度)
硫化物,特别是IIB组硫化物生成胶体的倾向较大,为了防止这一现象发生,第一,要
保持溶液的适当酸度,以促进胶体的凝聚(这个目的在调节酸度时即已达到);第二,硫化物沉淀要在热溶液中进行。
其目的是促进胶体凝聚和加速五价砷的还原。
但加热也会降低HS
的溶解度从而使S2-浓度减小,不利于溶解度较大的PbSCdS等沉淀生成,所以最后还要把溶液冷却至室温,再通HS。
(四)二价锡的氧化
本组内部分离时,SnS不溶于NaS,Sn"属于IIA组;SnS溶于NaS,属于IIB组,同一元素的不同价态分属两个组,组分析带来不便。
为使Sn"全部转化,可在通人HS之前加HO将Sn"氧化为然后将过剩的HO加热分解,以免以后与HS发生作用。
综上所述,本组离子沉淀的详细步骤如下:
1在酸性溶液中先加HO将Sn"-,然后,加热使过量HQ分解;
2.用NH•HO(在系统分析中,由于分出第一组阳离子的氯化物沉淀后,溶液的酸性较
强,故需先用氨水中和,再用盐酸调至所需酸度)和HCI调节[H+]=0.3mol•L-1;
3.加入少许NHI,还原As"、Sb"为As"、Sb";
4.加热,通HS,防止生成胶体;
5.冷却,将试液稀释一倍,然后通"S至沉淀完全。
(使用硫代乙酰胺时,将试液稀释一倍后酸度应为0.2mol/L)。
(五)硫代乙酰胺CHCSNH
由于HS气体毒性较大,制备也不方便,故近年来已不再使用,而改用其替代品一硫代乙酰胺CHCSNH通常简写为TAA)的水溶液代替H2S作沉淀剂。
硫代乙酰胺在酸性溶液中水解产生"S。
硫代乙酰胺水溶液在常温下比较稳定,可长期存放,只有在加热时才能发生水解反应。
硫代乙酰胺水溶液在不同的介质中加热时发生不同的水解反应,可以分别代替H2S、
(NH4)2S或NaS。
在酸性溶液中水解产生H2S,可代替H2S:
CHCSN2+H+2HOCHCOOH+N+HST
在氨性溶液中水解生成HS,相当于(NH)2S的作用:
CH3CSNH22NH3CH3CNHNH4HS
=I
NH2
在碱性溶液中水解生成扌,可代替NaS使用:
CH3CSNH23OH=CH3COONH3H2OS2
以硫代乙酰胺代替硫化氢作为组试剂具有以下特点:
(1)由于水解过程较慢,同时硫代乙酰胺的沉淀作用属于均相(匀)沉淀,故所得硫化物一般具有良好的晶形,易于分离和洗涤,共沉淀现象较少。
(2)硫代乙酰胺在90C及酸性溶液中,可在沉淀时间内将As(v)还原为As("),此时Sb(v)也同时被还原为Sb"),故不需另加NHI。
(3)硫代乙酰胺在碱性溶液中加热时,除生成S2-外,还生成一部分多硫化物。
多硫化物
具有氧化性,可将Sn(")氧化为Sn(")。
因此,若以硫代乙酰胺代替NqS作为UA组和UB组的分组试剂时,则事先可不加H2Q。
(4)由于在相同的条件下硫代乙酰胺所能提供的S2-浓度较H2S提供的低,因此分离第二、
三组阳离子时的适宜酸度为0.2mol•L-1HCl。
但在此酸度下砷的沉淀反应不完全
(AsO3-+6H=As3++3HO右向趋势很小),为了解决这一矛盾,可先将试液的酸度调至0.6mol・L-1使砷完全沉淀,由于TAA在酸性条件下水解时已消耗使酸度降低,此时再将溶液稀释一
倍,溶液的酸度正好在0.2mol•L-1左右。
综上所述,以TAA作为沉淀剂时,使本组离子沉淀的条件是:
先用氨水和盐酸调节试液的酸度为0.6mol•L-1,(在系统分析中,由于分出第一组阳离
子的氯化物沉淀后,溶液的酸性较强,故需先用氨水中和,再用盐酸调至所需酸度),加TAA
并在沸水浴上加热10min。
冷却后将试液稀释1倍,达到0.2mol•L-1酸度,再加TAA并加热10min,直至本组离子沉淀完全。
离心分离,沉淀经NHCI的稀溶液洗涤后作本组分析用;离
心液在系统分析中留作第三、四组阳离子的定性分析。
[需要指出的是,定性分析中使用的试剂如(NHhS和氨水等都应是新配制的(不应在空气中久置),否则因S2-被氧化和氨水吸收了CO会导致某些离子(特别是第四组的阳离子)提前沉淀而“丢失”O]
第二组离子的沉淀中包括八种元素所形成的硫化物,种类比较多,在分析中相互间的干扰比较大,因此,为了定性分析的方便,还可以根据硫化物的酸碱性不同将它们进一步分成两个小组。
三、铜组与锡组的分离
本组包括由八种元素所形成的离子,为了定性分析的方便,还可以根据硫化物的酸碱性不同将它们分成两个小组。
铅、铋、铜、镉的硫化物属于碱性硫化物,它们不溶于NaOHNaS和(NH)2S等碱性试剂,这些离子属于铜组(IIA);砷、锑和锡(IV)的硫化物属于两性硫化物,而且其酸性更为明显,因而能溶于上述几种碱性试剂中,属于锡组(IB)°汞的硫化物酸性较弱,只能溶解在含有高浓度扌的试剂NaS中,本章采用N@S溶液处理第二组阳离子硫化物的沉淀,因此HgS亦属
于IB组,也可用TAA(碱性溶液加热水解)或(NH)2S来代替NaS。
用(NH4)2S处理时则属于IIA组。
IB组硫化物与NaS的溶解反应如下:
Hg+S^HgS2-
23
AS2S33S2AsS3
Sb2S3+3《=2SbS3-
SnS+§-=SnS2-
离心分离,离心液留作锡组离子的分析鉴定,沉淀则用于铜组的分析。
使用NaS的缺点是少量的Bi2S3和CuS溶解,而汞的含量少时容易被IIA组留住,溶解不完全。
如改用(NH4)2S,则硫化锑和硫化锡溶解不完全,因而用得较少。
(NH4)2S优于(NH4)2S,
但它的缺点是可使相当多的铜进入IIB组,而锡量不大时,又容易把锡留在大量的硫化铜中。
因此IIA与IIB的分离还缺乏一个理想的方案。
四、铜组的分析
1铜组硫化物的溶解
在分出锡组后的沉淀中可能含有PbSBizS、CuS和CdS沉淀用含NHCI的蒸馏水洗涤干净后,加6mol•L-1HNO并加热溶解:
3PbS2NO3+8H3Pb23S2NO4H2O
Bi2S32NO38H2Bi33S2NO4H2O
CuS与CdS的溶解反应与PbS的相似。
2.Cd+的分离和鉴定
._、.2+3+2+
在铜组离子的硝酸溶液中加入甘油(1:
1)和过量的浓NaOH溶液,这时,Pb,Bi,Cu
与甘油生成甘油化合物留在溶液中,只有CcT生成白色Cd(OH*沉淀。
离心分离,离心液留作铜、铅和铋的鉴定。
Cd(OH)沉淀经稀甘油—碱溶液洗涤后,溶于3mol•L-1HCI溶液中,用水稀释试液至酸度约为0.3mol・L-1,通人"S或加加TAA并于沸水浴上加热,如有黄色沉淀(CdS)析出示有CcL
4
m=5yg,c=1:
10(100ppm)
值得注意的是,在Cd(OH)沉淀中容易夹带有共沉淀的Bi(OH)3和Cu(OH)因而溶解后通入"S时所得沉淀不是纯黄色,甚至呈暗棕色。
为此、可采取以下两项措施中的一项:
(1)防止上述现象发生的措施
将Cd(OH》溶解后,重新加入沉淀剂(甘油一碱)使其重新沉出,然后再溶解,通HS,进行鉴定。
(2)上述现象已经发生时的措施
将通HS所得沉淀离心分离、洗净,加3mol/LHCI3滴、水6滴(相当于加1mol/LHCI,降低酸度条件),加热,此时CdS溶解,CuSBi2S不溶。
离心沉降后,离心液以水稀释3倍(相当于酸度为0.3mol/L),通入HS,Cd+存在时出现黄色CdS沉淀。
3.铜的鉴定(亚铁氰化钾法)
Cu2+、pf、Bi3+等能与甘油生成可溶性配位化合物。
cf与甘油的反应的产物为甘油铜配
位化合物,使溶液显蓝色。
铅和铋的甘油化合物无色,其结构与甘油铜相似。
取此溶液可分
别鉴定铜、铅、铋
如溶液显蓝色,已证明有CiT存在。
如蓝色不明显或无色,则取少许溶液以HAc酸化,加K4Fe(CN)6]鉴定,红棕色沉淀示有
Cu
2Cu+Fe(CN)2'=CuFe(CN)6J
此沉淀不溶于稀酸,能溶于氨水生成深蓝色[Cu(NH3)4]2+,与强碱作用生成蓝色的Cu(OH>沉淀。
Fe3+及大量CcT、Ni2+对此鉴定反应有干扰。
4
m=3yg,c=1:
1.7x10(61ppm)
4.铅的鉴定(©CrQ法)
取前面得到的甘油碱溶液,以6mol/LHAc酸化,加K2CrC4溶液,黄色PbCrO沉淀,示有PtT。
如在第一组中已检出PtT,则此处铅的鉴定可免。
3
m=12.5卩g,c=1:
4x10(250ppm)
5.铋的鉴定(亚锡酸钠法)
取前述甘油碱溶液(保持原来的碱性)滴加在新配制的NaSnC溶液中、生成黑色的金属铋示有Bi3'
2Bi3++3SnCT+6OH=2BiJ+2SnCT+SHO
5
m=0.1卩g,c=1:
5x10(2ppm)
五、锡组的分析
主要是锡组沉淀,汞、砷与锑、锡分离及汞、砷分离。
1.锡组的沉淀
本组重新沉淀时,可选用HCI、HSO或浓HAc,
在用NaS或碱性TAA溶液溶出的UB组硫代酸盐溶液中,逐滴加入3mol-L-1HCI溶液(或浓HAc)至呈酸性,这时硫代酸盐被分解,析出相应的硫化物沉淀。
HgS2-+2H=Hg&+HST
2AsS-+6H=AS2S3J+3H2ST
3SbS3-+6Hf=SbS4+3HST
SnS2-+2H=SnSJ+HkST
与此同时,通常还会析出一些硫黄。
这是因为NaS很容易部分地被空气氧化为多硫化物,当它遇到H+时:
NqS+2H=2Na++H2ST+SJ
析出的少量单质硫对锡组分析妨碍不大。
离心分离,锡组硫化物沉淀用NH4CI稀溶液洗涤后留作以下分析用,一般情况下离心液可弃去。
2.汞、砷与锑、锡的分离
在上述硫化物沉淀上加8mol•L-1HCI溶液并加热,此时HgS与A2S不溶解,锑和锡的硫化物则因生成氯络离子而溶解。
3.砷与汞的分离和砷的鉴定
分出含有锑和锡的离心液后,在剩下的沉淀上加水数滴洗涤一次,然后加入过量的12%
(NH)2CO,微热,此时HgS(及S)不溶,而A2S3溶解:
AS2S3+3C&=AsS+AsO3+3CO
取一部分用(NH)2CO处理过的溶液,小心地加3mol/LHCI(防止大量气泡把溶液带出)至呈酸性,如有砷存在,生成黄色AS2S3沉淀:
AsS+AsO-+6H=AS2S3J+3H0
现象不明显时,可用砷化氢法鉴定(P.37)
4.汞的鉴定(SnCl2-苯胺法)
经上述步骤分离后,如剩下黑色残渣,则初步说明有汞,但还需证实。
将此残渣以王水
(HNO:
HCl=1:
3)溶解:
3HgS+2NG12C1+8lH=3HgC12-+3SJ+2NO?
+4HO
然后加热5-8分钟,破坏过量的王水,再以SnCI2鉴定:
SnCl2+2C1=SnCb2-
2HgC12-+SnCf=HqCYJ+SnC『+4C1
HgCl+SnCk2-=2HgJ+SnCb2-
沉淀由白变灰黑,示有汞。
如反应在滤纸上进行,则可得到黑色或棕色斑点。
苯胺存在时,反应的灵敏度增大。
亚汞盐和大量银盐干扰鉴定。
如果王水未除净,则SnCb可被王水氧化,此处将不能得到明确结果。
4
m=1卩g,c=1:
5x10(20ppm)
5.锡的鉴定(氯化亚汞法)
取一部分分出汞、砷硫化物后的8mol/LHCI溶液,用无锈的铁丝(或铁、铝粉等)将Snv还原为Snn:
SnC『+Fe=SnCl42-+Fe2++2C1
在所得溶液中加入HgCb溶液,锡存在时可发生下列反应:
SnC『+2HgC2=HgCbJ+SnC『-
SnC『+HgCl2=2HgJ+SnCb2-
灰色的HgCb+Hg或黑色的Hg沉淀,示有锡。
还原中应避免使用过多的粉状金属,它们过量存在时很容易进一步还原为Sn。
遇到这种
情形,应加一些HCI使其溶解为Sn2+,然后加入HgCb,视Snn量小和大而得到白色、灰色或黑色沉淀。
4
m=0.6卩g,c=1:
8x10(12ppm)
6.锑的鉴定(金属锡还原法)
取一滴分出汞、砷后的8mol/LHCI溶液,放在一小块锡箔上,如生成黑色斑点,用水洗净,加l滴新配的NaBrO容液。
斑点不消失,示有锑。
2SbCb3-+3Sn=2SbJ+3SnC「
当砷混入时,也能在锡箔上生成黑色斑点(As)。
但洗净后加NaBrO则溶解。
洗时要注意一定把HCI洗掉,否则在酸性条件下NaBrO也能使Sb的斑点消失。
3
m=20yg,c=1:
2.5x10(400ppm)
II-EV组
U)TAA:
调至0心luolk^HCI,
IAAfA,稀释1fl?
TAA,△*