第四节原电池原理及其应用.docx
《第四节原电池原理及其应用.docx》由会员分享,可在线阅读,更多相关《第四节原电池原理及其应用.docx(14页珍藏版)》请在冰豆网上搜索。
第四节原电池原理及其应用
学科:
化学年级:
高二
版本:
人教版期数:
1319
本周教学内容:
第四节原电池原理及其应用
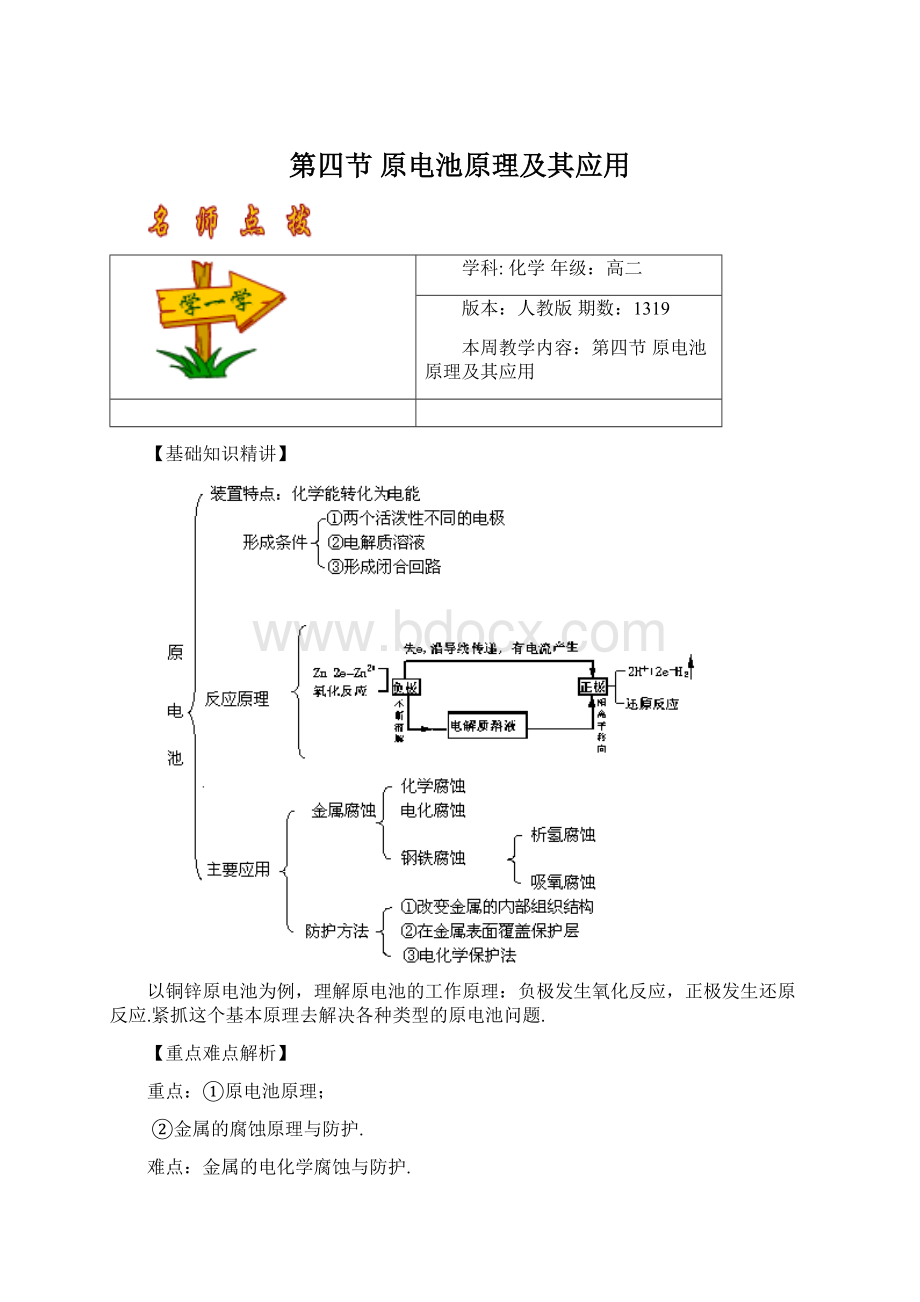
【基础知识精讲】
以铜锌原电池为例,理解原电池的工作原理:
负极发生氧化反应,正极发生还原反应.紧抓这个基本原理去解决各种类型的原电池问题.
【重点难点解析】
重点:
①原电池原理;
②金属的腐蚀原理与防护.
难点:
金属的电化学腐蚀与防护.
1.正确判定原电池
2.原电池正极和负极的确定
(1)由两极的相对活泼性确定.
(2)由电极现象确定.通常情况下,在原电池中某一电极若不断溶解或质量不断减少,该电极发生氧化反应,此为原电池的负极;若原电池中某一电极上有气体生成,电极的质量不断增加或不变,该电极发生还原反应,此为原电池的正极.
3.原电池工作原理:
以Cu-Zn原电池为例.
负极(锌板):
Zn-2e=Zn2+被氧化,锌板不断溶解;
正极(铜板):
2H+2e=H2↑被还原,表面置出气泡.
电子流动方向:
负极(Zn)经导线正极(Cu).
Cu-Zn原电池发生的总反应跟锌和酸的反应是一致的,但电子却经外接导线发生迁移,形成持续的电流,使化学能转化为电能.
构成原电池的反应必须能自发地进行氧化还原反应.从理论上讲,任何一个氧化还原反应都可设计成原电池,只不过要求氧化反应和还原反应必须在两极上分别进行,使与两极连接的导线里,产生持续电流.
【难题巧解点拨】
例1:
把a,b,c,d4块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a,b相连时,a为负极;c,d相连时,d上产生大量气泡;a,c相连时,电流由c经导线流向a;b、d相连时,电子由d经导线流向b,则此4种金属的活动性由强到弱的顺序为()
A.a>b>c>dB.a>c>d>b
C.c>a>b>dD.b>d>c>a
分析:
根据原电池原理,较活泼的金属为负极,被氧化溶解;相对不活泼的金属为正极,冒气泡或析出金属.电子由负极经外电路流向正极,电流方向与电子方向相反等进行推断可得:
a>c>d>b答案为B.例2下列装置能够组成原电池,产生电流的是()
分析:
根据构成原电池的条件必须同时满足:
(1)要有活泼性不同的两个电极.
(2)要有电解质溶液.(3)要有导线,能形成闭合回路.
用此条件进行判断:
在A中两个电极的金属相同,不符合条件,在(D)中没有电解质溶液,乙醇是非电解质.故只有B、C符合条件
答案:
BC
例3:
银锌电池是广泛用作各种电子仪器的电源,它的充电和放电过程可表示为:
2Ag+Zn(OH)2
Ag2O+Zn+2H2O
此电池放电时,负极上发生反应的物质是()
A.AgB.Zn(OH)2C.Ag2OD.Zn
分析:
根据原电池工作原理,负极上发生氧化反应.元素化合价会升高,所以在放电过程中被氧化的是Zn,即Zn为负极.
答案:
为D
【命题趋势分析】
常考知识点:
1.原电池的概念、工作原理
2.电极反应和电池反应
3.原电池原理的应用
4.结合物理的电学、工农业生产.
【典型热点考题】
1.将锌片和铜片用导线连接置于同一稀H2SO4溶液中,下列各叙述正确的是()
A.正极附近SO2-4浓度逐渐增大B.负极附近SO2-4的浓度逐渐减小
C.负极附近SO2-4的浓度逐渐增大D.正负极附近SO2-4的浓度基本不变
本题参考答案:
D
2.锌与100ml1mol·L-1盐酸反应的实验中,若设想向溶液中加入少量的①醋酸钠,或②溴化铜,或③醋酸铜(均为可溶性),并测定生成H2的速率(ml·min-1),预计三种方案的速率大小是()
A.①>③>②B.③>②>①C.②>③>①D.①>②>③
本题参考答案:
C
3.如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.
(1)片刻后可观察到的现象是()
A.铁圈和银圈左右摇摆不定B.保持平衡状态不变
C.铁圈向下倾斜D.银圈向下倾斜
(2)产生上述现象的原因是.
本题参考答案:
(1)D
(2)加CuSO4溶液后,构成Fe-Ag原电池,Fe溶解、减轻,Cu2+在银圈上得电子,沉积在其上,增重.
4.如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是,原因是.试管里的水面会上升,最终上升高约为,原因是.
本题参考答案:
铁丝表面形成一片红褐色铁锈;发生吸氧腐蚀;试管体积的
;铁和氧气反应,时间足够时铁消耗空气中全部O2,在空气中O2约占总体积的
.
5.熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:
2CO+2CO2-3-4e→4CO2
正极反应式:
;总电池反应式:
.
本题参考答案:
O2+2CO2+4e
2CO2-3;2CO+O2
2CO2
本周强化练习:
【同步达纲练习】
1.关于铜、锌和稀H2SO4构成的原电池的说法正确的是()
A.锌是正极,铜是负极B.H+在溶液里流向铜片
C.电流由锌流向铜D.电子经外电路由锌流向铜
2.铁钉和炭棒用导线连接后,浸入到0.01mol·L-1NaCl溶液中,可能发生的是()
A.炭棒上有H2析出B.炭棒附近产生OH-
C.炭棒上有O2析出D.铁钉被氧化
3.下列四组原电池,其中放电后,电解质溶液质量增加,且在正极有单质生成的是()
A.Cu、Ag、AgNO3溶液B.Zn、Cu稀H2SO4
C.Fe、Zn、CuSO4溶液D.Fe、C、Fe2(SO4)3溶液
4.实验中欲制得H2,最好的方法是()
A.纯锌与稀H2SO4B.纯锌和浓H2SO4
C.纯锌与稀盐酸D.粗锌(含铜杂质)与稀H2SO4
5.钢铁在潮湿的空气中发生电化腐蚀时,正极发生的主要反应是()
A.Fe-2e=Fe2+B.2H2O+O2+4e=4OH-
C.4OH--4e=2H2O+O2D.2H++2e=H2↑
6.埋在地下的铸铁输油管道,在下列各种情况下,腐蚀最慢的是()
A.在含铁元素较多的酸性土壤中
B.在潮湿疏松透气的土壤中
C.在干燥致密不透气的土壤中
D.在含碳粒较多的潮湿透气中性土壤中.
7.铜铁在锈蚀过程中,下列五种变化可能发生的是()
①Fe由+2价转化为+3价②氧气被还原③产生H2④Fe(OH)3失水形成Fe2O3、H2O⑤杂质碳被氧化而除去.
A.①②B.③④
C.①②③④D.①②③④⑤
8.有a,b,c,d四种金属,将a,b用导线连结起来,浸入电解质溶液中,b不易腐蚀;将a,d分别投入等浓度的盐酸中,d比a反应剧烈;将铜浸入b的盐溶液中,无明显变化;将铜浸入c的盐溶液里,有金属c析出.据此推知它们的活动性由强到弱的顺序为()
A.dcabB.dabcC.dbacD.badc
9.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池的容量更大,而且没有污染,其总反应式为:
2Zn+O2
2ZnO
所用原料为锌粒、电解液和空气.则下列叙述中,正确的是()
A.锌为正极,空气进入负极反应B.负极反应为Zn-2e
Zn2+
C.正极发生氧化反应D.电解液肯定不是强酸
10.燃料电池是燃料(如H2、CO、CH4等)跟氧气或空气起反应,将化学能转变为电能的装置,电解液为强碱溶液.()
下列关于甲烷燃料电池的说法中,正确的是()
A.负极反应为:
CH4+10OH--8e=CO2-3+7H2O
B.负极反应为:
O2+2H2O+4e
4OH-
C.随着放电进行,溶液中的阴离子向负极移动
D.随着放电进行,溶液的PH不变.
11.常用的钮扣电池为银锌电池,它分别以锌和氧化银为电极.放电时锌极上的电极反应是:
Zn+2OH--2e
Zn(OH)2,氧化银极上的反应是:
Ag2O+H2O+2e
Ag+2OH-,下列判断中,正确的是()
A.锌是负极,发生氧化反应,氧化银是正极,发生还原反应
B.锌是正极,发生氧化反应,氧化银是负极,发生还原反应
C.锌是负极,发生还原反应,氧化银是正极,发生氧化反应
D.锌是正极,发生还原反应,氧化银是负极,发生氧化反应
12.以下现象与电化腐蚀无关的是()
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生锈
D.银质奖牌久置后表面变暗
13.阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应式为:
2H2+O2
2H2O,电解液为KOH溶液,反应保持在较高温度使水蒸发,下列叙述中正确的是()
A.工作时,电解质溶液的PH逐渐增大
B.工作时,能见到浅蓝色火焰
C.工作时,H2为正极,O2为负极
D.电极反应式为:
负极:
2H2+4OH--4e=4H2O
正极:
O2+2H2O+4e
4OH-
14.铅蓄电池的两极分别为Pb、PbO2,电解液为H2SO4,工作时的反应为:
Pb+PbO2+2H2SO4=2PbSO4+2H2O,
下列结论正确的是()
A.Pb为正极被氧化B.PbO2为负极被还原
C.SO2-4只向PbO2处移动D.电解液密度不断减小
E.溶液的PH不断减小
15.锌锰干电池的正极是石墨炭棒,它放电时的总反应可表示为:
Zn(固)+2MnO2+2NH+4
Zn2++Mn2O3(固)+2NH3+H2O,在电池放电时,正极表面发生反应的物质是()
A.ZnB.石墨C.MnO2和NH+4D.Zn2+和NH3
16.锂电池是一种新型高能电池,它以轻质、高能而受到普遍重视,目前已研制成功了多种锂电池.某种锂电池的总反应可表示为:
Li+MnO2=LiMnO2,若该电池提供0.5C电量(1mol电子的电量为96500C),则消耗正极材料的质量(其它损失不计)约为()
A.3.63×105gB.3.5g
C.4.51×10-4gD.43.5g
17.纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2SO4过量时,可向其中加少量()
A.CuSO4溶液B.CuS固体C.铜D.镁条
18.下列关于实验现象的描述不正确的是()
A.把铜片和铁片紧靠在一起浸入稀H2SO4中,铜片表面出现气泡
B.把铜片插入FeCl3溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快
D.把铜片和铝片连接一起浸入浓HNO3中,铝片表面有气泡产生.
【素质优化训练】
1.铅蓄电池(原电池)工作时,总反应为Pb+PbO2+2HS2O4=2PbSO4+2H2O,由此可以判断:
(1)原电池的电极材料:
正极为,负极为.
(2)两极的电极反应式:
正极为,负极为.
(3)工作一段时间后,蓄电池里电解溶液的PH(填“变大”“变小”或“不变”).
2.1991年我国首创以铝、空气和海水电池为能源的新型海水航标灯.它以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就发出耀眼的闪光,其能量比干电池高20~50倍.根据以上叙述,填写这种电池两极的电极反应式:
(1)负极:
.
(2)正极:
.
3.称取三份锌,分盛三支试管,在试管甲里加入PH=3的盐酸50ml,在试管乙里加入PH=3的醋酸50ml,在试管丙里加入PH=3的醋酸50ml及少量铜粉,塞上导管塞子,定时测定生成H2的体积.若反应终了时,生成H2一样多,且锌没有剩余.
(1)用“>”“、”“=”或“<”回答以下问题:
①参加反应的锌的质量为:
.
②反应完毕,需反应时间的多少为:
.
(2)简答:
①反应所需时间最长的一种酸的原因是:
.
②乙、丙反应所需时间是否相等?
答:
.其原因是:
.
4.如何利用Cu+2FeCl3=2FeCl2+CuCl2设计一个原电池,画出装置图,写出电极的反应式.
5.电子表所用电池的两极材料为Zn和Ag2O,电解质溶液为KOH溶液,其电极反应是:
Zn+2OH--2e=ZnO+H2OAg2O+H2O+2e=Ag+2OH-
总反应式为:
Ag2O+Zn=2Ag+ZnO
下列判断正确的是()
A.Zn为正极,Ag2O为负极
B.Zn为负极,Ag2O为正极
C.原电池工作时,负极区溶液的PH减小
D.原电池工作时,负极区溶液的PH增大
6.由Cu片,Zn片和300ml稀H2SO4组成的原电池中,若锌片只发生电化腐蚀,则当铜片上共放出3.36L(标况)的气体时,H2SO4恰好用完,产生这些气体消耗锌g,有个电子通过了导线,原稀H2SO4的物质的量浓度为mol·L-1.
7.美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如下图所示:
两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
(1)a是极,b是极,电极反应式分别为,.
(2)飞船上宇航员的生活用水由燃料电池提供.已知这种电池发1度电时能生成350g水,试计算能量转化率.[2H2(g)+O2(g)=2H2O(l)+572KJ].
(3)这种电池的输出电压为1.5V.要使标有1.5V,1.5W的小灯泡连续发光0.5h,应消耗标况下H2多少升?
【生活实际运用】
1.电工操作中规定,不能把铜线和铝线拧在一起连接线路,这是因为.
2.银器皿日久表面逐渐变黑色,这是由于生成了Ag2S.有人设计用原电池原理加以除去,其处理方法为:
将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器侵入溶液中,放置一段时间后,黑色会褪去而银不会损失.试回答:
在此原电池反应中,负极发生的反应为;正极发生的反应为;反应过程中产生臭鸡蛋气味的气体,原电池总反应方程式为:
3.在一个盛有AgNO3溶液的烧杯中,放入质量相同的锌片和银片.两块金属片与一个小灯泡相连,经过一段时间后,从溶液中取出金属片,这时发现二者的质量有相同的变化,试确定所形成原电池的有效功率(完成电流功对理论可能功之比).
【知识验证实验】
1.自制热敷袋
【原理】铁粉在水存在下能与空气里的O2反应,放出热量4Fe+2H2O+3O2
2Fe2O3·H2O+Q
【准备】取一只约80×120mm的自封式塑料袋,另用布缝制一只略大于塑料袋的布袋.
【操作】
(1)用大头针在塑料袋上扎几十个针眼(袋的两层同时扎穿).
(2)称取15g小颗粒状活性炭,40g还原铁粉,5g细木屑,都放在一只烧杯中,再加入15ml15%食盐水,用玻璃棒搅拌均匀.
(3)把烧杯里的混合物全部加入扎过孔的塑料袋内,封上袋口,把这塑料袋放入自制的布袋中,扎住袋口.
(4)反复搓揉这袋5-8分钟,能感觉布袋的温度明显上升,可用热敷.
2.根据可逆反应:
AsO3-4+2I-+2H+
AsO2-3+I2+H2O,设计出如下的实验装置,A烧杯中装有Na3AsO4和Na3AsO3溶液,B烧杯中装有I2和KI溶液.两烧杯中用一倒置的装有饱和KI溶液的U形管相连,该装置称为盐桥.其作用是避免两烧杯中的溶液相混合,又能使两烧杯中的溶液因连通而导电.C1、C2棒为惰性电极.现进行如下操作:
(1)向A溶液中逐滴加入浓盐酸,发现电流计的指针发生偏转.
(2)若改向B溶液中滴加40%的NaOH溶液,发现电流计的指针向相反方向偏转.
试回答下列问题:
①两次操作中,电流计的指针偏转方向为什么相反?
试用化学平衡原理解释之
②
(1)操作过程中,C1棒上发生的反应是;
(2)操作过程中,C2棒上发生的反应是.
本题参考答案:
①由于[H+]的变化,使化学平衡向不同方向移动,发生不同方向的反应,其结果是电子转移方向不同。
②2I--2e
I2;
+H2O-2e
AsO3-4+2H+
【知识探究学习】
1.原电池
课文里所讲的原电池,是为了便于说明原电池化学原理的一种最简单的装置.如果用它作电源,不但效率低,而且时间稍长,电流就不断减弱,因此不适合于实际应用.这是什么原因呢?
主要是由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通.这种作用称为极化作用.为了避免发生这种现象,设计了如下图的原电池装置.
在两个烧杯中分别放入锌片和锌盐溶液、铜片和铜盐溶液,将两个烧杯中的溶液用一个装满电解质溶液的盐桥(如充满KCl饱和溶液和琼脂制成的胶冻)连接起来,再用导线将锌片和铜片联接,并在导线中串联一个电流表,就可以观察到下面的现象:
(1)电流表指针发生偏转,根据指针偏转方向,可以判断出锌片为负极、铜片为正极.
(2)铜片上有铜析出,锌片则被溶解.
(3)取出盐桥,指针回到零点,说明盐桥起了沟通电路的作用.
发生上述现象的原因是由于锌比铜活泼,容易失去电子变成Zn2+进入溶液,电子通过导线流向铜片,硫酸铜溶液中的Cu2+从铜片上获得电子变成铜原子沉积在铜片上.
由于电子从锌片流到铜片,所以锌片上发生氧化反应,铜片上发生还原反应.
Zn-2e-=Zn2+
Cu2++2e-=Cu
总反应式:
Cu2++Zn=Cu+Zn2+
一定时间后,溶液会因带电离子的积累(ZnSO4溶液中的Zn2+离子过多,CuSO4溶液中的SO2-4离子过多)而阻碍电子的转移.但有盐桥存在,允许溶液中离子迁移,以中和过剩的电荷,起了沟通电路的作用,使传递电子的反应能继续进行.于是,锌和CuSO4的氧化还原反应的化学能转变成外电路上电子流动的电能.
从分析铜-锌原电池的组成可以看出,原电池是由两个半电池组成的.锌和锌盐溶液组成一个半电池,铜和铜盐溶液组成另一个半电池.组成半电池的导体叫电极,失去电子的电极为负极,得到电子的电极为正极.不参加电极反应的电极叫惰性电极,如铜电极.
上述原电池的装置可用符号来表示:
Zn|ZnSO4‖CuSO4|Cu
负极盐桥正极
每个半电池都由两类物质组成,一类是可作还原剂的物质,如锌和铜,称为还原型物质.另一类是可作氧化剂的物质,如ZnSO4和CuSO4,称为氧化型物质.
相对应的氧化型物质和还原型物质组成氧化还原电对,常用如下符号表示:
Zn2+/Zn,Cu2+/Cu.不同氧化态的同一元素的离子或单质等也可构成氧化还原电对,如Fe3+/Fe2+、Cl2/Cl-、O2/OH-等.
参考答案:
【同步达纲练习】
1.BD2.BD3.BC4.D5.B6.C7.C8.B
9.BD10.AC11.A12.D13.D14.D15.C16.C17.C18.B
【素质优化训练】
1.
(1)PbO2Pb
(2)PbO2+2e+SO2-4+4H+=PbSO4+2H2O
Pb-2e+SO2-4=PbSO4(3)变大
2.
(1)Al-3e=Al3+
(2)2H2O+O2+4e=4OH-
3.
(1)①甲=乙=丙②甲>乙>丙
(2)①随着反应的进行,盐酸里[H+]减小得最多,反应速率减小最快,时间最长.
②不相等,丙中形成了铜锌原电池,加速了锌的反应,丙中反应较乙中快。
4.用铜和炭棒作电极,FeCl3溶液为电解质溶液。
电极反应式(-):
Cu-2e=Cu2+
(+):
2Fe3++2e=2Fe2+
5.BC
6.9.75、1.806×1023、0.5
7.
(1)负;正;2H2+4OH--4e
4H2O;
O2+2H2O+4e
4OH-
(2)64.7%(3)0.325
【生活实际运用】
1.在潮湿的空气中,铜、铝线接触能形成原电池,使铝很快被腐蚀.
2.【答案】2Al-6e=2Al3+;3Ag2S+6e=6Ag+3S2-
3Ag2S+2Al+6H2O=6Ag+2Al(OH)3↓+3H2S↑
3.【解答】设电化学过程和化学过程共溶解锌的物质的量为1mol,电化学过程溶解锌的物质的量为xmol,则化学过程溶解锌的物质的量为(1-x)mol
电化学过程:
负极:
Zn-2e
Zn2+正极:
2Ag++2e
2Ag
xmol2xmol2xmol2xmol(沉积在银上)
化学过程:
Zn+2Ag+
Zn2++2Ag
(1-x)mol2(1-x)mol(沉积在锌片上)
两极增重相等,则有:
108×2x=108×2(1-x)-65×1x=0.35(mol)
原电池的有效功率为:
×100%=35%