高考化学推断题综合题专题复习镁及其化合物专题解析1.docx
《高考化学推断题综合题专题复习镁及其化合物专题解析1.docx》由会员分享,可在线阅读,更多相关《高考化学推断题综合题专题复习镁及其化合物专题解析1.docx(18页珍藏版)》请在冰豆网上搜索。
高考化学推断题综合题专题复习镁及其化合物专题解析1
高考化学推断题综合题专题复习【镁及其化合物】专题解析
(1)
一、镁及其化合物
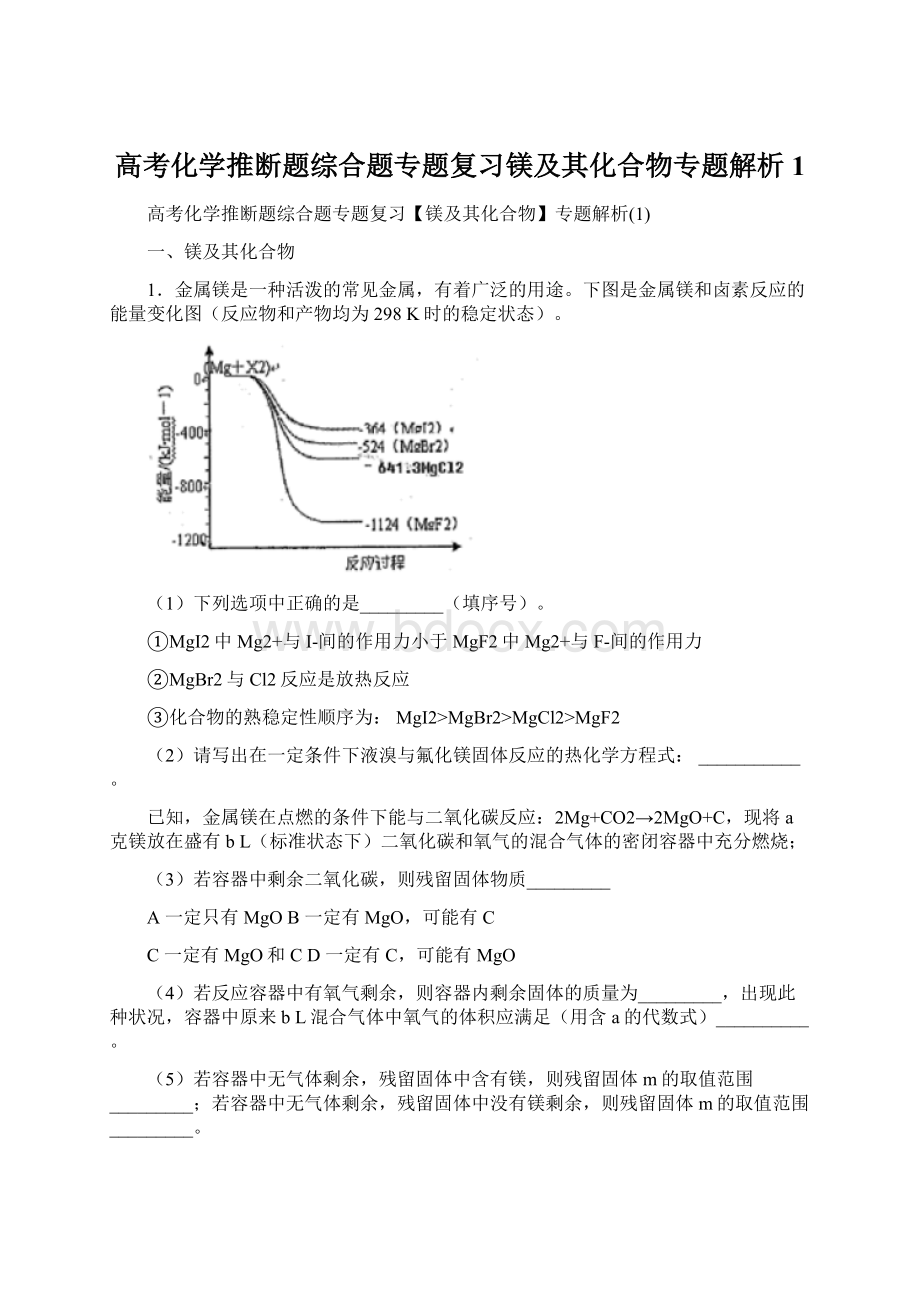
1.金属镁是一种活泼的常见金属,有着广泛的用途。
下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
(1)下列选项中正确的是_________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②MgBr2与Cl2反应是放热反应
③化合物的熟稳定性顺序为:
MgI2>MgBr2>MgCl2>MgF2
(2)请写出在一定条件下液溴与氟化镁固体反应的热化学方程式:
___________。
已知,金属镁在点燃的条件下能与二氧化碳反应:
2Mg+CO2→2MgO+C,现将a克镁放在盛有bL(标准状态下)二氧化碳和氧气的混合气体的密闭容器中充分燃烧;
(3)若容器中剩余二氧化碳,则残留固体物质_________
A一定只有MgOB一定有MgO,可能有C
C一定有MgO和CD一定有C,可能有MgO
(4)若反应容器中有氧气剩余,则容器内剩余固体的质量为_________,出现此种状况,容器中原来bL混合气体中氧气的体积应满足(用含a的代数式)__________。
(5)若容器中无气体剩余,残留固体中含有镁,则残留固体m的取值范围_________;若容器中无气体剩余,残留固体中没有镁剩余,则残留固体m的取值范围_________。
【答案】①②MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ/molB
gb>V(O2)>
(a+
)<m<(a+
)
<m<
【解析】
【分析】
(1)①离子晶体中离子键越强,离子晶体越稳定;
②如果反应物能量之和大于生成物能量之和,则是放热反应;
③化合物的热稳定性与物质的能量大小有关,能量越小越稳定;
(2)根据盖斯定律书写;
(3)镁在燃烧时先和氧气反应生成氧化镁,当氧气完全反应后,镁再和二氧化碳反应生成氧化镁;
(4)若氧气有剩余,则镁只和氧气反应生成氧化镁,根据原子守恒计算;采用极限的方法计算;
(5)若容器中无气体剩余,残留固体中含有镁,假设气体全部为氧气或二氧化碳,然后采用极限的方法解答;若容器中无气体剩余,残留固体中没有镁剩余,说明二者完全反应。
【详解】
(1)①相同类型的离子晶体中,离子键越强,则离子间作用力越强,物质含有的能量越低,所以MgI2中Mg2+与I−间的作用力小于MgF2中Mg2+与F−间的作用力,故正确;
②根据图象知,反应物的能量大于生成物能量,所以Mg与F2的反应是放热反应,故正确;
③能量越小的物质越稳定,所以化合物的热稳定性顺序为MgI2<MgBr2<MgCl2<MgF2,故错误;
故选①②;
(2)镁和氟气反应的热化学反应方程式为:
Mg(s)+F2(g)=MgF2(s)△H=−1124kJ/mol①
Mg(s)+Br2(l)=MgBr2(s)△H=−524kJ/mol②
将方程式②−①得MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=(−524kJ/mol)−(−1124kJ/mol)=+600kJ/mol,故答案为:
MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ/mol;
(3)镁先和氧气反应生成氧化镁,当氧气完全反应后,镁再和二氧化碳反应生成氧化镁,若容器中剩余二氧化碳,二氧化碳可能参加反应也可能不参加反应,所以残留固体物质一定含有氧化镁,可能含有碳,故选B;
(4)镁的物质的量=
=
mol,若氧气有剩余,则镁只和氧气反应生成氧化镁,根据原子守恒得n(Mg)=n(MgO),所以氧化镁的质量=
mol×40g/mol=
g;
氧气有剩余,氧气的最小体积为大于和镁完全反应的体积,而小于气体总体积,2Mg+O2=2MgO,根据镁和氧气的关系式得当镁和氧气恰好反应时需要气体氧气物质的量=
mol×
=
mol,则需要氧气体积=
mol×22.4L/mol=
L,所以氧气的体积为b>V(O2)>
,故答案为:
g;b>V(O2)>
;
(5)若容器中无气体剩余,残留固体中含有镁,说明镁不足量,假设气体全部是氧气,氧气完全反应时固体质量增加的质量=
mol×32g/mol=
g,则固体质量为(a+
)g;
假设气体全部是二氧化碳,根据2Mg+CO2→2MgO+C知,固体增加的质量为二氧化碳的质量,所以固体增加的质量=
mol×44g/mol=
g,所以固体质量为(a+
)g,则容器内固体质量为(a+
)<m<(a+
);
假设镁和氧气恰好反应,固体的质量为氧化镁的质量=
g;
假设镁和二氧化碳恰好反应,固体的质量为镁和二氧化碳的质量=a+
×1×44g/mol=
g,实际上固体质量介于二者之间,为
<m<
,故答案为:
(a+
)<m<(a+
);
<m<
。
【点睛】
根据镁和氧气、二氧化碳之间的反应结合极限法来分析解答,明确镁和氧气、二氧化碳混合气体反应的先后顺序是解本题关键。
2.短周期元素形成的物质A、B、C、D、E,它们的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的电子式:
_____________
(2)若E是有臭鸡蛋气味,D是既能溶于强酸,又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因:
____________________
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系:
_______________________________
(3)若C是一种气体,D是一种强酸,且E与A相同,则C与水反应的化学方程式为(请标出电子转移方向和数目):
__________________________________________
(4)若A是一种单质,该元素的原子最外层电子数等于最内层,气体E能使湿润的红色石蕊试纸变蓝,那么化合物D是_____________。
【答案】
H++H2O+AlO2-
Al(OH)3
Al3++3OH-c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
Mg(OH)2
【解析】
【分析】
(1)若C是离子化合物,D是一种强碱,可能为NaOH,则C可为Na2O2(或NaH),生成气体为O2或H2;
(2)D是既能溶于强酸、又有溶于强碱的化合物,应为Al(OH)3,E的水溶液呈现弱酸性,E可能与A、B两种物质中的某种相同,结合转化关系分析可知C应为H2S;
(3)若C是一种气体,D是一种强酸,C应为NO2,则D为HNO3,E为NO,结合物质的性质解答该题;
(4)若A是一种单质,该元素的原子最外层电子数等于最内层,气体E能使湿润的红色石蕊试纸变蓝,则气体E为NH3,A为Mg,B为氮气,生成的C为Mg2N3。
那么化合物D是
【详解】
(1)若C是离子化合物,D是一种强碱,可能为NaOH,则C可为Na2O2,生成气体为O2或H2,Na2O2是离子化合物,其电子式为
;
(2)D是既能溶于强酸、又有溶于强碱的化合物,应为Al(OH)3,E的水溶液呈现弱酸性,E可能与A、B两种物质中的某种相同,结合转化关系分析可知C应为H2S;
①D为氢氧化铝既能溶于强酸,又能溶于强碱的原因的电离方程式为酸式电离和碱式电离,电离方程式为:
H++H2O+AlO2-
Al(OH)3
Al3++3OH-;
②E为H2S,与NaOH反应生成的正盐溶液为硫化钠溶液,硫离子水解,溶液中离子浓度存在电荷守恒为:
c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-):
(3)若C是一种气体,D是一种强酸,应C为NO2,则D为HNO3,E为NO;
NO2与水反应生成HNO3和NO,反应的方程式为3NO2+H2O=2HNO3+NO,此反应为氧化还原反应,反应中电子转移的方向和数目为
;
(4)若A是一种单质,该元素的原子最外层电子数等于最内层,气体E能使湿润的红色石蕊试纸变蓝,则气体E为NH3,A为Mg,B为氮气,生成的C为Mg2N3,Mg2N3溶于水发生双水解,生成氨气和氢氧化镁,故D为Mg(OH)2。
3.X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)。
(1)若X的摩尔质量是W的2倍,工业上Z可作优质的耐高温材料。
W为黑色固体,则Y的化学式________________。
(2)若固体W是紫红色,且向溶液Z中滴入氯水,再滴入2滴KSCN溶液,溶液呈血红色。
则写出X+Y=Z+W的离子方程式__________________________。
(3)若晶体W是一种重要的半导体材料,实验室可用澄清石灰水来检验Z的燃烧产物。
写出Y与NaOH溶液反应的化学方程式________________________________________。
【答案】CO2Fe+Cu2+=Fe2++CuSiO2+2NaOH=Na2SiO3+H2O
【解析】
(1)X、W为单质,Y、Z为化合物,W为黑色固体,应为C单质,X的摩尔质量是W的2倍,Z可作优质的耐高温材料,X为Mg,Z为MgO,Y为CO2。
(2)向溶液Z中滴入氯水,再滴入2滴KSCN溶液,溶液呈血红色,则Z为Fe2+,W是紫红色固体,则W为Cu,X+Y=Z+W反应方程式为:
Fe+Cu2+=Fe2++Cu。
(3)晶体W是一种重要的半导体材料,则W是Si;实验室可用澄清石灰水来检验Z的燃烧产物,则Z的燃烧产物为CO2,化合物Z为CO,则X为C单质,Y为SiO2,Y与NaOH溶液反应的化学方程式为:
SiO2+2NaOH=Na2SiO3+H2O。
4.已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:
(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为__________,写出A+E→D的化学反应方程式__________________________。
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为_____________,写出A+E→D的化学反应方程式_____________________。
(3)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为____________,写出A+E→D的化学反应方程式___________________________。
【答案】CuOCuO+H2
Cu+H2O
3Fe+4H2O
Fe3O4+4H2
2Mg+CO2
2MgO+C
【解析】
【详解】
(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则A-E分别为氢气、氧气、铜、水、氧化铜,氢气与氧化铜加热时反应生成铜和水;
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则A-E分别为铁、氧气、氢气、四氧化三铁、水;铁与水蒸气加热时反应生成四氧化三铁和氢气;
(3)若常温下B为气体,C为黑色固体,则A-E分别为Mg、氧气、C、MgO、二氧化碳,镁与二氧化碳反应生成氧化镁和碳;
5.在一定条件下,单质B、C、D、E都能与A单质发生化合反应,转化关系如图所示。
已知:
①G是黑色晶体,能吸附B单质;②H能与氢氧化钠溶液或盐酸反应;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应;④I是绿色植物光合作用的原料,温室中常用它作肥料。
根据上述信息,回答下列问题:
(1)I的电子式为____________,G的俗名是_____________。
(2)以C和E为电极在NaOH溶液中构成原电池,该原电池的负极反应式为________。
(3)根据E和A反应的能量变化图像写出热化学方程式:
_______________。
(4)两种常见含C元素的盐,一种pH>7,另一种pH<7,写出这两种溶液混合时发生反应的离子方程式:
____________________;
(5)写出B在高温下和水蒸气反应的化学方程式并标出电子转移方向和总数________。
【答案】
磁性氧化铁Al-3e-+4OH-=AlO2-+2H2O2Mg(s)+O2(g)=2MgO(s)△H=-10QkJ/mol3AlO2-+Al3++6H2O=Al(OH)3↓
【解析】
【分析】
单质B、C、D、E都能与A单质发生化合反应,①G是黑色晶体,能吸附B单质,可推断B为Fe,G为Fe3O4,A为O2;②H能与氢氧化钠溶液或盐酸反应说明是两性氧化物,C为Al,H为Al2O3;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应,是铝热反应,证明E为Mg,F为MgO;④I是绿色植物光合作用的原料,温室中常用它作肥料,则I为CO2,D为C,E+I=F发生的是2Mg+CO2
C+2MgO,据此解答。
【详解】
根据上述分析可知:
A为O2;B为Fe;C为Al;D为C;E为Mg;F为MgO;G为Fe3O4,H为Al2O3;I为CO2。
(1)I为CO2,电子式为
;G为Fe3O4,俗名是磁性氧化铁;
(2)以铝和镁为电极在NaOH溶液中构成原电池,铝与NaOH溶液反应,作原电池的负极,该原电池的负极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(3)根据能量变化图像可知镁和氧气反应的热化学方程式:
2Mg(s)+O2(g)=2MgO(s)△H=-10QkJ/mol;
(4)两种常见含铝元素的盐,一种pH>7,该盐为偏铝酸盐,另一种pH<7,该盐为铝盐,两种溶液混合时发生反应的离子方程式为3AlO2-+Al3++6H2O=Al(OH)3↓;
(5)铁在高温下和水蒸气反应产生Fe3O4和H2,在该反应中Fe失去电子变为Fe3O4,H2O中的H得到电子变为H2,3molFe失去8mol电子,故反应的电子转移表示为:
。
【点评】
本题考查无机物推断,物质的颜色、物质的特殊性质等是推断突破口,需要学生熟练掌握元素化合物知识,结合元素及化合物的结构与性质分析、解答。
6.在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。
经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
(1)写出代表下列线段发生的反应的离子方程式:
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量之比为_____________。
(3)图中B点时所加入溶液中含NaOH为________mol
(4)若向50mL2mol·L-1的AlCl3溶液中加入100mLKOH溶液,充分反应后得到3.12g沉淀。
则KOH的物质的量浓度可能为________________________________。
【答案】Al(OH)3+OH-=AlO2-+2H2O2∶10.8mol1.2mol·L﹣1、3.6mol·L﹣1
【解析】试题分析:
本题考查与Al(OH)3有关的图像的计算,Al3+与强碱反应的计算。
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液,图像中OD段发生的反应为MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl;Mg(OH)2不溶于NaOH溶液,Al(OH)3溶于NaOH溶液,DC段发生的反应为Al(OH)3+NaOH=NaAlO2+2H2O。
(1)DC段为Al(OH)3溶于NaOH生成NaAlO2和H2O,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(2)根据纵坐标,Mg(OH)2物质的量为0.2mol,n(Mg2+)=n[Mg(OH)2]=0.2mol,Al(OH)3物质的量为0.3mol-0.2mol=0.1mol,n(Al3+)=n[Al(OH)3]=0.1mol,原溶液中Mg2+、Al3+物质的量之比为0.2mol:
0.1mol=2:
1。
(3)根据反应Mg2++2OH-=Mg(OH)2↓,Mg2+消耗的NaOH物质的量为0.2mol
2=0.4mol;B点时Al3+完全转化为AlO2-,根据反应Al3++4OH-=AlO2-+2H2O,到B点时Al3+消耗的NaOH物质的量为0.1mol
4=0.4mol;图中B点所加溶液中含NaOH物质的量为0.4mol+0.4mol=0.8mol。
(4)n(AlCl3)=2mol/L
0.05L=0.1mol,n[Al(OH)3]=
=0.04mol
0.1mol。
可能存在两种情况,①若加入的KOH溶液较少使部分AlCl3反应生成Al(OH)3沉淀,根据反应AlCl3+3KOH=3KCl+Al(OH)3↓,消耗的KOH物质的量n(KOH)=3n[Al(OH)3]=3
0.04mol=0.12mol,c(KOH)=
=1.2mol/L;②若加入的KOH使AlCl3完全沉淀,KOH又溶解了部分Al(OH)3,AlCl3完全沉淀消耗KOH物质的量为0.1mol
3=0.3mol,生成Al(OH)3沉淀的最大值为0.1mol,则溶解的Al(OH)3物质的量为0.1mol-0.04mol=0.06mol,根据反应Al(OH)3+KOH=KAlO2+2H2O,溶解Al(OH)3消耗的KOH物质的量为0.06mol,加入的KOH物质的量为0.3mol+0.06mol=0.36mol,c(KOH)=
=3.6mol/L;KOH物质的量浓度可能为1.2mol/L或3.6mol/L。
7.将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
(1)Mg和Al的总质量为g
(2)硫酸的物质的量浓度为.
(3)NaOH溶液的物质的量浓度为.
【答案】
(1)9.0g
(2)1.0mol/L(3)5.0mol/L
【解析】
试题分析:
(1)由图可知,0~20mL发生酸碱中和反应,20~200mL发生反应生成氢氧化镁和氢氧化铝沉淀,200~240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,由图象可知,n(Mg)="0.15"mol,n(Al)="0.2"mol,则Mg和Al的总质量为0.15×24+0.2×27=9.0g;
(2)由200~240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,则c(NaOH)="0.2/0.04"="5"mol/L,200mL时生成沉淀最多,溶液中的溶质为硫酸钠,则c(H2SO4)=(0.2×5÷2)/0.5=1.0mol/L;
(3)NaOH溶液的物质的量浓度为5.0mol/L。
考点:
镁、铝的性质
8.某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
(提示:
镁、铝均与酸反应,铝还能和碱反应:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑)
实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是除去铝镁合金表面的氧化膜。
(1)A中试剂为______.(填“NaOH溶液”或“稀盐酸”)
(2)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录
C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温;④由A向B中滴加足量试剂;⑤检查气密性;⑥调整橡胶软管使D和C的液面相平。
上述操作的顺序是__________;(填序号)
(3)B中发生反应的离子方程式为__________________
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将___________.(填“偏大”、“偏小”、“不受影响”)
(5)若实验用铝镁合金的质量为ag,测得氢气体积为bml(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为__________.(用含a、b、c的代数式表示)
【答案】NaOH溶液⑤①④③⑥①②2Al+2OH-+2H2O=2AlO2-+3H2↑偏小
【解析】
【分析】
(1)Mg、Al均可以和酸反应,因此不可以用酸来实验,由于Al可以和碱反应而不和Mg反应,则可以用NaOH与Al反应制得H2,然后用排水法收集H2,以计算Al的量;
(2)整个操作过程及原理是:
检查气密性;记录起始液面;加入碱反应;不产生气体后,记录C中的液面,两者相减即为产生H2的量;最后称得的固体即为Mg的质量.在读数时要注意D、C液面相平,否则气体将受压,造成读数不准;
(3)B中发生的是Al与碱的反应;
(4)未洗涤,则造成(a-c)变小,再分析判断;
(5)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量,而n(Al)可以由产生的H2获得。
【详解】
(1)根据铝镁的化学性质,铝镁都能与酸反应放出氢气,但铝还能与碱(如NaOH溶液)反应放出氢气,而镁不能,要测定铝镁合金中铝的质量分数,应选择NaOH溶液;
(2)实验时首先要检查气密性,记下量气管中C的液面位置,再加入NaOH溶液开始反应,待反应完毕并冷却至室温后,调整橡胶软管使D和C的液面相平,再记录量气管中C的液面位置,最后将B中剩余固体过滤,洗涤,干燥,称重;故答案为⑤①④③⑥①②;
(3)B管中铝与NaOH溶液的反应生成NaAlO2和H2,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)铝的质量分数为:
×100%,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,铝的质量分数偏小;
(5)铝镁合金的质量为ag,B中剩余固体镁的质量为cg,则参加反应的铝的质量为(a-c)g,设铝的相对原子质量为M,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2M 3×22400ml
(a-c)g bml
解之得:
M=
。
9.镁的化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是________,还生成少量的________(填化学式)。
(2)物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为_____________
A.3.2gB.4.0gC.4.2gD.4.6g
(3)镁作为一种强还原剂,还用于钛和铀的生产,写出镁与TiCl4在高温条件下制取钛的化学方程式_______________。
(4)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
Mg2Cu是一种储氢合金。
350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077),Mg2Cu与H2反应的化学方程式为___________。
(5)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是__________,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式______________________。
【答案】MgOMg3N2D
+2价2CH3MgCl+2H2O=Mg(OH)2↓+2CH4↑+M