酶工程复习提纲.docx
《酶工程复习提纲.docx》由会员分享,可在线阅读,更多相关《酶工程复习提纲.docx(25页珍藏版)》请在冰豆网上搜索。
酶工程复习提纲
酶工程复习提纲
第二章酶的定义、组成、特征及分类
一、从化化学本质上讲酶到底是一种什么物质?
二、一般催化剂的特性:
1.只能进行热力学上允许进行的反应;
2.可以缩短化学反应到达平衡的时间,而不改变反应的平衡点;
3.通过降低活化能加快化学反应速度。
4.它本身的数量和化学性质在化学反应后不发生改变。
三、酶作为催化剂的显著特点:
高效、专一、温和、可调节
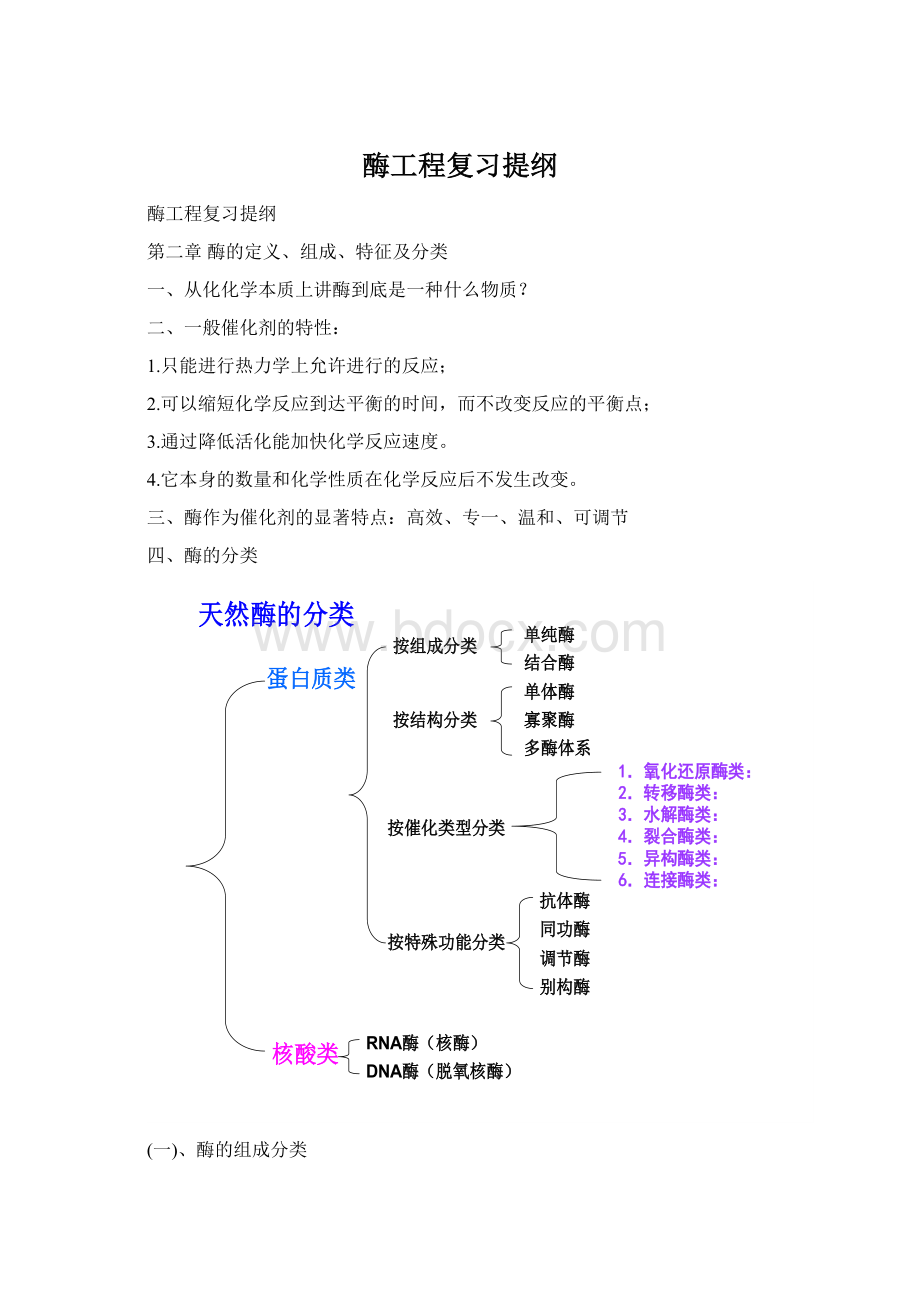
四、酶的分类
(一)、酶的组成分类
单纯酶:
它们的组成为单一的蛋白质。
结合酶(全酶):
蛋白质(酶蛋白)+辅因子
酶蛋白决定反应的特异性,辅因子决定反应的类型与性质。
辅因子:
辅酶:
与酶蛋白结合疏松,可用透析或超滤的方法除去的辅因子。
辅基:
与酶蛋白结合紧密,不能可用透析或超滤的方法除去的辅因子。
(二)、酶的结构分类
(1)、单体酶(monomericenzyme):
仅具有三级结构的酶,即只由一条肽链组成的酶。
(2)、寡聚酶(oligomericenzyme):
两个或两个以上的相同或不同亚基以共价键方式连接而形成的酶。
(3)、多酶复合体(多酶体系,multienzymesystem):
由几种功能不同的酶聚合在一起,分工合作。
共同催化一个生化反应过程。
(4)、多功能酶(multifunctionalenzyme):
一些多酶体系在进化的过程中由于基因融合,致使多种不同催化功能存在于一条多肽链上,这种一条肽链具有多种催化功能的酶叫多功能酶。
(三)、酶的功能组成—酶的活性中心
酶的活性中心:
与底物结合并进行催化反应的特殊的必需基团。
结合基团:
决定酶的专一性
活性中心内的必需基团
必需基团:
催化基团:
决定酶的催化性质
活性中心外的必需基团:
维持酶的空间结构和催化功能所必需的基团
五、酶的专一性;
第三章酶的作用机理
一、酶作用专一性的机制
(一)“三点结合”的催化理论
三点结合”的催化理论认为酶与底物的结合处至少有三个点,只有当三点完全结合的情况下。
催化作用才能实现,酶促反应才能进行。
(二)锁钥学说
锁钥学说认为整个酶分子的天然构象是具有刚性结构的,酶表面具有特定的形状。
酶与底物的结合如同一把钥匙对一把锁一样,那把钥匙开那把锁。
也就是说,只有当底物的形状与酶的活性中心的构象完全匹配时,酶与底物才能结合,催化反应才能进行。
(三)诱导嵌合学说(Inducedfitmodel)
酶活性中心的结构有一定的灵活性,当底物(激活剂或抑制剂)与酶分子结合时,在底物的诱导下,酶蛋白的构象发生了有利于与底物结合的变化,使反应所需的催化基团和结合基团正确地排列和定向,这样酶与底物才能很好地结合,酶促反应才得以进行。
二、酶高效催化的机制
(一)、酶为什么能催化化学反应
1、分子发生化学反应的必要条件:
活化能和能障
在化学反应体系中,并不是所有的分子都能参加化学反应,只有那些所含能量达到或超过一定限度(平均能量)的分子才能参与反应。
这些能参与反应的分子称为活化分子,由常态分子转变为活化分子所需的能量称为活化能。
活化分子含有的能参与化学反应的最低限度的能量称为化学反应的能阈或能障。
因此,只有那些所含能量大于能障的分子才能参与化学反应。
在一个化学反应体系中,活化分子越多,反应就越快。
所以,设法增加活化分子数,就能加速化学反应。
2、增加活化能(活化分子)的途径
增加活化分子有两种可能的途径:
一是加热或光照射增加能量,使一部分分子获得能量而活化,直接增加活化分子数目,以加速化学反应的进行。
另一种途径是降低活化能的阈值,间接增加活化分子数目。
催化剂的作用就是降低反应的活化能。
酶是如何降低化学反应的活化能的呢?
(二)、有关酶高效率机理的假说
1、中间产物学说
中间产物学说是目前较公认的解释酶作用机理的理论。
这个理论认为:
在酶促反应中,底物先与酶结合,形成不稳定的中间产物—ES复合物,然后再分解释放出酶与产物。
ES的形成,改变了原来反应的途径。
酶的活性中心与底物分子通过短程非共价键(如氢键,离子键和疏水键等)的作用,形成ES复合物,使底物的价键状态发生形变或极化,从而激活底物分子和降低过渡态活化能,使底物的活化能大大降低,结果使反应加速。
2.趋近效应(approximation)和定向效应(orientation)
通常底物浓度与化学反应速度成正比。
若在反应系统的某一局部区域,底物浓度增高,则反应速度也随之提高。
趋近效应指由于活性中心的立体结构和相关基团的诱导和定向作用,使底物分子中参与反应的基团相互接近,底物在酶活性中心的有效浓度大大增加,并被严格定向定位,从而降低了进入过渡态所需的活化能。
使酶促反应具有高效率。
酶的活性中心部位,一般都含有多个起催化作用的基团,这些基团在空间有特殊的排列和取向,可以对底物价键的形变和极化及调整底物基团的位置等起到协同作用,从而使底物达到最佳反应状态。
3、张力作用(distortionorstrain)
底物的结合可诱导酶分子构象发生变化,比底物大得多的酶分子的三、四级结构的变化,也可对底物产生张力作用,使底物扭曲,促进ES进入活性状态。
4、酸碱催化(acid-basecatalysis)
酸和碱是有机反应中用途最广和最普遍的催化剂。
酸-碱催化可分为狭义的酸-碱催化和广义的酸-碱催化。
酶参与的酸-碱催化反应一般都是广义的酸-碱催化方式。
广义酸-碱催化是指通过质子酸提供部分质子,或是通过质子碱接受部分质子的作用,达到降低反应活化能的过程。
酶的活性中心具有某些氨基酸残基的R基团,这些基团往往是良好的质子供体或受体,在水溶液中这些广义的酸性基团或广义的碱性基团对许多化学反应是有力的催化剂。
如氨基、羧基、巯基、酚羟基及咪唑基等。
影响酸碱催化反应速度的因素有两个:
第一个因素是酸碱的强度。
第二个因素是这些功能基供出质子或接受质子的速度。
共价催化:
催化剂通过与底物形成反应活性很高的共价过渡产物,使反应活化能降低,从而提高反应速度的过程,称为共价催化。
某些酶与底物结合形成一个反应活性很高的共价中间产物,这个中间产物以较大的机率,转变为过渡态,因此反应的活化能大大降低,底物可以越过较低的能障而形成产物。
5、共价催化作用可分为亲核催化作用和亲电子催化作用两大类。
①亲核催化作用:
亲核催化是指具有一个非共用电子对的基团或原子,攻击缺少电子具有部分正电性的原子,并利用非共用电子对形成共价键催化反应。
酶分子中具有催化功能的亲核基团主要是:
组氨酸的咪唑基、丝氨酸的羟基、半胱氨酸的巯基。
此外,许多辅酶也具有亲核中心。
酶中参与共价催化的基团主要包括His的咪唑基,Cys的硫基,Asp的羧基,Ser的羟基等。
②亲电子催化作用:
在亲电子催化作用中,催化剂和底物的作用与亲核催化相反,就是说,亲电子催化剂缺少电子,从底物中吸取一个电子对形成共价键催化反应。
酶分子亲电子的基团有亲核碱基被质子化的共轭酸,如—NH3+。
在酶的亲电子催化过程中,有时其必需的亲电子物质不是上述的共轭酸,而是由酶中非蛋白组成的辅因子提供,其中金属阳离子是很重要的一类。
6、金属离子催化作用
(1)、提高水的亲核性能:
金属离子可以和水分子的OH-结合,使水显示出更大的亲核催化性能。
(2)、电荷屏蔽作用
(3)、电子传递中间体
第四章影响酶促反应速度的因素
一、底物浓度对酶反应速度的影响
(一)、单底物反应
1、米氏方程
底物浓度较低时,增加底物浓度可加快酶促反应速度。
当底物饱和时,酶促反应速度不会再随底物浓度的增加而加快。
底物浓度与酶促反应速度的关系通常用米氏方程来表示:
2、米氏常数的定义
米氏常数是酶促反应速度达到最大反应速度的一半时的底物浓度。
Km是一个物理常数。
米氏常数的单位是mM。
3、米氏常数的意义
(1)Km是酶的一个特征性常数,只与酶的性质有关,与酶的浓度无关。
(2)如酶能催化几种不同的底物,对每种底物都有一个特定的Km值,其中Km值最小的称该酶的最适底物。
(3)Km除了与底物类别有关,还与pH、温度有关。
(4)Km表示酶和底物的亲和力。
Km越大,表示和底物的亲和力越小。
判断代谢反应的方向、途径和限速步骤等。
二、酶的抑制作用和抑制作用动力学
(一)、什么是抑制作用(inhibition)?
某些物质使酶活力下降的作用叫抑制作用,这些使酶活力下降的物质,称为抑制剂(Inhibitor,I)
(二)、抑制作用的种类
1、不可逆抑制(irreversibleinhibition):
抑制剂与酶的必需基团以共价键结合,不能用稀释或透析去除抑制剂使得酶活力恢复。
2、可逆抑制作用(reversibleinhibition)及其动力学
(1)竞争性抑制作用(competitiveinhibition)
①定义:
抑制剂与底物竞争酶的活性结合部位
②竞争性抑制作用的特点:
Km增加、Vmax不变
(2)非竞争性抑制作用(noncompetitiveinhibition)
①定义:
I与S同时结合到酶的不同部位上
②特点:
Km不变、Vmax降低
(3)反竞争性抑制作用(uncompetitiveinhibition)
①定义:
只有酶和底物结合之后,抑制剂才与酶和底物的复合物结合。
②特点:
Km降低、Vmax降低
(三)一些重要的抑制剂及其实际意义
①有机磷化合物:
有机磷化合物能抑制某些蛋白酶及酯酶的活力,特别是强烈抑制胆碱酯酶。
②巯基酶抑制剂:
A、烷化剂:
B、有机汞、有机砷化合物
③重金属抑制剂:
Ag+、Cu2+、Hg2+、Pb2+等金属盐能使大多数酶失活。
第五章核酶和抗体酶
一、核酶的发现
1982年Cech等发现四膜虫细胞大核期间26SrRNA前体具有自我剪接功能,并于1986年证明其内含子L-19IVS具有多种催化功能。
1995年Cuenoud等发现有些DNA分子亦具有催化活性。
称之为脱氧核酶。
二、核酶作用的特点
1、化学本质:
RNA
2、底物:
RNA
3、反应特异性(专一性)碱基
4、催化效率低
5、核酶是一种金属依赖酶。
金属离子起以下的作用:
(1)、特异的结构作用,或参与活性部位的化学过程
(2)、促进RNA的总体折叠
(3)、二价金属离子(如Mg2+)与底物活性部位直接相互作用,参与过渡中间复合物的形成
三、核酶的应用
1、核酶抗肝炎病毒的研究
目前人们已进行了核酶抗甲型肝炎病毒(HAV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)以及HDV作用的研究。
人工设计核酶多为锤头状结构,少部分是采用发夹状核酶。
2、抗人类免疫缺陷病毒Ⅰ型(HIV-Ⅰ)。
核酶免疫源性低,很少引起免疫反应。
1998年,美国加利福尼亚大学Wong-Staal等利用发夹核酶抑制HIV-Ⅰ基因表达,并率先进入临床Ⅰ期。
3、抗肿瘤治疗核酶能在特定位点准确有效地识别和切割肿瘤细胞的mRNA,抑制肿瘤基因的表达,达到治疗肿瘤的目的。
4、抑制疾病基因的表达和基因治疗
通过识别特定位点而抑制目标基因的表达,抑制效率高,专一性强。
针对锤头核酶而言,催化结构域小,既可作为转基因表达产物,也可以直接以人工合成的寡核苷酸形式在体内转运。
5、在其他领域的应用
防治动、植物病毒侵害:
马铃薯纺锤形块茎类病毒负链的多价核酶构建,马铃薯卷叶病毒复制酶基因负链的突变核酶的克隆等。
四、核酶技术面临的问题
1、核酶催化切割反应的可逆性问题,定向反应
2、催化效率较低,设法提高催化效率
3、寻找合适载体将核酶高效、特异地导入靶细胞
4、使核酶在细胞内有调控地高效表达
5、增强核酶在细胞内的稳定性
6、对宿主的损伤问题有待进一步考察
五、抗体酶(abzyme)
(一)、抗体酶的定义:
抗体酶或催化抗体(Catalyticantibody)是指具有酶催化活性的抗体。
是一种新型人工酶制剂,是一种具有催化功能的抗体分子,在其可变区赋予了酶的属性。
它是利用现代生物学与化学的理论与技术交叉研究的成果,是抗体的高度选择性和酶的高效催化能力巧妙结合的产物。
抗体:
与抗原特异结合的免疫球蛋白。
抗体酶:
指具有催化功能的抗体分子,在抗体分子的可变区(即肽链的N端)是识别抗原的活性区域,这部分区域被赋予了酶的属性。
(二)、抗体酶的催化特征
1、抗体酶的特点(与天然酶相比):
(1)能催化一些天然酶不能催化的反应
(2)有更强的专一性和稳定性
(3)催化作用机制不同
2、抗体酶和非催化性抗体作用的比较
(1)更高的反应特异性
(2)反应的可逆性
(3)反应的量效性
(4)反应过程
(三)、抗体酶的催化作用机理
1、过渡态理论与抗体酶
2、抗体酶催化的三种重要反应机制
水解作用机制
基团转移
连续反应机制
3、抗体酶催化反应的介质效应
酯解反应中介质效应:
抗体酶在有机溶剂中具稳定性。
脱羧反应中介质效应;有机溶剂引起脱羧反应速率增加。
酰基转移反应中介质效应:
在疏水溶剂中,活性较高。
(四)、抗体酶的制备
1、细胞融合法:
2、抗体结合位点化学修饰法:
对抗体酶进行结构修饰的关键是找到一种温和的方法在抗体结合位置或附近引入具有催化功能的基团。
游离巯基就是适合的基团之一,它具有高亲核性,易于氧化,及能通过二硫化物进行交换反应或亲电反应而选择性修饰的特点。
3、引入辅助因子法:
将此半抗原通过共价键连接在载体蛋白免疫动物产生的抗体,在金属离子复合物作为辅因子的参与下,这些抗体酶能选择性水解甘氨酸和丙氨酸之间的肽键.
4、用生物工程的方法产生抗体:
将编码具有抗体酶活性的Fab片断的基因是通过细菌的形式表达出来的。
5、拷贝法:
用酶作为抗原免疫动物得到抗酶的抗体,再将此抗体免疫动物并进行单克隆化,获得单克隆的抗抗体。
对抗抗体进行筛选,获得具有原来酶活性的抗体酶。
6、共价抗原免疫法:
这是在亲和标记抑制剂基础上发展起来的新的抗体酶制备方法。
以亲和标记剂为半抗原,则抗体结合部位将产生与亲和基团电荷性质相反的基团,如亲核性,亲电性氨基酸,酸性氨基酸,碱性氨基酸等。
第六章酶的分离纯化
一、沉淀分离:
1、沉淀剂的类型
2、使用注意事项
沉淀分离方法
分离原理
盐析沉淀法
利用不同蛋白质在不同的盐浓度条件下溶解度不同的特性,通过在酶液中添加一定浓度的中性盐,使酶或杂质从溶液中析出沉淀,从而使酶与杂质分离
等电点沉淀法
利用两性电解质在等电点时溶解度最低,以及不同的两性电解质有不同的等电点这一特性,通过调节溶液的pH值,使酶或杂质沉淀析出,从而使酶与杂质分离
有机溶剂沉淀法
利用酶与其它杂质在有机溶剂中的溶解度不同,通过添加一定量的某种有机溶剂,使酶或杂质沉淀析出,从而使酶与杂质分离
复合沉淀法
在酶液中加入某些物质,使它与酶形成复合物而沉淀下来,从而使酶与杂质分离
选择性变性沉淀法
选择一定的条件使酶液中存在的某些杂质变性沉淀,而不影响所需的酶,从而使酶与杂质分离
二、层析分离
层析方法
分离依据
吸附层析
利用吸附剂对不同物质的吸附力不同而使混合物中各组分分离
分配层析
利用各组分在两相中的分配系数不同,而使各组分分离
离子交换层析
利用离子交换剂上的可解离基团(活性基团)对各种离子的亲和力不同而达到分离目的
凝胶层析
以各种多孔凝胶为固定相,利用流动相中所含各种组分的相对分子质量不同而达到物质分离
亲和层析
利用生物分子与配基之间所具有的专一而又可逆的亲和力,使生物分子分离纯化
层析聚焦
将酶等两性物质的等电点特性与离子交换层析的特性结合在一起,实现组分分离
(一)离子交换层析
1、如何根据酶的特性选择离子交换介质?
2、如何根据离子交换介质的特性选择缓冲体系?
(二)凝胶层析操作(装柱、洗涤及洗脱)过程中要注意那些问题?
(三)亲和层析的原理及操作要点
第七章固定化酶
一、什么是固定化酶?
通过化学方法将水溶性酶与不溶性载体铰链而形成的不溶性酶称为固定化酶。
与天然酶比较,固定化酶具有可多次重复使用、可以装塔连续反应、纯化简单、能提高产物质量、应用范围广等多种优点。
二.固定化酶的优缺点
优点:
可多次重复使用
可以装塔连续反应
纯化简单
提高产物质量
应用范围广
缺点:
首次投入成本高
大分子底物较困难
三、影响固定化酶性质的因素
1.酶本身的变化:
主要是由于活性中心的氨基酸残基、高级结构和电荷状态等发生了变化。
2.载体的影响
(1)分配效应
(2)空间障碍效应
(3)扩散限制效应
3.固定化方法的影响
四、固定化后酶性质的变化
1.固定化对酶活性的影响:
酶活性下降,反应速度下降。
原因:
酶结构的变化空间位阻
2.固定化对酶稳定性的影响
(1)操作稳定性提高
(2)贮存稳定性比游离酶大多数提高。
(3)对热稳定性,大多数升高,有些反而降低。
(4)对分解酶的稳定性提高。
(5)对变性剂的耐受力升高
固定化后酶稳定性提高的原因:
a.固定化后酶分子与载体多点连接。
b.酶活力的释放是缓慢的。
c.抑制自降解,提高了酶稳定性。
3、米氏常数Km的变化,Km值随载体性质变化
(1)载体与底物带相同电荷,Km’>Km固定化酶降低了酶的亲和力。
(2)载体与底物电荷相反,静电作用,Km'五、固定化酶的制备
(一)、各类固定化方法的特点比较:
比较项目
吸附法
结合法
交联法
包埋法
物理吸附
.共价键结合
离子键结合
制备难易
易
难
易
较难
较难
固定化程度
弱
强
中等
强
强
活力回收率
较高
低
高
中等
高
载体再生
可能
不可能
可能
不可能
不可能
费用
低
高
低
中等
低
底物专一性
不变
可变
不变
可变
不变
适用性
酶源多
较广
广泛
较广
小分子底物、药用酶
(二)选择方法依据:
(1)酶的性质
(2)载体的性质
(3)制备方法的选择
(三)选择载体的原则
(1)要有巨大的比表面积
(2)要有活泼的表面
(3)便于装柱进行连续反应
(四)载体活化的方法
A.重氮法
B.叠氮法
C.烷基化反应法
D.硅烷化法
E.溴化氰法
(五)、固定化后酶的考察项目:
(1)测定固定化酶的活力,以确定固定化过程的活力回收率。
(2)考察固定化酶稳定性
(2)考察固定化酶最适反应条件
第八章化学酶工程
第一节酶分子的化学修饰
一、酶化学修饰的定义
用化学试剂对酶的侧链基团进行共价改造,从而赋予酶分子以特殊功能和提高酶的活力的方法,称为酶的化学修饰。
二.酶的化学修饰原因
1.稳定性不够,不能适应大量生产的需要。
2.作用的最适条件不符。
3.酶的主要动力学性质的不适应。
4.临床应用的特殊要求。
三、酶化学修饰的目的
1、改变活性部位的构象。
酶蛋白的主链经蛋白酶的水解作用,去掉部分肽段或者取代蛋白质一级结构上某些氨基酸残基,使活性部位的结构发生改变,以达到人们所需要的各种目的。
2、提高生物活性。
酶分子侧链基团的化学转变,改变基团的电化学性质、分子内基团的相互作用力等,某些情况下能提高酶的生物活性。
3、增强酶的稳定性。
一般酶反应条件基本接近中性,但在工业应用上,由于生产条件、底物等带来的影响,作用的pH常常不在中性;生产温度的提高,酶往往易变性失活。
这些都直接影响酶作用的发挥。
用双功能试剂让酶分子基团之间、内部侧链基团之间进行交联,可以达到提高酶的稳定性的目的。
4、降低酶类药物的抗原性。
酶是蛋白质,作为药物使用时,这些异源蛋白进入人体后可能成为抗原,诱导相应的抗体产生,这些酶类药物就会通过抗原抗体反应被清除掉,从而不能发挥药效,有的甚至还会产生过敏反应。
通过对酶的化学修饰,可以降低酶类药物的抗原性。
5、改变酶学性质。
利用有机小分子或大分子物质对活性部位或活性部位之外的侧链基团进行化学修饰,达到改变酶学性质的目的。
四、酶化学修饰的基本原理
1.如何增强酶天然构象的稳定性与耐热性
2.如何保护酶活性部位与抗抑制剂
3.如何维持酶功能结构的完整性与抗蛋白水解酶
4.如何消除酶的抗原性及稳定酶的微环境
因此,在酶的化学修饰过程中需要注意以下几个方面:
(1)、充分了解被修饰酶。
开始设计酶化学修饰反应时,对被修饰酶的活性部位、稳定条件、侧链基团性质及酶反应的最适条件等应尽可能全面了解。
(2)、修饰剂的选择
选择修饰剂时要求修饰剂具有较大的相对分子质量,对蛋白质的吸附有良好的生物相容性和水溶性,修饰剂分子表面有较多的活性基团,还要考虑修饰剂上的反应基团的活化方式和活化条件,以及修饰后酶活性的半衰期。
(3)修饰反应条件的选择
修饰反应一般要选择在酶稳定的条件下进行,尽可能少破坏酶的必需基团,选择酶与修饰剂的结合率和酶活回收率都较高的反应条件。
对反应体系中酶与修饰剂的分子比例、反应温度、pH、时间、溶剂性质和离子强度等在确定反应条件时也必须考虑。
五、酶修饰方法
(一)、酶分子侧链基团的化学修饰
(二)、酶分子表面的化学修饰
(三)、蛋白质类及其他对酶的化学修饰。
六、修饰酶的性质及特点
1.热稳定性提高
修饰剂与酶多点交联,固定了酶的分子构象,增强酶天然构象的稳定性减少了酶热失活,增强了酶的热稳定性。
2.抗原性降低
当酶被修饰以后,酶分子表面上许多抗原决定簇在反应过程中被修饰剂结合,在空间结构上使这些抗原决定簇被屏蔽,从而降低了酶分子的抗原性或抗原抗体的结合能力。
3.体内半衰期延长
经过化学修饰后,由于增强了抗蛋白水解酶、抗抑制剂和抗失活因子的能力以及对热稳定性的提高,所以其半衰期都比天然酶长。
4.最适pH变化
修饰酶的微环境更为稳定。
5.酶的动力学性质的改变
A、米氏常数Km增大:
交联于酶上的大分子修饰剂造成空间障碍,影响了底物对酶的接近和结合,使米氏常数Km增大。
B、修饰酶抵抗各种失活因子的能力增强。
C、体内半衰期的延长
6.对组织的分布能力变化
第二节模拟酶
一.模拟酶概述
(一)、模拟酶的概念:
用合成高分子来模拟酶的结构、特性、作用原理以及酶在生物体内的化学反应过程,它研究吸收酶中起主导作用的因素,利用有机化学、生物化学等方法设计和合成一些较天然酶简单的非蛋白质分子或蛋白质分子,以这些分子作为模型来模拟酶对其作用底物的结合和催化过程,也就是说,模拟酶是在分子水平上模拟酶活性部位的形状、大小及其微环境等结构特征,以及酶的作用机理和立体化学等特性。
模拟酶又称人工酶或酶模型,它是生物有机化学的一个分支。
(二)、模拟酶的研究目的:
研究模拟酶主要是为了解决酶容易受多种物理、化学因素的影响而失活,所以不能用酶广泛取代工业催化剂等缺点。
二、模拟酶的理论基础和策略
(一)酶学基础
酶的催化机制:
Pauling的稳定过渡态理论
(二)超分子化学基础
主-客体化学:
主体和客体