全国高考化学铁及其化合物的综合高考真题分类汇总含答案解析.docx
《全国高考化学铁及其化合物的综合高考真题分类汇总含答案解析.docx》由会员分享,可在线阅读,更多相关《全国高考化学铁及其化合物的综合高考真题分类汇总含答案解析.docx(18页珍藏版)》请在冰豆网上搜索。
全国高考化学铁及其化合物的综合高考真题分类汇总含答案解析
全国高考化学铁及其化合物的综合高考真题分类汇总含答案解析
一、高中化学铁及其化合物
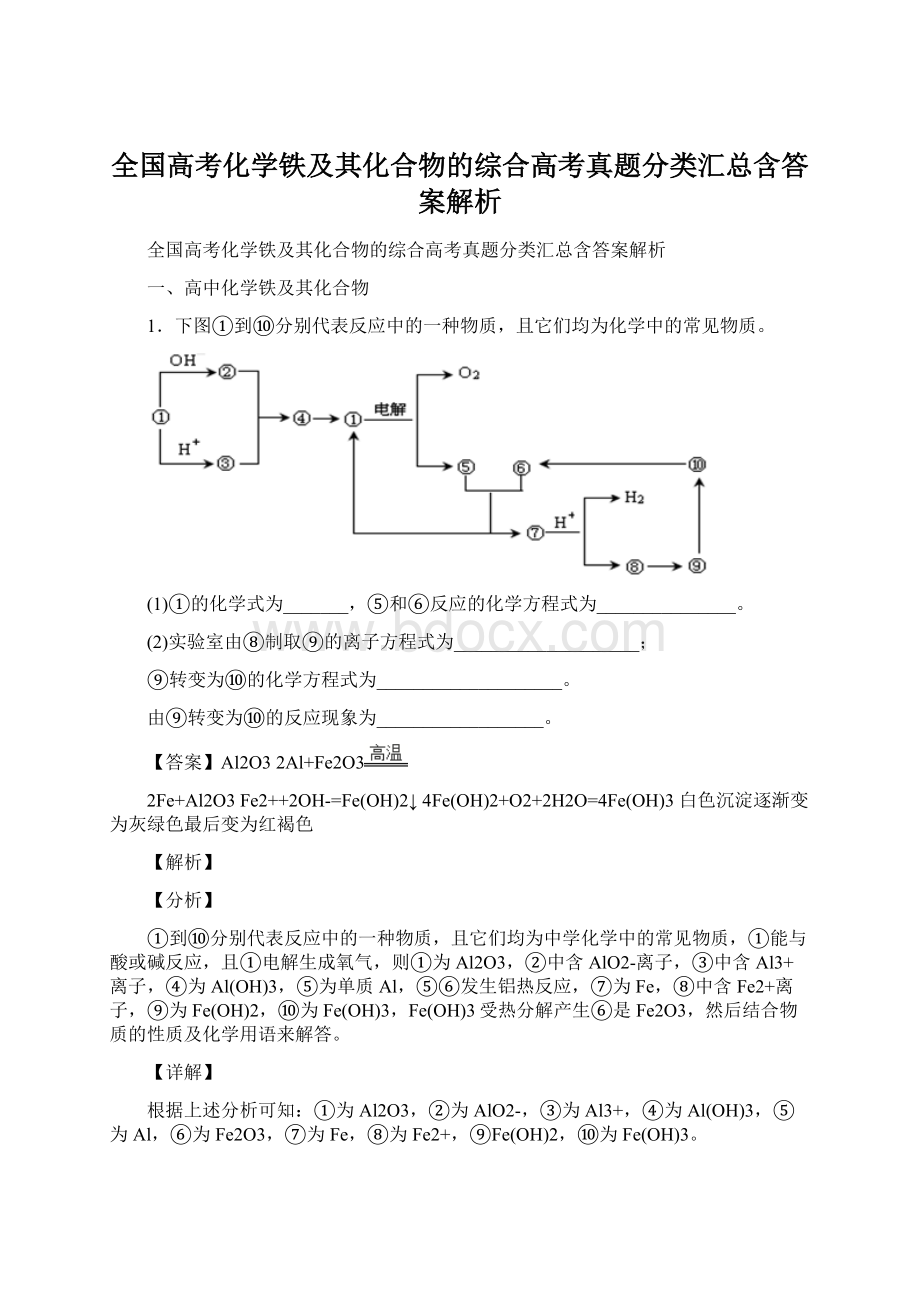
1.下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质。
(1)①的化学式为_______,⑤和⑥反应的化学方程式为_______________。
(2)实验室由⑧制取⑨的离子方程式为____________________;
⑨转变为⑩的化学方程式为____________________。
由⑨转变为⑩的反应现象为__________________。
【答案】Al2O32Al+Fe2O3
2Fe+Al2O3Fe2++2OH-=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)3白色沉淀逐渐变为灰绿色最后变为红褐色
【解析】
【分析】
①到⑩分别代表反应中的一种物质,且它们均为中学化学中的常见物质,①能与酸或碱反应,且①电解生成氧气,则①为Al2O3,②中含AlO2-离子,③中含Al3+离子,④为Al(OH)3,⑤为单质Al,⑤⑥发生铝热反应,⑦为Fe,⑧中含Fe2+离子,⑨为Fe(OH)2,⑩为Fe(OH)3,Fe(OH)3受热分解产生⑥是Fe2O3,然后结合物质的性质及化学用语来解答。
【详解】
根据上述分析可知:
①为Al2O3,②为AlO2-,③为Al3+,④为Al(OH)3,⑤为Al,⑥为Fe2O3,⑦为Fe,⑧为Fe2+,⑨Fe(OH)2,⑩为Fe(OH)3。
(1)由上述分析可知,①为Al2O3,⑤和⑥反应的化学方程式为2Al+Fe2O3
Al2O3+2Fe;
(2)实验室由Fe2+变为Fe(OH)2的操作方法是向其中加入NaOH溶液,因此由⑧制取⑨发生的离子反应为Fe2++2OH-=Fe(OH)2↓;由于Fe(OH)2不稳定,容易被溶解在其中的氧气氧化变为Fe(OH)3,则由⑨转变为⑩的离子方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,由⑨转变为⑩的反应现象为白色沉淀会逐渐由白色变为灰绿色,最后变为红褐色。
2.排放的工业废水中含Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑制得Fe2O3、Al2O3和金属Cu,过程如下。
请回答:
(1)固体A的成分是________________(填化学式)。
(2)溶液B中的金属阳离子有___________________。
(3)试剂G是__________________(填名称)。
(4)B→D反应的离子方程式是_________________________。
(5)溶液E焰色反应呈黄色,试剂H是__________________。
【答案】Fe、CuFe2+、Al3+稀盐酸或稀硫酸2Fe2++Cl2=2Fe3++2Cl—NaOH溶液
【解析】
【分析】
【详解】
(1)向含Fe3+、Al3+、Cu2+的工业废水中加入过量的废铁屑,发生反应2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,而铁屑是过量的,因此固体A的成分是Fe和Cu;
(2)溶液B中的金属阳离子有反应产生的Fe2+和废水中原有的Al3+;
(3)向Fe和Cu的混合物中加入过量的试剂G能产生溶液B和固体C,则试剂G为稀盐酸或稀硫酸,而固体C为不溶于稀盐酸或稀硫酸的Cu;
(4)向溶液B中加入足量的氯水,Fe2+被Cl2氧化成Fe3+,而Al3+不反应,因此离子方程式为2Fe2++Cl2=2Fe3++2Cl—;
(5)溶液D的成分是Fe3+和Al3+,向其中加入过量的H溶液生成沉淀F和溶液E,且沉淀F经过灼烧生成铁红,则F为Fe(OH)3;溶液E的焰色反应呈黄色,说明含有钠元素,且一定条件下能得到Al2O3,说明含有铝元素,则E为Na[Al(OH)4];经过以上分析,可知H为NaOH溶液。
3.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示
图中有些反应的生成物和反应的条件没有标出
。
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:
B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】AlHCl杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色4Fe(OH)2+O2+2H2O=4Fe(OH)32Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
【分析】
金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】
根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;
(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;
(3)FeCl2与NaOH溶液发生反应:
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;
(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑。
【点睛】
本题是无机物推断,物质的颜色及转化关系中特殊反应是物质推断的突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,试题培养了学生的分析能力及逻辑推理能力。
4.A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:
其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
(2)如何检验上述C溶液中的阳离子?
______________________。
(3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。
C的化学式是____________,属于置换反应____________,(填序号)写出反应①的化学方程式____________________。
【答案】Fe+2Fe3+=3Fe2+取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+SiCl4①③2C+SiO2
Si+2CO↑
【解析】
【分析】
(1)由转化关系可知A为变价金属,则A应为Fe,B为氯化铁,C为氯化亚铁,②为Fe与氯化铁的反应;
(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,③中SiCl4与氢气反应,提纯Si,以此解答该题。
【详解】
(1)A是常见的金属,①③中均有同一种气态非金属单质参与反应,且②为化合反应,则该非金属气体为Cl2,B为氯化铁,则反应②的离子方程式为2Fe3++Fe=3Fe2+;
(2)由分析知C为氯化亚铁,检验Fe2+的操作方法是取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+;
(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,其中②为Si和Cl2化合生成SiCl4,③中SiCl4与氢气反应,提纯Si,则反应①的化学方程式为SiO2+2C
Si+2CO↑,其中属于置换反应的有①③。
5.某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。
工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。
回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:
__________、______。
(3)得到FeSO4•7H2O晶体的操作Ⅲ为:
加热浓缩、冷却结晶、______、______、干燥。
【答案】FeH2SO4Fe+2Fe3+=3Fe2+Fe+Cu2+=Fe2++Cu过滤洗涤
【解析】
【分析】
工业废水中含大量Fe2+、Fe3+、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,要加入铁粉,可置换出铜,同时生成硫酸亚铁,经过滤,得到的滤液C中主要含硫酸亚铁,滤渣B中含Cu、Fe,向该固体混合物中加入D为H2SO4,得到的溶液F为硫酸亚铁,得到滤渣E为Cu,将溶液C、F合并就是FeSO4溶液,溶液经蒸发、浓缩、冷却结晶、过滤,洗涤、干燥就可得到FeSO4·7H2O晶体,以此来解答。
【详解】
(1)加入铁粉,由于金属活动性Fe>Cu,可发生置换反应,置换出铜,反应的离子方程式为Fe+Cu2+=Fe2++Cu,铁、铜的混合物中加入稀硫酸,铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,所以A的化学式为Fe,D的化学式为H2SO4;
(2)由于离子的氧化性Fe3+>Cu2+>Fe2+>Na+,所以向工业废水中加入过量A时,首先发生反应Fe+2Fe3+=3Fe2+,然后发生反应Fe+Cu2+=Fe2++Cu;
(3)FeSO4的溶解度受温度的影响变化较大,所以从FeSO4的溶液中获得晶体经过加热,通过蒸发浓缩、冷却结晶,然后过滤、洗涤,最后干燥,就得到了FeSO4•7H2O晶体。
【点睛】
本题以废水处理流程为线索,考查了混合物的分离、提纯的操作过程、试剂的选用及离子方程式书写等,把握流程中发生的化学反应及分离方法为解答的关键,注重基础知识的考查。
6.A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。
试推断:
(1)A:
__、B:
__、C:
__、D:
__、E:
__;
(2)固体C加热得到A的化学反应方程式__;
(3)得到红褐色沉淀E的化学反应方程式__。
【答案】Na2CO3KOHNaHCO3NaClFe(OH)32NaHCO3=Na2CO3+H2O+CO2↑4Fe(OH)2+2H2O+O2=4Fe(OH)3
【解析】
【分析】
A、C、D为盐且焰色反应均为黄色,说明都含有钠元素的化合物;B是碱且透过钴玻璃观察焰色反应为紫色,判断为含K元素,A、C和盐酸反应均得到D的溶液,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,可以判断,无色无味的气体是CO2,A为Na2CO3,C为NaHCO3,D为NaCl;若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E,说明B为氢氧化钾,E为氢氧化铁,据此分析解答。
【详解】
A、C、D为盐且焰色反应均为黄色,说明都含有钠元素的化合物;B是碱且透过钴玻璃观察焰色反应为紫色,判断为含K元素,A、C和盐酸反应均得到D的溶液,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,可以判断,无色无味的气体是CO2,A为Na2CO3,C为NaHCO3,D为NaCl,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E,说明B为氢氧化钾,综上所述:
A:
Na2CO3、B:
KOH、C:
NaHCO3 D:
NaCl、E:
Fe(OH)3;
(1)有分析可知:
A:
Na2CO3、B:
KOH、C:
NaHCO3 D:
NaCl、E:
Fe(OH)3;
(2)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水的化学方程式为2NaHCO3=Na2CO3+H2O+CO2↑;
(3)氢氧化亚铁具有还原性,能够与氧气、水反应生成氢氧化铁,方程式:
4Fe(OH)2+O2+2H2O=4Fe(OH)3。
7.中学化学常见物质A、B、C、D、E有如下转化(已知A、B、C、D、E均含有同一元素):
请写出:
(1)B→C+D的离子方程_______________________;
(2)E→F化学方程式__________________________。
(3)若A→B过程的反应不是化合反应,该反应可能的化学方程式___________________。
(4)D通过化合反应转化为C的离子方程式为____________________________________。
【答案】
【解析】
【分析】
由F是红褐色物质,可知F是Fe(OH)3;E能氧化为Fe(OH)3,E是Fe(OH)2;逆推可知C含有Fe2+、D含有Fe3+,则A是Fe;B中的铁元素有+2、+3两种,B是Fe3O4。
【详解】
根据以上分析,
(1)Fe3O4与盐酸反应生成氯化亚铁和氯化铁,反应的离子方程
;
(2)氢氧化亚铁和氧气反应生成氢氧化铁,反应化学方程式为
;
(3)若Fe→Fe3O4过程的反应不是化合反应,则为铁和水蒸气高温条件下生成四氧化三铁和氢气,反应可能的化学方程式为
;
(4)Fe3+和Fe通过化合反应生成Fe2+,反应的离子方程式为
。
8.已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。
请回答下列问题。
(1)写出下列各物质的化学式:
X______、Y______、A______、B______、C______。
(2)反应①的离子方程式为____________。
【答案】Cl2SO2HClH2SO4FeCl32Fe3++SO2+2H2O=2Fe2++SO42-+4H+
【解析】
【分析】
A与硝酸酸化的AgNO3溶液反应产生白色沉淀,A中含Cl-;B与盐酸酸化的BaCl2溶液反应产生白色沉淀,B中含SO42-;又根据X、Y均为有刺激性气味的气体,且X能与
反应,则X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3。
【详解】
(1)分析可知,X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3。
(2)反应①为氯化铁与二氧化硫发生氧化还原反应,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
9.某
的溶液X,其中可能含有
、
、
、
、
、
、
、
、
中的一种或几种,取200mL该溶液进行实验,其现象及转化如图.
已知:
反应过程中有一种气体是红棕色.
请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有________.
(2)溶液X中,关于
的判断一定正确的是________(填字母).
a.一定有b.一定没有c.可能有
(3)①中产生气体A的离子方程式为_____________________________________________________.
(4)⑦中生成沉淀K的离子方程式为_____________________________________________________.
(5)溶液X中不能确定的离子是_____________________用实验证明该离子一定不存在的化学方法为______________________________________________________________________________________.
(6)若实验测定A.F.K均为
l,试确定沉淀C及其物质的量范围:
_________.
【答案】
、
b
取少量溶液X于试管中,加入几滴KSCN溶液,溶液不变红色,说明无
(其他答案合理也可)沉淀为
【解析】
【详解】
由反应①加入的Ba(NO3)2溶液及pH=1,结合溶液中可能含有的离子等信息可判断气体A为NO,气体D为NO2,溶液E为HNO3,因此溶液中含有还原性的离子,即含有Fe2+;由反应④加入过量NaOH溶液及溶液中可能存在的离子判断气体F为NH3,溶液I为NH4NO3,溶液中含有NH4+;pH=1的溶液中不可能含有CO32-、SiO32-,故沉淀C为BaSO4;根据图示关系及可能存在的离子可知沉淀G为Fe(OH)3,溶液J为FeCl3;沉淀K为Al(OH)3。
(1)由强酸性条件即可判断溶液X中一定不存在弱酸根离子,所以不存在的离子有CO32-、SiO32-;
(2)强酸性溶液中硝酸根离子具有强氧化性,如果存在硝酸根离子,则不存在亚铁离子,加入硝酸钡溶液时不能产生气体,所以溶液X中一定没有NO3-,
答案选b;
(3)亚铁离子和硝酸反应生成铁离子、一氧化氮和水,离子反应方程式为:
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)⑦中生成沉淀K为Al(OH)3,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)生成Fe(OH)3的Fe3+可能来自于Fe2+被硝酸氧化,也可能是原来溶液中就存在Fe3+,故不能确定溶液X中是否存在Fe3+,可用KSCN溶液检验溶液X中是否存在Fe3+;
(6)NO、NH3、Al(OH)3各为0.01mol,则说明溶液X中有0.03molFe2+、0.01molNH4+、0.01molAl3+。
若溶液X中不存在Fe3+,由上述推断可知溶液中一定存在Al3+、NH4+、Fe2+、SO42-,由溶液中的电荷守恒可知3n(Al3+)+n(NH4+)+2n(Fe2+)+n(H+)=2n(SO42-),故n(SO42-)=
(0.03mol+0.01mol+0.06mol+0.02mol)=0.06mol,若溶液中含有Fe3+,则n(SO42-)>0.06mol。
10.A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,组成单质A的元素有可变化合价。
它们之间存在如下图所示的转化关系。
由此推断:
(1)甲的化学式为________________,丙的化学式为________________。
(2)写出甲和D反应的化学方程式:
_________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有________(填字母)。
A.稀硫酸B.盐酸
C.硫氰化钾溶液D.高锰酸钾溶液
【答案】Fe3O4Al2O33Fe3O4+8Al
9Fe+4Al2O3ACD
【解析】
【分析】
A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,乙是H2O,组成单质A的元素有可变化合价,且高温条件下与H2O反应,则A是Fe,甲是Fe3O4,C是H2,B是O2,Fe3O4与D反应生成Fe,此反应为铝热反应,则D是Al,丙是Al2O3。
【详解】
(1)乙在常温常压下为无色无味的液体,乙是H2O,组成单质A的元素有可变化合价,且高温条件下与H2O反应,则A是Fe,甲是Fe3O4,Fe3O4与D反应生成Fe,此反应为铝热反应,则D是Al,丙是Al2O3,故甲的化学式为Fe3O4,丙的化学式为Al2O3。
(2)甲是Fe3O4,D是Al,其化学反应方程式为:
3Fe3O4+8Al
9Fe+4Al2O3
(3)甲是Fe3O4,要检验其中所含有的阳离子,要先用稀硫酸使其发生反应:
Fe3O4+8H+=2Fe3++Fe2++4H2O,然后再用高锰酸钾溶液检验Fe2+,用硫氰化钾溶液检验Fe3+,故使用的物质是A、C、D。
11.如图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。
它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的名称或化学式:
F______,H_____。
(2)若反应①是在加热条件下进行,则A是___;若反应①是在常温条件下进行,则A是___。
(3)写出B与MnO2共热获得D的化学方程式______。
(4)写出D与E共热获得H的化学方程式________。
(5)如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
2min内,A物质的平均反应速率为______。
【答案】四氧化三铁氯化铁氯酸钾过氧化氢MnO2+4HCl(浓)
MnCl2+C12↑+2H2O2Fe+3C12=2FeC130.4mol/(L·min)
【解析】
【分析】
C为O2,若反应①是在加热条件下进行,则A是氯酸钾,若反应①是在常温条件下进行,则A是过氧化氢。
D为C12,则B为浓盐酸,氯气与铁加热反应生成氯化铁,则H为氯化铁。
铁在氧气中燃烧生成四氧化三铁,则F为四氧化三铁,四氧化三铁与盐酸反应生成氯化铁和氯化亚铁,则G为氯化亚铁。
【详解】
(1)有分析可知,F为四氧化三铁,H为氯化铁;
(2)反应①是在二氧化锰作催化剂条件下制取氧气,若反应①是在加热条件下进行,则A是氯酸钾。
若反应①是在常温条件下进行,则A是过氧化氢;
(3)B为浓盐酸,浓盐酸与MnO2共热生成氯气、氯化锰和水,化学方程式为MnO2+4HCl(浓)
MnCl2+C12↑+2H2O;
(4)D为C12,E为Fe单质,氯气与铁共热生成氯化铁,化学方程式为2Fe+3C12=2FeC13;
(5)2min内,A的物质的量浓度变化量=(2.0-1.2)mol/L=0.8mol/L,则A物质的平均反应速率=
=0.4mol/(L·min)。
12.A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。
在一定条件下相互转化关系如下图所示(部分产物已略去)。
请按要求回答下列问题:
(1)若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成一种强酸,则B
转化为C的化学方程式是_______________________;
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式是_____________;
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是___________________符合条件的D物质可能是___________(填序号)。
①硫酸②醋酸③氢氧化钠④一水合氨⑤氯化钡
【答案】
(1)2SO2+O2
2SO3;
(2)FeCl3;(3)6H2O+Al3++3AlO2-=4Al(OH)3↓。
【解析】
试题分析:
(1)若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成