完整版高中化学电解池习题.docx
《完整版高中化学电解池习题.docx》由会员分享,可在线阅读,更多相关《完整版高中化学电解池习题.docx(15页珍藏版)》请在冰豆网上搜索。
完整版高中化学电解池习题
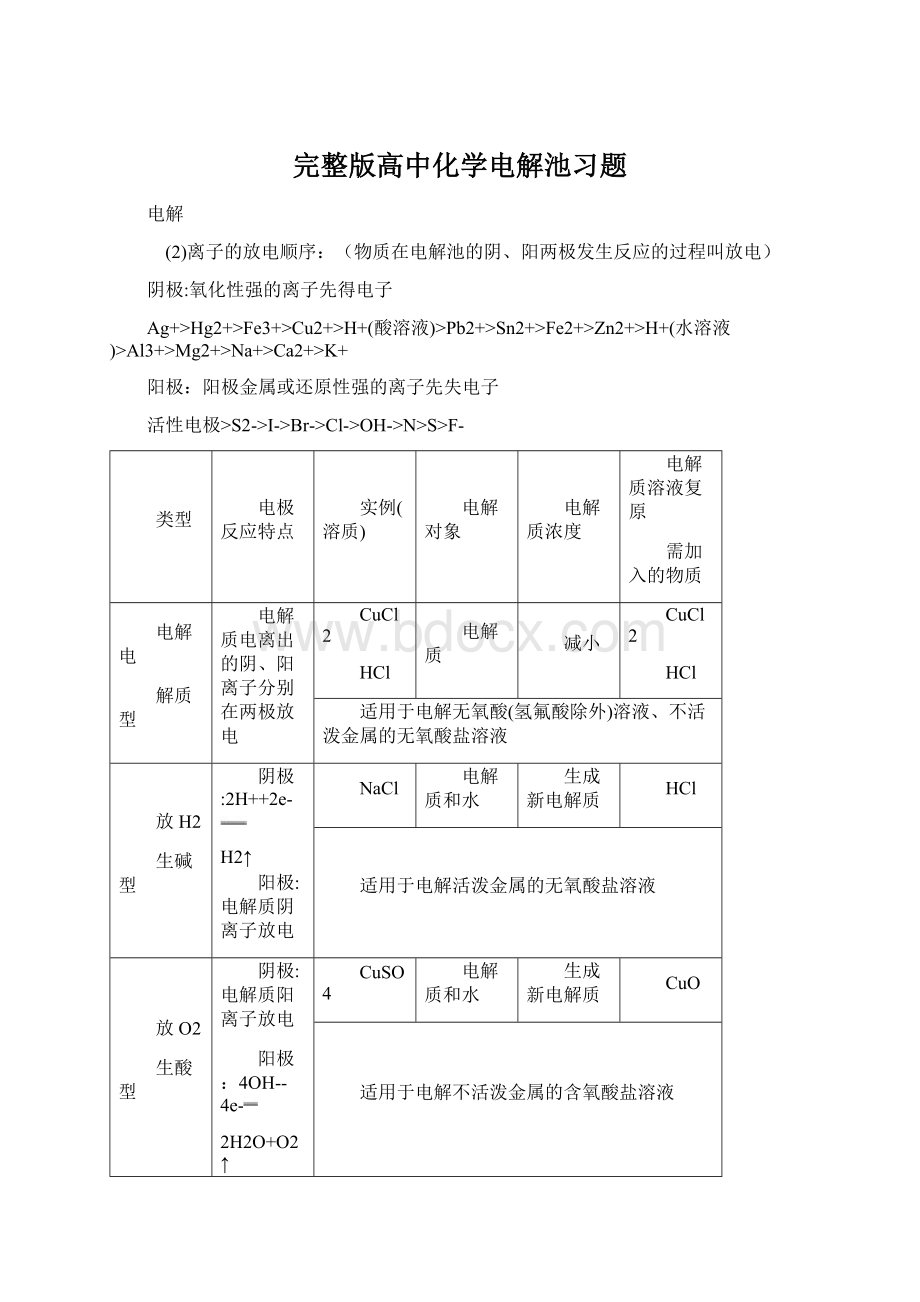
电解
(2)离子的放电顺序:
(物质在电解池的阴、阳两极发生反应的过程叫放电)
阴极:
氧化性强的离子先得电子
Ag+>Hg2+>Fe3+>Cu2+>H+(酸溶液)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水溶液)>Al3+>Mg2+>Na+>Ca2+>K+
阳极:
阳极金属或还原性强的离子先失电子
活性电极>S2->I->Br->Cl->OH->N>S>F-
类型
电极反应特点
实例(溶质)
电解对象
电解质浓度
电解质溶液复原
需加入的物质
电解电
解质型
电解质电离出的阴、阳离子分别在两极放电
CuCl2
HCl
电解质
减小
CuCl2
HCl
适用于电解无氧酸(氢氟酸除外)溶液、不活泼金属的无氧酸盐溶液
放H2
生碱型
阴极:
2H++2e-
H2↑
阳极:
电解质阴离子放电
NaCl
电解质和水
生成新电解质
HCl
适用于电解活泼金属的无氧酸盐溶液
放O2
生酸型
阴极:
电解质阳离子放电
阳极:
4OH--4e-
2H2O+O2↑
CuSO4
电解质和水
生成新电解质
CuO
适用于电解不活泼金属的含氧酸盐溶液
电解
水型
阴极:
4H++4e-
2H2↑
阳极:
4OH--4e-
2H2O+O2↑
NaOH
H2SO4
Na2SO4
水
增大
H2O
适用于电解含氧酸溶液、可溶性强碱溶液、活泼金属的含氧酸盐溶液
1.关于原电池、电解池的电极名称,下列说法错误的是( )
A.原电池中失去电子的一极为负极
B.电解池中与直流电源负极相连的一极为阴极
C.原电池中相对活泼的一极为正极D.电解池中发生氧化反应的一极为阳极
2.若某装置发生反应:
Cu+2H+
Cu2++H2↑,关于该装置的有关说法正确的是( )
A.该装置一定为原电池B.该装置为电解池
C.若为原电池,Cu为正极D.电解质溶液可能是稀硝酸
3.有关以下甲、乙、丙、丁四个图示的叙述正确的是( )
A.甲中负极反应式为2H++2e-
H2↑B.乙中阳极反应式为Ag++e-
Ag
C.丙中H+向石墨棒方向移动D.丁中电解开始时阳极产生黄绿色气体
4.下面列出了电解不同物质时发生的电极反应,其中错误的是( )
A.电解饱和食盐水,阴极:
Na++e-
Na
B.电解CuSO4溶液,阴极:
Cu2++2e-
Cu
C.电解熔融NaCl,阴极:
Na++e-
Na
D.电解NaOH溶液,阳极:
4OH--4e-
2H2O+O2↑
6.Cu2O是一种半导体材料,右图是基于绿色化学理念设计的制取Cu2O的电解池示意图,电解总反应为2Cu+H2O
Cu2O+H2↑。
下列说法正确的是( )
A.石墨电极上产生氢气B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成
7.下图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色、无味气体放出。
符合这一情况的是( )
a
b
X
溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
1.下列叙述中错误的是( )
A.电解池是电能转化为化学能的装置
B.原电池跟电解池连接后,电子从原电池负极流向电解池阳极
C.电镀时,电镀池里的阳极材料发生氧化反应
D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
2.用铂电极分别电解KCl溶液和K2SO4溶液时,都会出现的现象或实验结果是( )
A.溶液中K+离子浓度都不变
B.溶液的pH都不变
C.阳极上都生成能使湿润的碘化钾淀粉试纸变成蓝色的无色气体
D.阴极上都生成可燃性气体
3某同学为了使反应2HCl+2Ag===2AgCl↓+H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
5.()用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
组号
X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
CuSO4
CuSO4溶液
C
C
C
H2SO4
H2O
D
Ag
Fe
AgNO3
AgNO3晶体
8.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图所示,电解总反应为:
2Cu+H2O
Cu2O+H2↑。
下列说法正确的是( )
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成
11.如图装置闭合电键时,电流表A的指针将发生偏转。
试回答下列问题。
(1)A池是________,Zn的电极名称是________;
B池是________,Pt的电极名称是________(填电解池、原电池、阴、阳、正、负极等)。
(2)写出下列有关反应:
Cu极上电极反应:
________________________________________________________________________;
C极上电极反应:
________________________________________________________________________。
(3)B池中的总反应的化学方程式为________________________________________________________________________
________________________________。
12.电解原理在化学工业中有广泛的应用。
如图表示一个电解池。
装有电解液c;A、B分别是两
块电极板,通过导线与直流电源相连。
(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,试判断:
①a是________极(填“正”或“负”),B是________极(填“阴”或“阳”);
②A电极上的电极反应式为________________________________________________________________________,
B电极上的电极反应式为________________________________________________________________________;
③检验A电极产物的方法是________________________________________________________________________
________________________________________________________________________。
(2)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则:
①A电极的材料是________,电极反应式为________________________________________________________________________
________________________________________________________________________;
②B电极的材料是________,电极反应式为________________________________________________________________________
________________________________________________________________________。
一.选择题(共12小题)
1.金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:
氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:
Ni2++2e﹣═Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
2.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
A.a为负极,b为正极
B.d为阳极,c为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
3.某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
4.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应:
2Cu+H2O
Cu2O+H2↑.下列说法正确的是( )
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成
5.如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象中正确的是( )
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
6.关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
7.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH.则电解过程中转移的电子数为( )
A.0.1molB.0.2molC.0.3molD.0.4mol
8.用石墨电极电解100mLH2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.1mol•L﹣1B.2mol•L﹣1C.3mol•L﹣1D.4mol•L﹣1
9.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
A.CuCl2[CuSO4]B.NaOH[NaOH]C.NaCl[HCl]D.CuSO4[Cu(OH)2]
10.下列过程需要通电才能进行的是( )
①电离②电解③电镀④电泳⑤电化腐蚀.
A.①②③B.②④⑤C.②③④D.全部
11.下列各组中,每种电解质溶液在惰性电极条件下电解时只生成氢气和氧气的是( )
A.HCl、CuCl2、Ba(OH)2B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2D.NaBr、H2SO4、Ba(OH)2
12.若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上
②将银片接在电源的正极上
③在铜片上发生的反应是:
Ag++e﹣→Ag
④在银片上发生的反应是:
4OH﹣﹣4e﹣→O2↑+2H2O
⑤需用硫酸铜溶液为电镀液
⑥需用硝酸银溶液为电镀液.
A.①③⑥B.②③⑥C.①④⑤D.②③④⑥
二.填空题(共13小题)
13.如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:
6.8~8.0,酸色﹣红色,碱色﹣黄色).
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是 (填编号);
①A管溶液由红变黄; ②B管溶液由红变黄;
③A管溶液不变色; ④B管溶液不变色;
(2)写出A管中发生反应的反应式:
;
(3)写出B管中发生反应的反应式:
;
(4)检验a管中气体的方法是 ;
(5)检验b管中气体的方法是 ;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是 .
14.如图为以惰性电极进行电解:
(1)写出B、C、D各电极上的电极反应式和总反应方程式:
A:
,
B:
,
总反应方程式:
;
C:
,
D:
,
总反应方程式:
;
(2)在A、B、C、D各电极上析出生成物的物质的量比为 .
15.电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是 .在X极附近观察到的是 .
②Y电极上的电极反应式是 ,检验该电极反应产物的方法是 .
(2)如要用电解方法实现将铁片镀上一层金属铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ②Y电极反应式是 .
③已知开始时铁片与铜片的质量相同,当电路中有0.4摩尔电子通过时,两极质量相差 克.
16.碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一.工业上可从电解精炼铜的阳极泥中提取碲.
(1)粗铜中含有Cu和少量Zn、Ag、Au、TeO2及其他化合物,电解精炼后,阳极泥中主要含有TeO2、少量金属单质及其他化合物.电解精炼粗铜时,阳极电极反应式为 .
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱.从上述阳极泥中提取碲的一种工艺流程如下:
①“碱浸”时TeO2发生反应的化学方程式为 .
②“沉碲”时控制溶液的pH为4.5﹣5.0,生成TeO2沉淀.如果H2SO4过量,溶液酸度过大,将导致碲的沉淀不完全,原因是 ;防止局部酸度过大的操作方法是 .
③“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是 .
17.某原电池构造如图所示.其电池的总反应是:
Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s).请回答以下问题:
(1)若盐桥为琼脂﹣KOH组成,其作用是 .OH﹣离子移向 (填“A”或“B”)中的溶液.Cu为原电池的 极,其电极反应式是 .A中的电解质溶液在该电池工作一段时间后会出现 的现象.
(2)把盐桥改为铁棒后,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 (填“原电池”或“电解池”),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)(提示:
当两个原电池串联时,电极材料的金属活动性相差较大的为原电池,电极材料的金属活动性相差较小的为电解池).
(3)把盐桥改为铜棒后,电流计的指针 (填“会”、“不会”)发生偏转,左边烧杯中的硝酸铜浓度 (填“增大”、“减小”或“不变”)
(4)把盐桥改为银棒后,电流计的指针 (填“会”、“不会”)发生偏转,理由是 .
19.右图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
已知:
铅蓄电池在放电时发生下列电极反应
负极:
Pb+SO
﹣2e﹣=PbSO4
正极:
PbO2+4H++SO
+2e﹣=PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式 ;
(2)若在电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色,说明蓄电池的A极为 极
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g/cm3)时:
①若收集到11.2L(标准状况下)氯气,则至少转移电子 mol.
②若蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为 L.
③若消耗硫酸amol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出) (用含a的代数式表达).
20.从NO
、SO
、H+、Cu2+、Ba2+、Ag+、Cl﹣等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解.
(1)两极分别放出H2和O2时,电解质的化学式可能是 .
(2)若阴极析出金属,阳极放出O2时,电解质的化学式可能是 .
(3)两极分别放出气体,且体积比为1:
1,电解质的化学式可能是 .
21.((Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
(1)甲装置的名称是 (填“原电池”或“电解池”).
(2)写出电极反应式:
Pt极 ;当甲中产生0.1mol气体时,乙中析出铜的质量应为 ;
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色 (填“变深”、“变浅”或“无变化”).
(Ⅱ)燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置.对于以强碱为电解质的CH4燃料电池,负极电极反应式为:
随着放电的进行,溶液的pH (填“变大”“变小”或“不变”)
(Ⅲ)由Cu2+、Cl﹣、Na+、SO42﹣四种离子中的两种离子组成的电解质溶液若干种,可选用铜电极、铂电极进行电解实验.
(1)要使电解过程中溶质的组成和质量不变,而该稀溶液的浓度增大,又无浑浊,应以 为阳极电解 溶液,阳极电极反应式为 .
(2)以铂作阳极电解 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解的总反应式为 .
22.按如图所示装置进行实验,并回答下列问题:
(1)判断装置的名称:
A池为 ,B池为 .
(2)锌极为 极,电极反应式为 ;铜极为 极,电极反应式为 ;石墨棒C1为 极,电极反应式为 ;石墨棒C2附近发生的实验现象为 .
(3)当C2极析出224mL气体(标准状况下),锌的质量变化为(增加或减少) g.CuSO4溶液的质量变化为(增加或减少) g.
(4)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:
用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO﹣,把二价镍氧化为三价镍.以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:
2Cl﹣﹣2e﹣=Cl2↑
d.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子.
23.如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:
铅蓄电池在放电时发生下列电极反应:
负极Pb+SO42﹣﹣2e﹣═PbSO4
正极PbO2+4H++SO42﹣+2e﹣═PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式 .
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为 极.
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g/cm3)时,
①若铅蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为 L.
②若消耗硫酸amol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出) (用含a的代数式表示).
24.如图所示表示的是电解饱和食盐水的装置,阴极材料是铁棒,阳极材料是碳棒,饱和食盐水中含有少量酚酞.
(1)接通电源后,饱和食盐水中的阳离子的移动方向是 (填“阴极”或“阳极”).
(2)电极上生成了气体A和B,生成气体A的电极反应式是 .
(3)随着气体的生成,饱和食盐水中产生了两种不同的颜色:
一种是 色,其产生的位置是 (填“阴极区”或“阳极区”);另一种是 色,其产生的位置是 (填“阴极区”或“阳极区”).
(4)电解一段时间后取出电极,将U形管内的液体搅拌混匀,又发生了化学反应,该反应的化学方程式是 ;该溶液可用作消毒剂,原因是 .
三.解答题(共3小题)
26.氢氧燃料电池是一种高效、低污染的新型电池,主要用于航天领域.它的电极材料一般为活性电极,具有很强的催化活性,如铂电极、活性炭电极等.该电池 为燃料, 为氧化剂,可用 性电解质(如稀H2SO4),也可用 性电解质(如 ).
当用酸性电解质时,电极反应为:
正极:
,
负极:
,
总反应:
.
当用碱性电解质时,电极反应式为:
正极:
,
负极:
,
总反应:
.